
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 5. 6. Разобщение дыхания и синтеза атфСодержание книги
Поиск на нашем сайте
Некоторые липофильные вещества (2,4-динитрофенол, некоторые лекарства, жирные кислоты) могут переносить ионы водорода через внутреннюю мембрану митохондрий в матрикс, минуя канал АТФ-синтазы. В результате этого снижается протонный градиент и прекращается синтез АТФ. Это явление называется разобщением, а вещества - разобщителями дыхания и фосфорилирования (рис. 5.9).
2,4-Динитрофенол протонируется в межмембранном пространстве, где концентрация протонов выше, и диффундирует через внутреннюю мембрану митохондрий в матрикс. В матриксе, где концентрация протонов ниже, 2,4-динитрофенол теряет протон, переходит в ионизированную форму и может возвращаться в межмембранное пространство Подобным образом действуют протонофоры, увеличивающие проницаемость мембраны для ионов Na+ и К+. При действии разобщающих факторов большая часть энергии выделяется в виде теплоты, количество АДФ и поглощение кислорода при этом увеличиваются. ИНГИБИТОРЫ ДЫХАНИЯ Некоторые лекарственные вещества, химические реагенты и антибиотики вызывают ингибирование ферментов, либо собственно дыхательной цепи, либо окислительного фосфорилирования. 1. Ингибиторы, блокирующие дыхательную цепь: барбитураты, ротенон - ингибиторы NADH-дегидрогеназы; антимицин А - ингибитор QH2-дегидрогеназы; СО, H2S, цианид - ингибируют цитохромоксидазу. 2. Антибиотик олигомицин не влияет непосредственно на перенос электронов, но ингибирует процесс фосфорилирования на уровне АТФ-синтазы. 33) Сопряжение процессов окисления и фосфорилирования в дыхательной цепи. Коэффициент Р/О. 1. Перенос электронов по ЦПЭ при участии комплексов I, III и IV сопровождается выделением наибольшего количества энергии (рис. 5.7). Часть этой энергии используется для переноса Н+ из матрикса в межмембранное пространство, в результате чего возрастает протонный электрохимический потенциал Δμ Η+, основной составляющей которого является протонный градиент (рис. 5.8). 2. При достижении определенного протонного градиента происходит активация АТФ-синтазы (комплекс V), в ней открывается канал, через который протоны возвращаются в матрикс из межмембранного пространства, а энергия ΔμΗ+ используется для синтеза АТФ. 3. Каждый из трех комплексов ЦПЭ (I, III, IV) обеспечивает необходимый протонный градиент для активации АТФ-синтазы и синтеза одной молекулы АТФ. Количество молекул АТФ, образованных при восстановлении одного атома кислорода до Н2О при прохождении двух электронов по ЦПЭ, эквивалентно количеству использованного фосфата Н3РО4(Р) и выражается коэффициентом окислительного фосфорилирования (Р/О). Если водород поступает в ЦПЭ от кофермента NADH, то Р/О имеет максимальное значение, равное 3. Если водород поступает от FAD-зависимых дегидрогеназ, то Р/О равен 2 (реальные значения Р/О несколько ниже, так как часть энергии электрохимического потенциала рассеивается в форме теплоты).
I - NADH - дегидрогеназа; III - QН2-дегидрогеназа; IV - цитохромоксидаза, V-АТФ-синтаза. Энергия протонного электрохимического потенциала используется для синтеза АТФ, если протоны возвращаются в матрикс через ионные каналы АТФ-синтазы При участии АТФ-АДФ транслоказы, расположенной во внутренней мембране митохондрий, АТФ транспортируется в цитоплазму в обмен на АДФ. В цитоплазме АТФ используется как источник энергии в различных процессах. 4. Таким образом, трансформация энергии в организме проходит следующие этапы.
34) Окислительное декарбоксилирование пировиноградной кислоты, значение этого процесса. 1. Первая реакция ОПК - реакция окислительного декарбоксилирования пирувата описывается следующим суммарным уравнением (рис. 5.14).
Эту реакцию катализирует сложно организованный пируватдегидрогеназный комплекс (ПДК). 1. Пируватдегидрогеназный комплекс (ПДК) состоит из трех типов каталитических протомеров, образующих три фермента: Е1 - пируватдекарбоксилазу, Е2 - дигидролипоилтрансацетилазу и Е3 - дигидролипоилдегидрогена- зу. Каждый фермент содержит разное количество протомеров. Протомеры каждого из трех ферментов содержат в своем составе прочно связанные с белками коферменты (табл. 5.2). Коферменты NAD+и HS-KoA включаются в состав комплекса только в момент реакций и освобождаются при завершении процесса в составе конечных продуктов - Ацетил-КоА и NADH + H+. Таблица 5.3. Пируватдегидрогеназный комплекс (ПДК) млекопитающих
Каждый фермент, входящий в ПДК, катализирует определенный этап реакции: I - Е1 - пируватдекарбоксилаза катализирует декарбоксилирование пирувата и перенос С2-фрагмента на ТДФ с образованием гидроксиэтила; II - Е2 - дигидролипоилтрансацетилаза катализирует окисление гидроксиэтильной группы и перенос С2-фрагмента на амид липоевой кислоты; III - ацетилированная трансацетилаза взаимодействует с HS-КоА с образованием восстановленной формы липоамида и ацетил-КоА; IV - восстановленная форма трансацетилазы дегидрируется дигидролипоилдегидрогеназой (Е3), содержащей FAD; V - FADH2 в составе Е3 дегидрируется при участии NAD+. В реакциях, катализируемых ПДК, липоевая кислота, связанная в ферменте Е2 с остатками лизина, функционирует как «поворотный кронштейн», переносящий атомы водорода и ацетильные остатки от одного фермента к другому 2. Ацетил-КоА, образовавшийся в реакции, катализируемой ПДК, далее вступает в цитратный цикл (рис. 5.16). 35). Цикл Кребса: последовательность реакций, связь с дыхательной цепью, биологическая роль. Цитратный цикл [цикл трикарбоновых кислот (ЦТК), цикл Кребса] - основной источник доноров водорода для ЦПЭ. Этот метаболический путь состоит из реакций, в результате которых ацетильный остаток ацетил-КоА окисляется до CO2 и Н2О. В ацетил-КоА связь между атомами углерода устойчива к окислению; включаясь в цитратный цикл, ацетильный остаток перестраивается и в конечном итоге,углерод ацетильной группы окисляется до двух молекул CO2, а атомы водорода, освобождающиеся в реакциях дегидрирования, доставляются в ЦПЭ при участии NAD- и FAD-зависимых дегидрогеназ. • Первая реакция цикла представляет собой конденсацию оксалоацетата с ацетил-КоА, катализируемую цитратсинтазой (рис. 5.17). В этой реакции выделяется большое количество энергии (AG = -8 ккал/моль), что сдвигает равновесие в сторону образования цитрата и определяет дальнейшее направление реакций ЦТК. На образование цитрата в каждом обороте цикла затрачивается одна молекула оксалоацетата; по завершении цикла происходит регенерация оксалоацетата. Таким образом, одна молекула оксалоацетата может многократно использоваться для окисления ацетильных остатков, выполняя функцию своеобразного катализатора цикла.
Цифры 1-8 обозначают реакции одного оборота цикла. На каждую молекулу NADH (реакции 3, 4, 8) в ЦПЭ синтезируется 3 молекулы АТФ; на каждую молекулу FADH2 (реакция 6) - 2 молекулы АТФ. Таким образом, каждый оборот цикла сопровождается синтезом 11молекул АТФ путем окислительного фосфорилирования; 1 молекула АТФ образуется за счет субстратного фосфорилирования (реакция 5)
• В одном обороте цикла, включающем 8 реакций, происходят 2 реакции декарбоксилирования с образованием 2 молекул CO2. В 4 реакциях цитратного цикла происходит дегидрирование с образованием восстановленных коферментов: 3 молекул NADH и 1 молекулы FADH2 в составе сукцинатдегидрогеназы. • Ацетильный остаток ацетил-КоА (С2) полностью окисляется в ЦТК, в результате чего в ЦПЭ синтезируется 11 молекул АТФ путем окислительного фосфорилирования (рис. 5.16). • Одна молекула АТФ в ЦТК синтезируется путем субстратного фосфорилирования (рис. 5.18).
В этой реакции донором энергии для синтеза ГТФ является молекула субстрата, поэтому такой способ синтеза ГТФ называется субстратным фосфорилированием. ГТФ и АТФ являются энергетическими эквивалентами.Энергия ГТФ может трансформироваться в энергию АТФ при участии нуклеозиддифосфаткиназы:
36) Углеводы пищи, их значение. Механизм переваривания. Всасывание продуктов. ПЕРЕВАРИВАНИЕ И ВСАСЫВАНИЕ 1. Основным источником углеводов организма являются углеводы пищи, к которым относится крахмал. Кроме того, в пище содержатся глюкоза, фруктоза, сахароза и лактоза. Крахмал представляет собой разветвленный полисахарид, мономером которого является глюкоза. Мономеры линейных участков соединены α1.4-гликозидными связями, а в местах разветвления α1,6-связью. Цепи между участками ветвления содержат примерно 24 мономера. Крахмал поступает в организм в составе растительной пищи. Лактоза содержится в молоке и является основным углеводом в питании грудных детей. Лактоза состоит из остатков D-галактазы и D-глюкозы, связанных β1,4-гликозидной связью. Сахароза - дисахарид растений, особенно ее много в сахарной свекле и сахарном тростнике. В сахарозе остатки D-глюкозы и D-фруктозы соединены α,β1,2-гликозидной связью. Мальтоза поступает с продуктами, в которых крахмал частично гидролизован (солод, пиво). Мальтоза состоит из двух остатков D-глюкозы, соединенных α1,4-гликозидной связью. Глюкоза и фруктоза являются моносахаридами и содержатся в меде и фруктах. Норма углеводов в питании составляет 400-500 г в сутки. Углеводы обеспечивают более 50% калорий, необходимых человеку в сутки. Пищевые углеводы - полимеры и димеры - подвергаются перевариванию в пищеварительном тракте под действием ферментов, которые гидролизуют гликозидные связи и образуют мономеры, способные всасываться, поступать в кровь, а затем в ткани (рис. 6.1). 2. Переваривание углеводов. Амилаза слюны расщепляет α1,4-гликозидные связи в крахмале. В ротовой полости происходит лишь частичное переваривание крахмала, так как действие фермента на крахмал кратковременно. Основными продуктами переваривания крахмала в ротовой области являются декстрины. Желудочный сок не содержит ферментов, расщепляющих пищевые углеводы. Амилаза слюны инактивируется в желудке, так как оптимальное
Ферменты тонкого кишечника, гидролизующие дисахариды, образуют фементативные комплексы, локализованные на поверхности энтероцитов: сахаразо-изомальтазный (включает сахаразу, мальтазу и изомальтазу), гликоамилазный (включает ферменты, расщепляющие олигосахариды и мальтозу), β-гликозидазный (проявляет активность лактазы)
|
|||||||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 308; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.137 (0.011 с.) |

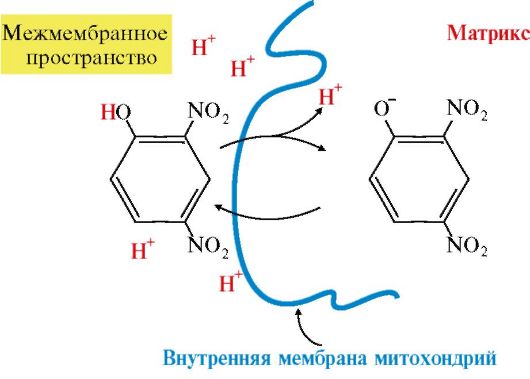 Рис. 5.9. Снижение протонного градиента под влиянием 2,4-динитрофенола.
Рис. 5.9. Снижение протонного градиента под влиянием 2,4-динитрофенола. Рис. 5.8. Сопряжение дыхания и синтеза АТФ в митохондриях.
Рис. 5.8. Сопряжение дыхания и синтеза АТФ в митохондриях.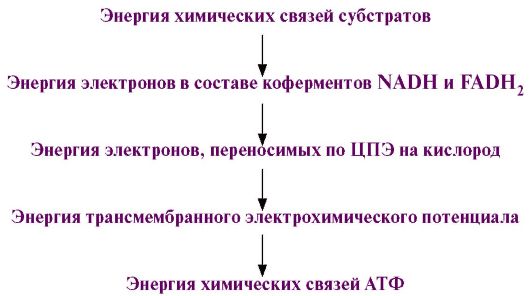 На всех этапах этого процесса часть энергии рассеивается в виде теплоты.
На всех этапах этого процесса часть энергии рассеивается в виде теплоты.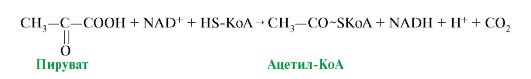 Рис. 5.14. Суммарное уравнение окислительного декарбоксилирования пирувата
Рис. 5.14. Суммарное уравнение окислительного декарбоксилирования пирувата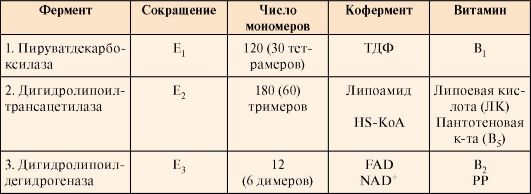 Все ферменты, входящие в состав комплекса, располагаются в пространстве таким образом, что обеспечивают одновременное протекание однотипных реакций в нескольких местах комплекса. Промежуточные метаболиты передаются от одного активного центра к другому, что делает работу ферментного комплекса максимально эффективной (рис. 5.15). В состав комплекса входят также регуляторные протомеры: киназа и фосфатаза ПДК, роль которых рассматривается в теме 5.11 (см. рис. 5.22).
Все ферменты, входящие в состав комплекса, располагаются в пространстве таким образом, что обеспечивают одновременное протекание однотипных реакций в нескольких местах комплекса. Промежуточные метаболиты передаются от одного активного центра к другому, что делает работу ферментного комплекса максимально эффективной (рис. 5.15). В состав комплекса входят также регуляторные протомеры: киназа и фосфатаза ПДК, роль которых рассматривается в теме 5.11 (см. рис. 5.22).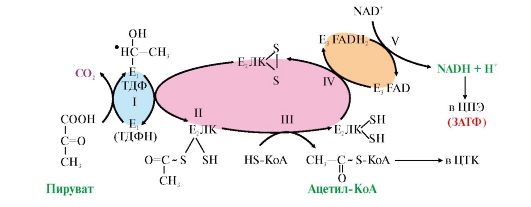 Рис. 5.15. Окислительное декарбоксилирование пировиноградной кислоты.
Рис. 5.15. Окислительное декарбоксилирование пировиноградной кислоты.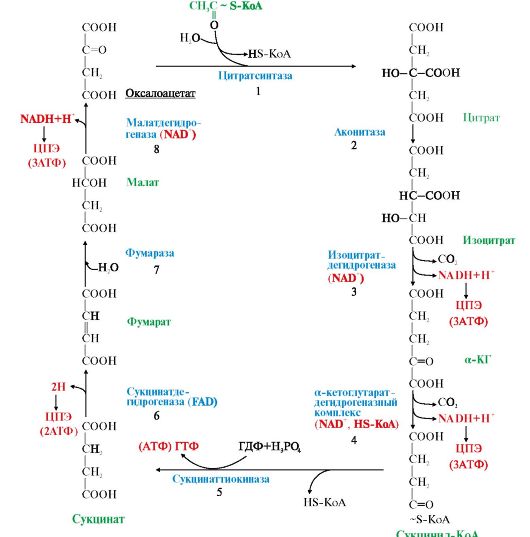 Рис. 5.16. Цитратный цикл.
Рис. 5.16. Цитратный цикл.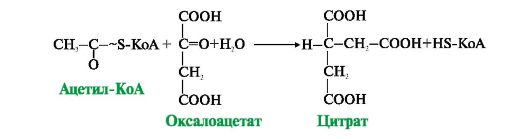 Рис. 5.17. Образование цитрата при участии цитратсинтазы
Рис. 5.17. Образование цитрата при участии цитратсинтазы Рис. 5.18. Субстратное фосфорилирование ГДФ
Рис. 5.18. Субстратное фосфорилирование ГДФ Следовательно, суммарный выход АТФ при окислении 1 молекулы ацетил-КоА составляет 12 молекул; из них 11 молекул образуется путем окислительного фосфорилирования и 1 путем субстратного.
Следовательно, суммарный выход АТФ при окислении 1 молекулы ацетил-КоА составляет 12 молекул; из них 11 молекул образуется путем окислительного фосфорилирования и 1 путем субстратного.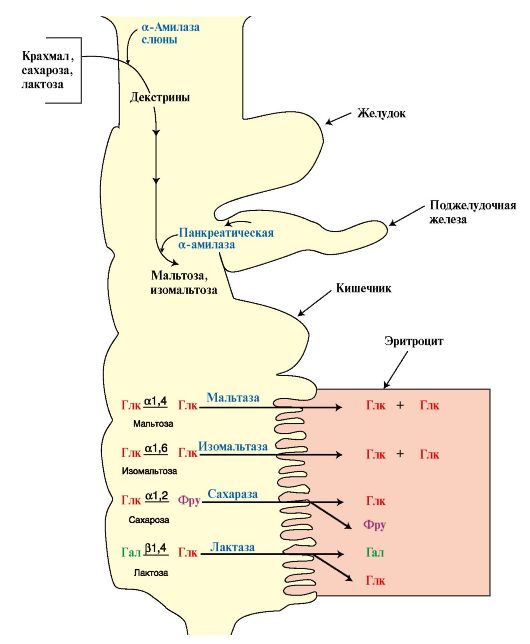 Рис. 6.1. Переваривание углеводов.
Рис. 6.1. Переваривание углеводов.


