
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Переход от нормальности к титру:
Расчет содержания определяемого вещества по титру исходного стандартного (титрованного) раствора реактива (Тв) или по титру, выраженному по определяемому веществу (Тв/а). Предположим, что при титровании методом отдельных навесок для анализа было растворено а граммов вещества А. Полученный раствор был оттитрован стандартным раствором реактива В, титр которого равен Тв. На титрование всего раствора пошло VB мл стандартного раствора. Требуется вычислить процентное содержание вещества А. Вычисления проводят исходя из положения, что 1 г-экв вещества А нацело реагирует с 1 г-экв вещества В. Количество граммов реактива В, пошедшего на реакцию с определяемым компонентом, равно:
Рассмотренный метод вычисления общего содержания определяемого вещества по титру исходного раствора имеет значение при ] титровании различных веществ одним и тем же стандартным раствором. При массовом титровании одинаковых веществ удобнее выражать титр исходного стандартного раствора в граммах определяемого вещества А (ТВ/а), количество которого соответствует 1 мл стандартного раствора реактива В. Существенное отличие такого способа выражения концентрации исходного стандартного раствора состоит в том, что титр стандартного (титрованного) раствора реактива выражают в граммах определяемого вещества. Тв/а показывает, сколько граммов определяемого вещества (А) реагирует в процессе титрования с 1 мл раствора реактива (В). Тв/а — титр по определяемому веществу выражают в граммах определяемого вещества, количество которого эквивалентно количеству вещества, содержащегося в 1 мл стандартного раствора, т. е. величина Тв/а показывает, сколько граммов определяемого вещества эквивалентно (равноценно) количеству вещества стандартного раствора реактива, содержащемуся в 1 мл его раствора. Например, TAgNo3 = 0,001699 г/мл означает, что в 1 мл исходного стандартного раствора нитрата серебра содержится 0,001699 2 AgN03, TAgNo3/HCI = 0,0003646 г/мл, TAgNo3/cr = =0,0003546 г/мл, ТАgNо3/вг = 0,0007992 г/мл и TAgNo3/I- = 0,001269 г/мл соответственно означают, что 1 мл исходного стандартного раствора, содержащего 0,001699 г AgN03, эквивалентен 0,0003646 г HC1, 0,0003546 г хлорид-ионов, 0,0007992 г бромид-ионов и 0,001269 г иодид-ионов. Титры одного и того же раствора, выраженные различными способами, зависят от величин грамм-эквивалентов стандартного и определяемых веществ. Эту зависимость выражают следующей формулой:
Пользуясь этой формулой, можно вычислить титр раствора по определяемому веществу:
где
Для расчета содержания определяемого компонента необходимо титрстандартного раствора умножить на аналитический объемный фактор и на объем стандартного (титрованного) раствора, израсходованного на титрование анализируемого образца:
или в процентах:
Кривые титрования В процессе титрования изменяются равновесные концентрации вещества, титранта и продуктов реакции. При этом пропорционально концентрациям этих веществ изменяются свойства раствора. Например, при окислительно-восстановительном титровании изменяются равновесные концентрации окислителя и восстановителя и, следовательно, потенциал; при изменении концентраций компонентов кислотно-основной реакции изменяется рН раствора. График зависимости параметра системы, связанного с концентрацией титруемого вещества, титранта или продукта, от состава раствора в процессе титрования называют кривой титрования. Кривые титрования помогают выбрать индикатор, оценить погрешность, наглядно проследить за ходом титрования. При построении кривых по осям координат можно откладывать разные величины. Если по оси ординат отложить логарифм концентрации (или отношения концентраций) или величину, пропорциональную этому логарифму, получаются логарифмические кривые титрования.(рН или Е) будет определяться отношением концентраций сопряженной пары. Кривые, по оси ординат которых отложен логарифм отношения концентраций (или пропорциональная ему величина), называют часто билогарифмическими Монологарифмические кривые, В любой момент титрования до ТЭ концентрацию титруемого вещества можно представить так:
Концентрация титранта в растворе до ТЭ ничтожно мала, поскольку при высоком значении константы реакции (а это одно из условий титрования) титрант практически весь тратится на взаимодействие с А. За ТЭ концентрация А ничтожно мала, поэтому за ходом титрования следят по изменению равновесной концентрации титранта.
Формулы можно упростить. 1. Если концентрация титранта значительно выше концентрации определяемого вещества, то множитель V 0 /(V 0 + VT) мало отличается от единицы и выражения упрощаются до [ А]=с0(1- f), [ Т] = ст(f -1), или в логарифмической форме lg[A] = lgc0 + lg(l-f), lg[T] = lgcT + lg(f-l). 2. Если с0 3. 4. 3. Если с0 За ТЭ можно выразить [А] через [Т], воспользовавшись для этого константой реакции титрования Кт. Для кислотно-основных реакций Kt = [ H 3 0+][ OH - ] = Kw и P H = pKw + lgcT + lg(f-l); для реакций осаждения КТ = [А][В]=К, И P A = pKS + lgcr + lg(f-l); для реакции комплексообразования
pM = lg поскольку за ТЭ [ML] В ТЭ рассчитываемый параметр определяется только константой реакции титрования, например для кислотно-основных реакций рН = ½ р KW, Для реакций осаждения рА = ½ р KS, для комплексообразования pM = ½ lg Билогарифмические кривые. Выражая отношение концентраций компонентов сопряженной пары через известные величины, получаем до ТЭ: Для определения параметра, меняющегося при титровании, пользуются константой соответствующей реакции. Например, в кислотно-основном титровании это константы кислотности Ка или основности К b
H = За ТЭ ветви кривых представляют собой монологарифмические кривые. При рассмотрении конкретных методов титрования мы остановимся на вычислении соответствующих параметров за ТЭ и в ТЭ. Логарифмические кривые имеют S-образную форму. На кривых имеются области плавного (до и после ТЭ) и резкого (вблизи ТЭ) изменения рассчитываемого (или измеряемого) параметра. Область резкого изменения называют скачком титрования. Границы скачка устанавливаются в зависимости от заданной точности титрования. Чем выше требования к точности определения, тем уже скачок титрования. На величину скачка влияет ряд факторов: константа равновесия реакции, концентрация веществ, температура, ионная сила и др. При визуальном обнаружении ТЭ пользуются индикаторами. Это вещества, окраска которых изменяется при определенном значении параметра. Индикатор выбирают так, чтобы его окраска изменялась в пределах установленного скачка титрования (не обязательно в ТЭ). При этом точка изменения окраски индикатора (конечная точка титрования, КТТ) не совпадает с ТЭ, что вызывает погрешность титрования (положительную, если титрование заканчивается после достижения ТЭ, и отрицательную, если раньше). Очевидно, что для правильного выбора индикатора и оценки погрешности титрования необходимо построение кривой титрования. Кривую титрования можно охарактеризовать крутизной, которая является мерой чувствительности и точности титрования: Alg[A]
где
Для выбора индикатора нет необходимости строить всю кривую: достаточно рассчитать значение параметра на границах заданного скачка, исходя из требуемой точности определения. Однако кривые дают наглядную картину процесса.
|
|||||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 112; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.171.136 (0.017 с.) |
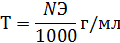

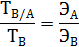
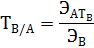
 величина постоянная; ее называют аналитическим множителем {фактором) объемного анализа и обозначают F. Следовательно
величина постоянная; ее называют аналитическим множителем {фактором) объемного анализа и обозначают F. Следовательно = F
= F 
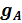 = F
= F 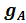 =
= 
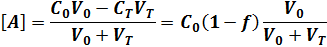

 ст,то
ст,то


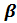 + lg(f-l)-lgc0 + lgcT, (9.15)
+ lg(f-l)-lgc0 + lgcT, (9.15)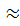 с0.
с0.

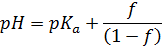
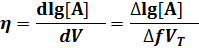
 ] — индекс крутизны; dV — объем, пошедший на изменение dlg[A]. Максимальное значение
] — индекс крутизны; dV — объем, пошедший на изменение dlg[A]. Максимальное значение 


