
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Значение аналитической химииСтр 1 из 7Следующая ⇒
ЗНАЧЕНИЕ АНАЛИТИЧЕСКОЙ ХИМИИ Аналитическая химия имеет важное научное и практическое значение. Почти все основные химические законы были открыты с помощью методов аналитической химии. Состав различных материалов, изделий, руд, минералов, лунного грунта, далеких планет н других небесных тел установлен методами аналитической химии. Открытие целого ряда элементов периодической системы {аргона, германия и др.) оказалось возможным благодаря применению точных методов аналитической химии. Ни одно современное химическое исследование, будь это синтез новых веществ, разработка новой технологической схемы, интенсификация производства, повышение качества продукции и т. д.. не может обойтись без применения методов аналитической химии. Существенное значение для многих технологических процессов имеет контроль производства, осуществляемый методами аналитической химии. Так например, правильно составить шихту в металлургическом, стекольном или ином производстве можно только зная состав исходных материалов. МЕТОДЫ АНАЛИТИЧЕСКОЙ ХИМИИ Методы аналитической химии могут бить классифицированы на основе различных принципов. Можно классифицировать методы в зависимости от массы вещества, которая используется в анализе. В макрометодах для анализа требуется 0,1 г вещества и больше, полумикрометодах 0.1...0,01 г, микрометодах 0,01-..10-3 г, ультра микро методах 10 -6 г и субмнкро - методах 10-9г. Методы, в которых используют 10—9 г и менее, применяют в анализе различных биологических проб, препаратов с высокой радиоактивностью, сильной токсичностью и т.д. Техника выполнения анализа в этих методах существенно усложняется: аналитические операции производят с помощью специальных манипуляторов и нередко под микроскопом. Классические методы В основе химических методов обнаружения и определения лежат химические реакции трех типов: кислотно-основные, окислительно-восстановительные и комплексообразования. Иногда они сопровождаются изменением агрегатного состояния компонентов. Наибольшее значение среди химических методов имеют гравиметрический и титриметрический. Эти аналитические методы называют классическими. Критериями пригодности химической реакции как основы аналитического метода в большинстве случаев являются полнота протекания и большая скорость.
Классические методы постепенно уступают место инструментальным. Однако они остаются непревзойденными по точности: относительная погрешность определения редко превышает 0,1—0,2%, тогда как погрешность многих инструментальных методов — 2—5%. Классические методы по-прежнему являются стандартными для оценки правильности определений. Основная область применения гравиметрии и титриметрии — прецизионное определение больших и средних количеств веществ. Гравиметрические методы Гравиметрический анализ заключается в выделении вещества в чистом виде и его взвешивании. Чаще всего такое выделение проводят осаждением. Реже определяемый компонент выделяют в виде летучего соединения (методы отгонки). В ряде случаев гравиметрия — лучший способ решения аналитической задачи, например при анализе образцов с содержанием определяемого компонента более 0,1%, особенно если требуется проанализировать ограниченное число проб. Погрешность определения не превышает 0,1—0,2%. Гравиметрия — это абсолютный (безэталонный) метод. Недостатком гравиметрических методов:-является длительность определения, особенно при серийных анализах большого числа проб, а также неселективность — реагенты-осадители за небольшим исключением редко бывают специфичными. Поэтому часто необходимы предварительные разделения. Сущность метода Аналитическим сигналом в гравиметрии является масса. Хотя в названии метода присутствует слово «вес», однако измеряемой величиной служит более фундаментальная характеристика — масса, не зависящая от географической широты. Массу находят, сравнивая с другой, известной, массой при помощи весов. Поскольку вес w и масса т связаны соотношением w = mg, а величина g постоянна, при взвешивании получают сравнительную оценку массы или веса. По традиции получаемую величину называют «весом», а процесс ее нахождения «взвешиванием». Известные массы, определенные с большой точностью, оформляют обычно в виде металлических гирек и называют разновесками. Гравиметрическое определение состоит из нескольких этапов:
1. Осаждение соединения, содержащего определяемое вещество (его называют осаждаемой формой ). 2. Фильтрование полученной смеси для отделения осадка от надосадочной жидкости. 3. Промывание осадка для удаления надосадочной жидкости и адсорбированных примесей с его поверхности. 4. Высушивание при низкой температуре для удаления воды или при высокой температуре для превращения осадка в более подходящую для взвешивания форму (гравиметрическую форму ). 5. Взвешивание полученного осадка. Большинство аналитических методов использует зависимость между измеряемым физическим свойством у и количеством определяемого вещества (или его концентрацией), которая в идеальном случае (отнюдь не всегда) линейна: с = ку, 1 где к — константа. Обычно значение к находят эмпирически, измеряя сигнал у от одного или более образцов с известной концентрацией. Из этого правила есть два исключения: гравиметрический и кулонометрический методы анализа. В гравиметрии к — это гравиметрический фактор F, который можно рассчитать непосредственно из общеизвестных констант. В общем случае:
в - молекулярная масса гравиметрической формы где а и в— числа, необходимые для уравнивания числа молей определяемого вещества в числителе и знаменателе (табл. 1). Таблица.1. Гравиметрические факторы
К осадкам в гравиметрии предъявляют ряд довольно жестких требований. Требования к осаждаемой форме. 1. Осадок должен быть практически нерастворимым. Определяемый компонент должен выделяться в осадок количественно, при этом его концентрация в растворе после осаждения не должна превышать 10-6 М. Осаждение считается количественным, когда остаточное количество осаждаемого вещества лежит за пределами точности взвешивания на аналитических весах (0,0002 г). 2. Осадок должен выделяться в форме, удобной для его отделения от раствора и промывания, и по возможности быть крупнокристаллическим, если он кристаллический, или хорошо скоагулированным, если он аморфен. Важно, чтобы он был однородным по дисперсности 3. Осадок должен быть чистым, т. е. не содержать посторонних примесей. Требования к гравиметрической форме. 1. Гравиметрическая форма должна быть стехиометрическим соединением известного состава. 2. Она должна быть устойчива. 3. Желательно, чтобы значение F было мало (для снижения относительной погрешности результата определения нужного компонента). Для выполнения этих требований необходимо соблюдать условия, которые легко сформулировать, если разобраться в механизме образования осадка. Образование осадка При добавлении реагента-осадителя к раствору осаждаемого вещества образования твердой фазы не наблюдается более или менее длительный период. Даже если достигнуто произведение растворимости, т. е. содержание осаждаемого вещества равно или превышает растворимость, система остается гомогенной. Раствор, концентрация которого выше растворимости, является пересыщенным. Такой раствор метастабилен, хотя и может существовать в отсутствие центров кристаллизации (которыми могут быть, например, пылинки) долгое время. Он играет роль переходного состояния. Для пересыщенного раствора существует некоторая предельная концентрация, называемая сверхрастворимостью, выше которой система становится неустойчивой, появляются мельчайшие твердые частицы — зародыши, и система из гомогенной переходит в гетерогенную.
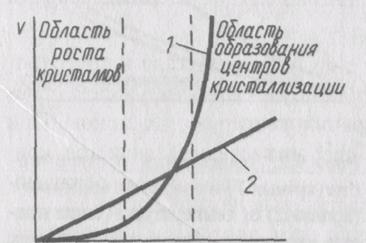
Растворимость и сверхрастворимость зависят от температуры и природы вещества (рис. 1). В области ниже кривой 1 раствор ненасыщен, область между кривыми 1 и 2 является метастабильной, в области над кривой 2 получаются зародыши, которые растут по мере добавления к раствору осадителя. Если добавлять к раствору осаждаемого иона осадитель в количестве, не превышающем сверхрастворимость, то осадка сначала не будет, затем при достижении сверхрастворимости (точка b на кривой 2) образуются первые зародыши. Если теперь добавить осадитель в количестве, не превышающем сверхрастворимость (до концентрации х ), новые зародыши не образуются, и осадитель тратится на рост уже имеющихся частиц.
Рис.. 1 Зависимость растворимости (кривая 1) и сверхрастворимости (кривая 2) от температуры (такие кривые характерны для кристаллических осадков типа BaS04). Пунктиромпоказана кривая сверхрастворимости скрытокристаллического (или аморфного) осадка типа AgCl. В этом случае следует ожидать образования крупнокристаллического осадка. В противном случае, если сверхрастворимость будет превышена сразу или же будет постоянно превышаться при добавлении осадителя (до у ), то будут появляться все новые зародыши, на рост их не хватит вещества — в результате осадок будет мелкодисперсным. Например, несмотря на близкую растворимость осадков BaS04 (KS= 1,3 10-10) и AgCl (KS= 1,8-10-10), сверхрастворимость для BaS04 больше растворимости в 30 раз, а для AgCl менее чем в 2 раза. Превысить сверхрастворимость для AgCl легче, чем для BaS04, в результате осадок сульфата бария — кристаллический, AgCl — аморфный, состоящий из множества мелких частиц. Ясно, что сверхрастворимость малорастворимых осадков легко превысить, даже если она достаточно сильно отличается от растворимости и осадитель добавлять маленькими порциями. Таким образом, дисперсность осадка определяется двумя процессами — образованием зародышей и ростом частиц. Скорость обоих процессов зависит от пересыщения.
Обозначим концентрацию растворенного вещества в какой-либо момент времени Q растворимость в состоянии равновесия s. Тогда пересыщение равно Q-s.Удобнее оперировать относительным пересыщением (Q-s)/s Скорость образования зародышей v1 и скорость роста v2 зависят от относительного пересыщения следующим образом:
Рис. 2 Влияние относительного пересыщения на скорость образования новых центров кристаллизации (кривая 1) и скорость роста кристаллов (кривая 2) где к1 и к2 — константы (обычно к2 > к1,), и близко к 4. Очевидно, что при низком относительном пересыщении доминирует рост частиц, а при высоком — образование новых центров кристаллизации (рис. 2). Образование зародышейможет быть спонтанным (гомогенная нуклеация) и индуцированным (гетерогенная нуклеация). При гомогенной нуклеации зародыш появляется в результате скопления около одного центра группы ионов или ионных пар (под действием химических сил). При гетерогенной нуклеации ионы собираются вокруг посторонней твердой частицы (затравки, например пылинки); при этом ионы (или ионные пары) диффундируют к поверхности затравки и адсорбируются на ней. На практике имеет место гетерогенная нуклеация, поскольку в растворе всегда достаточно посторонних твердых частиц. К сожалению, основные теоретические положения относятся к спонтанной нуклеации. Рассмотрим образование зародышей с термодинамической и кинетической точек зрения. Зародыш — очень маленькая частица, поэтому большинство образующих его ионов находится на внешней части — гранях, ребрах, углах. Такие ионы обладают повышенной свободной энергией, так как силы, действующие со стороны свободных ионов, больше, чем со стороны растворителя. Зародыш с максимальным поверхностным натяжением называется критическим. Он играет роль активированного комплекса в химической реакции. Все зародыши, не достигшие критического размера, распадаются, а достигшие его —растут. Процесс образования зародышей проходит индукционный период, продолжительность которого зависит от концентрации и природы ионов:
где n = 2,5—9. Относительно размеров критического зародыша нельзя сделать категорического утверждения. На основании термодинамического подхода (исходя из значений поверхностного натяжения) он должен содержать около ста ионов. Если же исходить из прямой зависимости индукционного периода от скорости образования зародышей, то критический зародыш должен быть очень небольшим (от 2 до 9 ионов), например (CaF2)3, (BaS04)4. И тот и другой подходы основаны на допущениях, вряд ли приемлемых для окончательных решений. Рост частиц включает две стадии: диффузию вещества к поверхности и кристаллизацию. Какая из этих стадий будет лимитирующей, зависит от скорости осаждения и концентрации реагирующих ионов. При медленном осаждении лимитирующей скорость стадией является кристаллизация, частица при этом окружена однородным слоем осаждающихся ионов и в результате получаются кристаллы более или менее правильной формы. При высоких концентрациях ионов лимитирующей стадией может стать диффузия. Тогда подвод вещества к углам и ребрам будет больше, чем к граням. В результате получаются нити, усы, дендриты, кристаллы неправильной формы с большой поверхностью.
К искажению правильной формы приводят также дефекты в кристаллах (трещины, винтовая дислокация и др.). В этом случае новые ионы стараются занять места подальше от углов и ребер, поскольку угловые и реберные ионы обладают наибольшей поверхностной энергией. В результате грань кристалла растет ступеньками. На практике кристаллы всегда несовершенны.
Коллоидное состояние В процессе роста размер частиц изменяется. Частицы диаметром 10-7-10-4 см образуют коллоидную систему; таким образом, процесс образования осадка обязательно включает стадию коллоидообразования. Коллоидные системы бывают лиофобными и лиофильными. Лиофобные системы имеют малое сродство к растворителю и разрушаются под действием электролитов. Раствор лиофобного коллоида называют золем. Обычно это дисперсные системы неорганических веществ (золи серы, золота, сульфидов металлов). Осадки, получающиеся из золей, содержат мало растворителя. Лиофилъные системы, напротив, обладают высоким сродством к растворителю и мало чувствительны к электролитам, а осадки сильно сольватированы. Такие системы обычно образуют органические вещества (белки, крахмал, желатин). Иногда лиофобные коллоиды имеют внешние признаки лиофильного коллоида. Таковы сильно гидратированные оксиды металлов, кремниевая и оловянная кислоты. Свойства коллоидных систем определяются процессами, происходящими на поверхности частиц: их размеры столь малы, а удельная поверхность (отношение общей поверхности к массе осадка) столь велика, что именно эти процессы, которыми можно пренебречь в крупнодисперсных системах, здесь выступают на первый план. Ионы на поверхности обладают повышенной свободной энергией, что приводит к адсорбции ионов из раствора и образованию электрически заряженных частиц. Одноименно заряженные частицы отталкиваются. Это и является одной из причин устойчивости коллоидного состояния. Например, в кубическом кристалле AgCl каждый ион серебра внутри кристалла окружен шестью хлоридионами, на поверхности же кристалла (особенно на гранях и в углах) ионы имеют частичный остаточный заряд. Поэтому, хотя в целом поверхность незаряжена, на ней локализованы положительные и отрицательные заряды. Знак и величина заряда поверхности частицы сложным образом зависят от ряда факторов. Руководствуясь полуэмпирическими правилами, можно предсказать, какие ионы будут адсорбироваться предпочтительнее. Основное правило — ионы, входящие в состав осадка, адсорбируются сильнее, чем посторонние ионы, а из двух собственных ионов адсорбируется тот, концентрация которого больше. Например, при осаждении AgCl добавлением NaCl к раствору AgN03 осадок сначала будет адсорбировать ионы серебра (частицы приобретают положительный заряд), а затем при избытке NaCl — хлорид-ионы (частицы приобретают отрицательный заряд). Очевидно, что осаждение проходит через изоэлектрическую точку, в которой суммарный заряд частицы равен нулю. Эта точка, как правило, не совпадает с точкой, где реагенты добавлены в стехиометрических количествах: действительно, собственные ионы адсорбируются с разной силой. Например, AgCl сильнее адсорбирует хлорид-ионы, и изоэлектрическая точка AgCl лежит при pAg+ = 4,0 и рС- = 5,7. Ионы, связанные непосредственно с поверхностью, образуют первичный адсорбционный слой, их называют потенциалопределяющими ионами. Поверхность имеет некоторый потенциал y 0 (не поддающаяся измерению величина). Под действием электростатических сил к первичному адсорбированному слою притягивается эквивалентное количество противоионов. Противоионы не могут приблизиться к поверхности ближе, чем на определенное предельное расстояние S, которое зависит от радиуса ионов. За предельным расстоянием плотный слой противоионов, соприкасающийся с поверхностью, переходит в диффузный слой. На расстоянии d от поверхности y 0 уменьшается до y d, а за пределами этого расстояния в диффузном слое потенциал экспоненциально уменьшается до нуля (рис3).
Рис. 3. Строение двойного электрического слоя мицеллы Поверхность, заряженная благодаря первично адсорбированным ионам, и слой противоионов составляют двойной электрический слой. В него входит также слой ориентированных молекул растворителя, который при движении частиц ведет себя так, как будто он является частью твердой фазы. На внешней границе слоя растворителя и всей массы раствора (плоскости скольжения) возникает потенциал, называемый электрокинетическим (или дзета- ) потенциалом, который можно измерить экспериментально (по скорости движения коллоидных частиц в электрическом поле). Устойчивость коллоидной системы определяется толщиной двойного электрического слоя и величиной дзета-потенциала. Старение осадка После образования осадка с ним происходит ряд необратимых физико-химических процессов, приводящих к уменьшению энергии и структурным изменениям и называемых старением осадка. Важнейшими из этих процессов являются перекристаллизация первоначально получившихся частиц, переход метастабильных состояний в стабильные, термическое старение вследствие теплового движения ионов, химическое старение в результате изменения состава осадка. Все эти процессы играют важную роль при проведении гравиметрического анализа и в большинстве случаев благоприятно влияют на гравиметрические свойства осадков. При перекристаллизации кристаллы растворяются и осаждаются снова. Скорость перекристаллизации определяется соотношением скоростей обоих процессов, поэтому она зависит от природы осадка и условий. С ростом растворимости растет скорость всего процесса, следовательно, подкисление маточного раствора и повышение температуры способствуют перекристаллизации. Более растворимые осадки перекристаллизовываются быстрее, однако кинетический фактор может оказаться решающим. Например, бромид серебра перекристаллизовывается очень быстро, а гидрат оксида железа (Ш) — месяцами, но в то же время сульфат бария, с растворимостью близкой к бромиду серебра, изменяется гораздо медленнее AgBr, поскольку константа скорости растворения BaS04 меньше, чем у AgBr. Одним из процессов, протекающих при перекристаллизации, является оствалъдовское созревание— перенос вещества от мелких частиц к крупным. Поверхностное натяжение у мелких частиц больше, чем у крупных, поэтому мелкие частицы растворяются, а крупные растут за их счет. Оствальдовское созревание характерно для веществ с высоким поверхностным натяжением (BaS04, РЬСrO4). Перекристаллизация осадков, в которой частицы слабо связаны между собой, например AgCl, приводит к укреплению контактов, возникающих между частицами при коагуляции, вследствие оседания дополнительных ионов в местах их сцепления и удаления слабо связанной воды. При этом устойчивость к пептизации повышается. Возникновение мостиков между частицами приводит к получению легко фильтрующихся агрегатов (друз). При перекристаллизации структура кристалла совершенствуется, исправляются дефекты, осадок очищается от посторонних ионов. Термическое старение связано с колебанием ионов в решетке. Амплитуда колебаний увеличивается при повышении температуры. При этом ионы, которые при осаждении по каким-то причинам не встали на положенное им место, могут занять его и остаться там, поскольку оно отвечает минимуму свободной энергии; примеси выталкиваются и, если они летучи, удаляются. Наиболее эффективно термическое старение при температуре, в два раза меньшей температуры плавления. Особый случай старения наблюдается для оксалата кальция, который при комнатной температуре осаждается в виде смеси дигидрата и тригидрата. При нагревании эти продукты становятся метастабильными по отношению к моногидрату. В результате превращения метастабилъных модификаций в устойчивую форму — моногидрат — соосажденные примеси при нагревании в основном удаляются. При химическом старении осадок может перейти в другую кристаллическую модификацию или полимеризоваться. Один из видов химического старения наблюдается в случае осадков гидратированных оксидов. Например, рентгенографическое исследование аморфного осадка гидратированного оксида алюминия, полученного при комнатной температуре, обнаруживает структуру бёмита — у-А1203 • Н20. При старении бёмит превращается в байерит — ог-А1203-ЗН20 — метастабильный гидрат, который очень медленно переходит в стабильную форму у- А1203 • ЗН20 (гиббсит). Наконец, при высоких температурах образуется негигроскопичный продукт алунд — а- А1203. Оксалат магния проявляет склонность к образованию пересыщенного раствора, вероятно, вследствие довольно высокой растворимости, а также комплексообразования с избытком С202-4. Выпавшие частицы СаС204 nН20 служат зародышами для осадка MgC204: на их поверхности адсорбируются оксалат-ионы, концентрация которых оказывается достаточной для превышения произведения растворимости MgC204. В результате наблюдается замедленное осаждение оксалата магния. При гравиметрических определениях совместное и последующее осаждение сводят к минимуму путем предварительного разделения и правильного выбора условий осаждения. Основной причиной загрязнения является соосаждение. Соосаждение — это загрязнение осадка веществами, которые в данных условиях должны оставаться в растворе; другими словами, при соосаждении происходит захват примесей из ненасыщенного раствора. Например, осадок BaS04, полученный при добавлении раствора ВаС12 к раствору Na2S04, содержит примеси ионов, входящих в состав и осадителя, и осаждаемого вещества. Примеси могут оказаться на поверхности осадка { адсорбция) и внутри его { абсорбция). Соосаждение По механизму захвата посторонних веществ различают несколько видов соосаждения: адсорбцию, окклюзию, образование твердого раствора (изоморфное соосаждение). Адсорбция. Причиной адсорбции является нескомпенсированность заряда ионов на поверхности кристаллов. Очевидно, что адсорбция — главный источник загрязнения мелкодисперсных осадков, поскольку общая площадь их поверхности очень велика. Адсорбция — экзотермический процесс, поэтому повышение температуры снижает степень загрязненности осадка. Существует ряд правил, определяющих, какие из ионов будут адсорбироваться предпочтительнее. 1. Правило Панета—Фаянса—Хана: из двух одинаково заряженных ионов равной концентрации преимущественно адсорбируется тот, который сильнее притягивается ионами кристалла. Сила ионного притяжения тем больше, чем ниже растворимость соединения, образуемого этим ионом с ионом решетки, чем больше степень ковалентности связи, чем больше поляризуемость аниона и поляризующая сила катиона. Сильнее всего притягиваются собственные ионы осадка. В результате поверхность частиц заряжается (положительно или отрицательно) и из раствора адсорбируются противоионы. Например, на поверхности иодида серебра в присутствии нитрата серебра и ацетат-ионов адсорбируются ионы серебра, а в качестве противоионов — ацетат-ионы, поскольку растворимость ацетата серебра ниже, а степень ковалентности выше, чем у нитрата серебра. Схематически запишем это так: AgI• Ag+ CH3COO-. 2. При прочих равных условиях преимущественно адсорбируется ион, концентрация которого больше. При этом может оказаться, что посторонний ион адсорбируется предпочтительнее собственного (специфическая адсорбция). Однако в гравиметрическим анализе всегда имеются в избытке ионы осадка: до осаждения — ионы осаждаемого вещества, после формирования осадка — ионы осадителя. Поэтому в первую очередь осадок адсорбирует собственные ионы, а какие именно, зависит от их концентрации. Неорганические осадители
Для осаждения применяют неорганические и органические реагенты. Последние, как правило, более селективны. Осадки соединений с органическими лигандами легко фильтруются и очищаются при промывании. Гравиметрические факторы обычно малы, поскольку органические молекулы имеют большую молекулярную массу. Эти осадки негигроскопичны. Определение органических соединений. Гравиметрия имеет ограниченное применение в аналитической химии органических веществ. Однако описан ряд избирательных реакций на некоторые функциональные группы Иногда используют различные предварительные операции. Например, салициловую кислоту определяют по реакции с иодом.
. Органические осадители
Методы отгонки Титриметрические методы Сущность титриметрии Вещества реагируют между собой в эквивалентных количествах (п1 = n2). Так как n = cV C 1 V 1 = C 2 V 2 Следовательно, можно найти неизвестную концентрацию одного из веществ (пусть с2), если известны объем его раствора и объем и концентрация прореагировавшего с ним вещества. Зная молекулярную массу эквивалента М, находят массу вещества: т2= c 2 MV 0 10 -3 Чтобы зафиксировать конец реакции, который называют точкой стехиометричности, или точкой эквивалентности (ТЭ), раствор с известной концентрацией вещества (его называют титрантом, Т) постепенно, небольшими порциями, добавляют к раствору определяемого вещества А. Этот процесс называют титрованием. После добавления каждой порции титранта в растворе устанавливается равновесие реакции титрования аА+ t Т = продукты Реакция титрования должна отвечать следующим требованиям: Протекать быстро; Для прямого титрования
Для обратного титрования тА(в аликвоте) = (ст1 V т1 1 - ст2 V Т2 )МА •10-3. Для нахождения процентного содержания следует учесть массу навески т: wA,% = Метод отдельных навесок заключается в том, что п навесок вещества (m1,m2,и т. д.), взятых на аналитических весах, растворяют в небольших объемах растворителя (знать их нет необходимости) и проводят титрование в каждом растворе. В этом случае количество вещества в каждой навеске равно Метод пипетирования более экспрессен и менее трудоемок, но и менее точен, чем метод отдельных навесок. Стандартные растворы Для титриметрического определения необходимо знать концентрацию титранта. Титрант с известной концентрацией называют стандартным раствором. По способу приготовления различают первичные и вторичные стандартные растворы. Первичный стандартный раствор готовят растворением точного количества чистого химического вещества известного стехиометрического состава в определенном объеме растворителя. Вторичный стандартный раствор получают следующим образом: готовят раствор с приблизительной концентрацией, близкой к желаемой, и определяют его концентрацию (стандартизируют) по подходящему первичному стандартному раствору. Первичные стандартные вещества должны отвечать ряду требований. 1.Состав соединения должен строго соответствовать химической формуле. Оно либо выпускается промышленностью в высокочистом состоянии, либо легко подвергается очистке простыми методами, например перекристаллизацией. Содержание примесей не должно превышать 0,05%, что примерно соответствует относительному стандартному отклонению при измерении массы навески. 2. Вещество должно быть устойчивым при комнатной температуре; вещества гигроскопичные или легко окисляющиеся атмосферным кислородом или поглощающие диоксид углерода непригодны. Вещество не должно претерпевать изменения при высушивании. Поэтому первичное стандартное вещество должно быть по возможности безводным и нелетучим. Можно использовать и кристаллогидрат, если его довести до определенной степени гидратации путем длительного выдерживания в атмосфере с постоянной относительной влажностью и затем сохранить эту степень гидратации во время взвешивания. 3.Вещество должно обладать по возможности большой молекулярной массой, чтобы уменьшить влияние неизбежной погрешности взвешивания. Для приготовления многих стандартных растворов можно воспользоваться фиксаналами. Фиксанал представляет собой ампулу, в которой запаяно точно известное количество стандартного вещества или раствора. Для приготовления раствора известной концентрации нужно разбить ампулу над специальной воронкой с пробивным устройством, перенести содержимое ампулы в мерную колбу подходящего объема и разбавить водой до метки. Однако, чтобы застраховаться от случайных погрешностей, следует стандартизировать даже приготовленный таким образом раствор и периодически повторять стандартизацию (за исключением тех случаев, когда известно, что раствор совершенно устойчив). Принцип эквивалентности Одним из основных понятий в химии вообще и в аналитической химии в частности является понятие об эквивалентности реагирующих веществ в химической реакции. Вещества реагируют между собой в эквивалентных количествах. На этом принципе основан расчет результатов титриметрического анализа. Если определяемое вещество А реагирует с раствором титраята В по уравнению νAA + νBB —> Продукты реакции то эквивалентными массами эти
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 64; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.252.140 (0.087 с.) |
 (2)
(2)

 (3)
(3)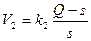 (4)
(4)
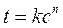





 10-3, где с — молярная концентрация эквивалента, а V — объем, в котором растворено вещество, то для двух стехиометрически реагирующих веществ справедливо соотношение:
10-3, где с — молярная концентрация эквивалента, а V — объем, в котором растворено вещество, то для двух стехиометрически реагирующих веществ справедливо соотношение: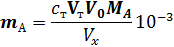
 .
.



