Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Графики изотермического процессаСодержание книги
Поиск на нашем сайте
Вообще, графики термодинамических процессов принято изображать в следующих системах координат: pV -диаграмма: ось абсцисс V, ось ординат p; V T -диаграмма: ось абсцисс T, ось ординат V; pT -диаграмма: ось абсцисс T, ось ординат p. График изотермического процесса называется изотермой. Изотерма на pV -диаграмме — это график обратно пропорциональной зависимости p = const V. Такой график является гиперболой (вспомните алгебру — график функции
Рис. 7. Изотерма на pV -диаграмме Изобарный процесс Напомним ещё раз, что изобарный процесс — это процесс, проходящий при постоянном давлении. В ходе изобарного процесса меняются лишь объём газа и его температура. Типичный пример изобарного процесса: газ находится под массивным поршнем, который может свободно перемещаться. Если масса поршня M и поперечное сечение поршня S, то давление газа всё время постоянно и равно
где p 0 — атмосферное давление. Пусть идеальный газ совершает изобарный процесс при давлении p. Снова рассмотрим два произвольных состояния газа; на этот раз значения макроскопических параметров будут равны p,V 1 ,T 1 и p,V 2 ,T 2. Выпишем уравнения состояния:
Поделив их друг на друга, получим:
В принципе, уже и этого могло бы быть достаточно, но мы пойдём немного дальше. Перепишем полученное соотношение так, чтобы в одной части фигурировали только параметры первого состояния, а в другой части — только параметры второго состояния (иными словами, «разнесём индексы» по разным частям):
А отсюда теперь — ввиду произвольности выбора состояний! — получаем закон Гей-Люссака:
Иными словами, при постоянном давлении газа его объём прямо пропорционален температуре: V = const · T. Почему объём растёт с ростом температуры? При повышении температуры молекулы начинают бить сильнее и приподнимают поршень. При этом концентрация молекул падает, удары становятся реже, так что в итоге давление сохраняет прежнее значение. Графики изобарного процесса График изобарного процесса называется изобарой. На V T -диаграмме изобара V = const · T является прямой линией (рис. 10):
Рис. 10. Изобара на V T -диаграмме Изохорный процесс Изохорный процесс, напомним, — это процесс, проходящий при постоянном объёме. При изохорном процессе меняются только давление газа и его температура.
Изохорный процесс представить себе очень просто: это процесс, идущий в жёстком сосуде фиксированного объёма (или в цилиндре под поршнем, когда поршень закреплён). Пусть идеальный газ совершает изохорный процесс в сосуде объёмом V. Опять-таки рассмотрим два произвольных состояния газа с параметрами p 1 ,V,T 1 и p 2 ,V,T 2. Имеем:
Делим эти уравнения друг на друга:
Как и при выводе закона Гей-Люссака, «разносим» индексы в разные части:
Ввиду произвольности выбора состояний мы приходим к закону Шарля:
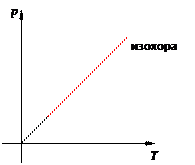
Иными словами, при постоянном объёме газа его давление прямо пропорционально температуре: p = const · T. Увеличение давления газа фиксированного объёма при его нагревании — вещь совершенно очевидная с физической точки зрения. Вы сами легко это объясните. Графики изохорного процесса График изохорного процесса называется изохорой. На pT -диаграмме изохора p = const · T является прямой линией (рис. 13):
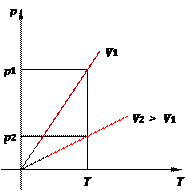
Рис. 13. Изохора на pT -диаграмме Смысл пунктирного участка тот же: неадекватность модели идеального газа при низких температурах. Далее, чем больше объём, тем ниже идёт изохора на pT -диаграмме (рис. 14):
Рис. 14. Чем ниже изохора, тем больше объём
|
|||||
|
Последнее изменение этой страницы: 2021-06-14; просмотров: 142; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.171.136 (0.009 с.) |

 ). Изотермагипербола изображена на рис. 7.
). Изотермагипербола изображена на рис. 7.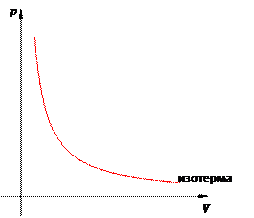
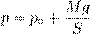 ,
,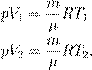 ,
,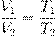 .
. .
. = const.
= const.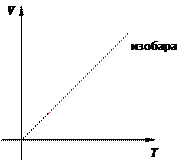
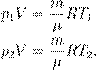 ,
,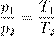 .
. .
.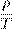 = const.
= const.