
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Энергия частиц и температура газа
Можно показать, что при установлении теплового равновесия между двумя газами выравниваются средние кинетические энергии их частиц. Но мы знаем, что при этом становятся равны и температуры газов. Следовательно, температура газа — это мера средней кинетической энергии его частиц. Собственно, ничто не мешает попросту отождествить эти величины и сказать, что температура газа — это средняя кинетическая энергия его молекул. В продвинутых курсах теоретической физики так и поступают. Определённая таким образом температура измеряется в энергетических единицах — джоулях. Но для практических задач удобнее иметь дело с привычными кельвинами. Связь средней кинетической энергии частиц и абсолютной температуры газа даётся формулой:
где k = 1, 38 · 10−23 Дж/К — постоянная Больцмана. Из данной формулы можно получить выражение для средней квадратической скорости частиц. Подставим (1) в (2): откуда В эту формулу входит масса частицы m 0, которую ещё надо вычислить. Но можно получить более удобный вариант формулы, домножив числитель и знаменатель подкоренного выражения на число Авогадро N A:
. m 0 N A В знаменателе имеем: m 0 N A = µ — молярная масса газа. В числителе стоит произведение двух констант, которое также является константой: Дж Дж −23 23 −1 R = kN A= 1, 38 · 10 К моль· К Константа R называется универсальной газовой постоянной. Теперь формула для средней квадратической скорости приобретает вид:
Такое выражение гораздо более удобно для практических вычислений.
Решение задач Задача №1 При какой температуре средняя кинетическая энергия поступательного движения молекул газа равна 6,21*10-21 Дж?
Дано: Решение:
Т-? Ответ:300 K З адача №2
При какой температуре средняя квадратичная скорость молекул азота 830 м/с? Дано: Решение:
Т-? m0= Т= Ответ:774 K
Задача №3 Какова средняя квадратичная скорость молекул кислорода при температуре 300К?
Vср-? m0= V= Ответ: 473м/с
Тема 2.3. «Уравнение состояния идеального газа». Содержание учебного материала: «Уравнение состояния идеального газа. Изопроцессы. Газовые законы.» Цели. Учебные: Сформировать специальные знания, умения и навыки по заданной теме. Раскрыть сущность уравнения Менделеева – Клайперона, изопроцессов и газовых законов. Научить строить графики изопроцессов. Научить применять газовые законы при решении практических и графических задач. Воспитательные: Воспитывать трудолюбие, интерес к предмету, внимательность и наблюдательность. Прививать навыки работы в должном темпе, развивать инициативу, уверенность в своих силах. Повысить интерес обучающихся к изучаемому материалу путем разнообразия форм проведения уроков. Развивающие: Развивать познавательные способности обучающихся. Активизировать исследовательские способности. Расширять их кругозор, исследовательское мышление. Уметь применять полученные теоретические знания на практике. Развить умения слушать, анализировать, чётко аргументировать, излагать и отстаивать своё мнение. Оборудование: манометр, термометр, весы, нагреватель, ёмкость для нагревания жидкости, градуированный сосуд, секундомер, измерительная лента. Берём формулу p = nkT. Вспомним теперь, что
откуда pV = νRT. (3) Соотношение (3) называется уравнением Менделеева — Клапейрона. Оно даёт взаимосвязь трёх важнейших макроскопических параметров, описывающих состояние идеального газа — давления, объёма и температуры. Поэтому уравнение Менделеева — Клапейрона называется ещё уравнением состояния идеального газа.
Учитывая, что
Есть ещё один полезный вариант этого уравнения. Поделим обе части на V:
Но
В задачах по физике активно используются все три формы записи (3)—(5). На протяжении этого раздела мы будем придерживаться следующего предположения: масса и химический состав газа остаются неизменными. Иными словами, мы считаем, что: m = const, то есть нет утечки газа из сосуда или, наоборот, притока газа в сосуд; µ = const, то есть частицы газа не испытывают каких-либо изменений (скажем, отсутствует диссоциация — распад молекул на атомы). Эти два условия выполняются в очень многих физически интересных ситуациях (например, в простых моделях тепловых двигателей) и потому вполне заслуживают отдельного рассмотрения. Если масса газа и его молярная масса фиксированы, то состояние газа определяется тремя макроскопическими параметрами: давлением, объёмом и температурой. Эти параметры связаны друг с другом уравнением состояния (уравнением Менделеева — Клапейрона). Термодинамический процесс Термодинамический процесс (или просто процесс) — это изменение состояния газа с течением времени. В ходе термодинамического процесса меняются значения макроскопических параметров — давления, объёма и температуры. Особый интерес представляют изопроцессы — термодинамические процессы, в которых значение одного из макроскопических параметров остаётся неизменным. Поочерёдно фиксируя каждый из трёх параметров, мы получим три вида изопроцессов. Изотермический процесс идёт при постоянной температуре газа: T = const. Изобарный процесс идёт при постоянном давлении газа: p = const. Изохорный процесс идёт при постоянном объёме газа: V = const. Изопроцессы описываются очень простыми законами Бойля — Мариотта, Гей-Люссака и Шарля. Давайте перейдём к их изучению. Изотермический процесс При изотермическом процессе температура газа постоянна. В ходе процесса меняются только давление газа и его объём. Установим связь между давлением p и объёмом V газа в изотермическом процессе. Пусть температура газа равна T. Рассмотрим два произвольных состояния газа: в одном из них значения макроскопических параметров равны p 1 ,V 1 ,T, а во втором — p 2 ,V 2 ,T. Эти значения связаны уравнением Менделеева — Клапейрона:
Как мы сказали с самого начала, масса газа m и его молярная масса µ предполагаются неизменными. Поэтому правые части выписанных уравнений равны. Следовательно, равны и левые части: p 1 V 1 = p 2 V 2. Поскольку два состояния газа были выбраны произвольно, мы можем заключить, что в ходе изотермического процесса произведение давления газа на его объём остаётся постоянным: pV = const. Данное утверждение называется законом Бойля — Мариотта. Записав закон Бойля — Мариотта в виде const p = V можно дать и такую формулировку: в изотермическом процессе давление газа обратно пропорционально его объёму. Если, например, при изотермическом расширении газа его объём увеличивается в три раза, то давление газа при этом в три раза уменьшается.
Как объяснить обратную зависимость давления от объёма с физической точки зрения? При постоянной температуре остаётся неизменной средняя кинетическая энергия молекул газа, то есть, попросту говоря, не меняется сила ударов молекул о стенки сосуда. При увеличении объёма концентрация молекул уменьшается, и соответственно уменьшается число ударов молекул в единицу времени на единицу площади стенки — давление газа падает. Наоборот, при уменьшении объёма концентрация молекул возрастает, их удары сыпятся чаще и давление газа увеличивается.
|
|||||||
|
Последнее изменение этой страницы: 2021-06-14; просмотров: 64; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.31.209 (0.015 с.) |
 (2)
(2)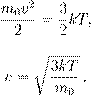
 r3 kN A
r3 kN A · 6, 02 · 10 моль = 8, 31
· 6, 02 · 10 моль = 8, 31  .
. .
.
 Ек=6,21*10-21 Дж Eк=
Ек=6,21*10-21 Дж Eк= 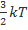 =>
=> 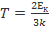 =
= 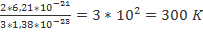

 V=830м/с V=
V=830м/с V= 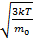 => T=
=> T= 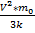
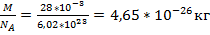
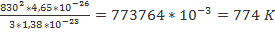
 Дано: Решение:
Дано: Решение: Т=300К V=
Т=300К V= 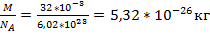
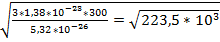 =473м/с
=473м/с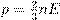 и подставляем в неё
и подставляем в неё 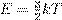 . Получаем:
. Получаем: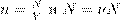
 A, где ν — число молей газа:
A, где ν — число молей газа: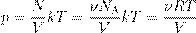 ,
, , где m — масса газа, получим другую форму уравнения Менделеева — Клапейрона:
, где m — масса газа, получим другую форму уравнения Менделеева — Клапейрона: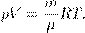 (4)
(4)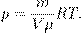
 — плотность газа. Отсюда
— плотность газа. Отсюда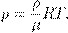 (5)
(5)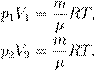
 ,
,


