
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Методические указания по разделамСодержание книги Поиск на нашем сайте
ХИМИЯ Методические указания и задания для контрольной работы для студентов заочной формы обучения специальности: 19.02.10. Технология продукции общественного питания
Луганск 2017 МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ ЛУГАНСКОЙ НАРОДНОЙ РЕСПУБЛИКИ ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ СРЕДНЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ ЛУГАНСКОЙ НАРОДНОЙ РЕСПУБЛИКИ «ЛУГАНСКИЙ ГОСУДАРСТВЕННЫЙ КОЛЛЕДЖ ЭКОНОМИКИ И ТОРГОВЛИ»
ХИМИЯ Методические указания и задания для контрольной работы для студентов заочной формы обучения специальности: 19.02.10. Технология продукции общественного питания
Луганск 2017
Методические указания и варианты контрольных заданий по химии для студентов специальности19.02.10. Технология продукции общественного питания заочной формы обучения. Сост. Берестовая М.Л., Луганск: ГОУ СПО ЛНР «Луганский государственный колледж экономики и торговли», 2017. - с. 40 В работе приведены общие методические указания к выполнению контрольных заданий, порядок выполнения работы, выбор заданий, краткие методические указания к решению типовых задач, охватывающих основные разделы химии, список рекомендуемой литературы.
СОДЕРЖАНИЕ Стр. Введение………………………………………………………….. 4
Методические указания по разделам …….……………………. 1. Основы химической термодинамики. Термохимия……. 6 2. Химическая кинетика и равновесие……………………… 7 3. Растворы……………………………………………………. 9 4. Коллоидно-дисперсные системы. Растворы высокомолекулярных соединений. Студни……………… 11 5. Основы качественного анализа…………………………… 12 6. Основы гравиметрического (весового) анализа…………. 14 7. Основы титриметрического (объемного) анализа………. 16 8. Белки. Жиры. Углеводы…………………………………… 18 9. Витамины. Ферменты……………………………………… 23 Методические указания по выполнению контрольной работы…………………………………………….. 25
Перечень вопросов контрольной работы……………………… 28
Литература………………………………………………………. 36
Прложение……………………………………………………….. 37 Введение Наука стала производительной силой нашего общества. Без применения достижения науки, и в частности химии, невозможно развитие современной промышленности и сельского хозяйства. Химия, являясь одной из фундаментальных естественнонаучных дисциплин, изучает материальный мир, законы его развития, химическую форму движения материи. В процессе изучения химических дисциплин вырабатывается научный взгляд на мир в целом. Знание химии необходимо для плодотворной творческой деятельности технологов любой специальности. Необходимо прочно усвоить основные законы, овладеть техникой химических расчетов, выработать навыки самостоятельного выполнения химических экспериментов и обобщения фактов. Знания химии необходимо для последующего успешного изучения общенаучных специальных дисциплин. Методические указания для выполнения контрольной работы по учебной дисциплине ЕН.03 Химия разработаны в соответствии с требованиями Федерального государственного образовательного стандарта по специальности 19.02.10. Технология продукции общественного питания. Целью изучения дисциплины является приобретение студентами теоретических знаний и практических умений в области химии. В результате изучения дисциплины студент должен: Уметь: - применять основные законы химии для решения задач в области профессиональной деятельности; - использовать свойства органических веществ, дисперсных и коллоидных систем для оптимизации технологического процесса; - описывать уравнениями химических реакций процессы, лежащие в основе производства продовольственных продуктов; - проводить расчеты по химическим формулам и уравнениям реакции; - использовать лабораторную посуду и оборудование; - выбирать метод и ход химического анализа, подбирать реактивы и аппаратуру; - проводить качественные реакции на неорганические вещества и ионы, отдельные классы органических соединений; - выполнять количественные расчеты состава вещества по результатам измерений; - соблюдать правила техники безопасности при работе в химической лаборатории. Должен знать: - основные понятия и законы химии; - теоретические основы органической, физической, коллоидной, аналитической химии; - понятие химической кинетики и катализа; - классификацию химических реакций и закономерности их протекания; - обратимые и необратимые химические реакции, химическое равновесие, смещение химического равновесия под действием различных факторов;
- окислительно-восстановительные реакции, реакции ионного обмена; - гидролиз солей, диссоциацию электролитов в водных растворах, понятие о сильных и слабых электролитах; - тепловой эффект химических реакций, термохимические уравнения; - характеристики различных классов органических веществ, входящих в состав сырья и готовой пищевой продукции; - свойства растворов и коллоидных систем высокомолекулярных соединений; - дисперсные и коллоидные системы пищевых продуктов; - роль и характеристики поверхностных явлений в природных и технологических процессах; - основы аналитической химии; - основные методы классического количественного и физико-химического анализа; - назначение и правила использования лабораторного оборудования и аппаратуры; - методы и технику выполнения химических анализов. Основная форма изучения дисциплины – самостоятельная работа студентов над рекомендуемой литературой в соответствии с методическими указаниями. В процессе изучения дисциплины студенты-заочники должны выполнить одну домашнюю контрольную работу по заданному варианту.
Тема 3. Растворы. Существуют различные способы выражения концентрации: - Массовая доля растворенного вещества(ω) - отношение массы растворенного вещества (г, кг) к массе всего раствора в процентах - показывает, сколько граммов растворенного вещества содержится в 100 г раствора: ω = m р.в. / m р-ра · 100 %; m р-ра = Vр-ра · ρ р-р; mр-ра= m в-ва + mрастворителя; - Молярная концентрация См или М (молярность)– показывает количество молей растворенного вещества, содержащихся в 1л раствора: СM= υ р.в. / Vр-ра = m р.в. / V р-ра · M; - Нормальная или эквивалентная концентрация Сн или н (нормальность) – показывает число эквивалентов растворенного вещества, содержащихся в 1 л раствора: сн = Важнейшим свойством разбавленных растворов является осмос -односторонний переход растворителя через полупроницаемую мембрану из раствора с меньшей концентрацией в раствор с большей концентрацией. Сила, обуславливающая осмос, называется осмотическим давлением. Осмотическое давление зависит от концентрации раствора и температуры. Для разбавленных растворов неэлектролитов эта зависимость выражается уравнением Вант– Гоффа: осмотическое давление прямо пропорционально концентрации раствора и абсолютной температуре: Pocм= υ·R·T/V где V — объем раствора; υ — число молей растворенного вещества; R —универсальная газовая постоянная (R = 8,313 ·103 Дж/град моль); Т — абсолютная температура. Так как отношение υ/V— представляет собой концентрацию раствора См, выражаемую в моль/л, можно написать: Pocм= Cм· R·T Пользуясь уравнением, можно рассчитать осмотическое давление раствора, если известны его концентрация и температура. Зная Рoсм при заданной температуре, можно определить концентрацию растворов.
Решение типовых задач
Задача 1: Вычислите массовую долю раствора, полученного при растворении 4г хлорида кальция(СaCI2) в 396 мл воды (ρ= 1 г/мл). Дано: Решение: m(СaCI2) = 4 г Записываем формулу массовой доли раствора, исходя V(Н2О) = 396мл из условия задачи: ---------------------- m(СaCI2) ·100% ω(р-ра) =? ω(р-ра) = ---------------------; m(р-ра) Из уравнения следует, что для вычисления массовой доли необходимо знать массу раствора, определяем ее по формуле: m (р-ра) = m(СaCI2) + m(Н2О) = 4г+ 396г= 400г, m(Н2О) = V(Н2О) · ρ(Н2О) = 396мл ·1 г/мл= 396г; Подставляем полученные данные, и данные задачи в уравнение массовой доли раствора: 4г ·100% ω(р-ра) = ------------ = 1%; 400г Ответ: массовая доля раствора равна 1%.
Задача 2: Сколько граммов серной кислоты(H2SO4) содержится в 150 мл 0,2М раствора? Дано: Решение: V(р-ра) = 150мл Записываем исходную формулу для определения См= 0,2М молярной концентрации раствора: -------------------------- m(Н2SO4) =? m(Н2SO4) СM= ---------------------------- М(Н2SO4) · V(р-ра) Из формулы выводим: m(Н2SO4) = СM · М(Н2SO4) · V(р-ра); Вычисляем молярную массу серной кислоты: М(Н2SO4) = 1·2 + 32 + 16·4 = 98 (г/моль); Объем раствора переводим из миллилитров в литры: V(р-ра) = 150мл = 0,15л Подставляем числовые значения в формулу: m(Н2SO4) = 0,2·98·0,15 = 2,94 (г) Ответ: масса серной кислоты равна 2,94г.
Задача 3. Вычислите молярную и нормальную 20 % раствора хлорида кальция плотностью 1,178 г/мл. Дано: Решение: ω = 20 % Найдеммассу раствора ρ = 1,178 г/мл _ mр-ра = V·ρ = 1000 · 1,178 = 1178 г. С -? Найдем массу CaCl2, содержащуюся в 1178 г. Сн -? 20 % раствора 20 г CaCl2 содержится в 100 г раствора х г — в 1178 г раствора х = 235,6 г. Молярность определим с помощью соотношения: С = υ /V υ = m/M = 235,6/111 = 2,1 моль M(CaCl2) = 40+35,5·2 = 111 г/моль С = 2,1/1 = 2,1 М Нормальная концентрация определяется с помощью соотношения: Сн = mр.в. / Мэкв V Мэ = М/ кол-во атомов Ме · валентность Ме =111/2 = 55,5 г/моль Сн = 235,6/55,5 · 1 = 4,2 н Ответ: С = 2,1 М; Сн = 4,2 н
Тема 9. Витамины. Ферменты.
Витамины играют очень важную роль в большинстве жизненных процессов и что они не образуются в организме, а должны поступать в него извне. Познакомьтесь с классификацией витаминов и запомните основные виды водорастворимых (витамины группы В, витамин С, Р и т. п.) и жирорастворимых ( А, Д, Е, К и т. д.) витаминов. Рассматривая характеристику каждого из них, необходимо обратить внимание на: 1)химическую природу витамина; 2) распространение в составе пищевых продуктов; 3) изменения витамина при хранении и тепловой обработке продукта. При изучении витамина Собратите внимание на то, что он наименее стойкий из всех известных витаминов, так как легко окисляется кислородом воздуха, особенно при высокой температуре, в присутствии катионов железа и меди. При изучении витаминов группы В отметьте, что эти вещества относятся к гетероциклическим соединениям, имеющим атомы азота в гетероциклах и что витамины стойки к тепловым воздействиям, но могут разрушаться под действием ультрафиолетовых лучей. Из жирорастворимых витаминов нужно особенно четко знать свойства витамина А и витамина Д. Витамин А является одноатомным непредельным спиртом и может быть получен гидролизом красящего вещества многих растений — каротина. Витамин А — теплостойкое вещество, но разрушается при окислении, особенно на свету. Витамина Д имеет несколько биологически активных изомеров и он устойчив к окислительным процессам и нагреванию, поэтому хорошо сохраняется в пищевых продуктах при их консервировании и кулинарной обработке. Витамины повышают пищевую ценность продуктов, поэтому нужно обратить внимание на вопросы синтеза витаминов и получения их микробиологическими методами. Ферменты участвуют в осуществлении всех процессов обмена веществ, в реализации генетической информации. Переваривание и усвоение пищевых веществ, синтез и распад белков, нуклеиновых кислот, жиров, углеводов и других соединений в клетках и тканях всех организмов — все эти процессы невозможны без участия ферментов. Любое проявление функций живого организма — дыхание, мышечное сокращение, нервно-психическая деятельность, размножение и др. — обеспечивается действием ферментов. Индивидуальные особенности клеток, выполняющих определенные функции, в значительной мере определяются уникальным набором ферментов, производство которых генетически запрограммировано. Отсутствие даже одного фермента или какой-либо его дефект могут привести к серьезным отрицательным последствиям для организма. Ферме́нты (от лат. «fermentum» — брожение, закваска), энзимы — специфические белки, увеличивающие скорость протекания химических реакций в клетках всех живых организмов. Так как ферменты сохраняют свои свойства и вне организма, их успешно используют в различных отраслях промышленности. Например, протеолитический фермент папайи (из сока папайи) — в пивоварении, для мягчения мяса; пепсин — при производстве «готовых» каш и как лекарственный препарат; трипсин — при производстве продуктов для детского питания; реннин (сычужный фермент из желудка теленка) — в сыроварении. Каталаза широко применяется в пищевой и резиновой промышленности, а расщепляющие полисахариды целлюлазы и пектидазы — для осветления фруктовых соков. Ферменты необходимы при установлении структуры белков, нуклеиновых кислот и полисахаридов, в генетической инженерии и т. д. С помощью ферментов получают лекарственные препараты и сложные химические соединения.
Контрольной работы 1. Выбор варианта контрольной работы Вариант контрольной работы определяется по двум последним цифрам шифра студента. В таблице по горизонтали Б расположены цифры от 1 до 0, каждая из которых является последней цифрой шифра. По вертикали А размещены цифры от 1 до 0, каждая из которых – предпоследняя цифра шифра. Пересечение горизонтальной и вертикальной линии определяет клетку с вопросами варианта студента. Например, шифр студента имеет последние цифры 55. Перекресток 5 сроки по вертикали А и 5 столбца по горизонтали Б определяет вариант с вопросами № 5,20, 26, 35, 46,55, 64,80, 89, 95. 2. Требования к оформлению контрольной работы При изучении курса «Химия» студенты заочной формы обучения выполняют одну контрольную работу, состоящую из 10 заданий. Контрольная работа выполняется в установленный учебным графиком срок. При написании работы студент должен придерживаться следующих правил: 1 Писать четким почерком, без помарок и сокращения слов, тщательно проверить содержание, орфографию и стиль. 2 Пронумеровать страницы, оставить на них поля, интервал между строчками делать не менее одной клетки. 3 Не превышать общий объем (24 страницы ученической тетради). 4 Контрольную работу подписать, в соответствии с требованиями. 5 В конце работы привести список литературы с указанием фамилии автора и его инициалов, полного названия учебника, места издания, названия издательства, года издания (см. учебно-методическую литературу); затем следует дата выполнения работы и личная подпись. 6 Для рецензии преподавателя необходимо оставить 1-2 страницы. Требования к оформлению ответа на вопрос задания: 1. Прежде всего необходимо переписать вопрос задания в тетрадь. 2. Ответ на новый вопрос необходимо начинать с начала страницы. 3. Ответ на теоретический вопрос должен быть четким и кратким. 4. Оформление решения задачи следующее: написать, что дано; что надо определить; ход решения с применением законов, правил, формул объяснением их; ответ задачи. Все задачи по данному курсу решаются с использованием соответствующих законов, правил, формул, поэтому в тетради надо обязательно указать, на основании какого закона, правила Вы решаете задачу; привести формулировку закона, правила; объяснит значение всех величин, входящих в формулы. Затем подставить в уравнение числовые значения и дать ответ. При простой подстановке числовых величин в формулу без объяснения хода решения задача не будет считаться решенной. Работа оценивается «зачтено» или «не зачтено». Студент, получивший контрольную работу с положительной оценкой знакомится с рецензией и с учетом замечаний преподавателя дорабатывает отдельные вопросы с целью углубления своих знаний. Незачтенная контрольная работа возвращается студенту с подробной рецензией, содержащей рекомендации по устранению ошибок, для повторного выполнения. Работа выполняется студентом вновь и сдается вместе с незачтенной работой на проверку этому же преподавателю. Контрольная работа, выполненная не по своему варианту, возвращается без проверки. В случае возникновения проблем при выполнении контрольной работы следует обращаться к преподавателю за консультацией. Проверенные контрольные работы студент предоставляет преподавателю при сдаче дифференцированного зачета (экзамена). ТАБЛИЦА ВАРИАНТОВ
Литература
1. Белик В.В. Киенская К.И. Физическая и коллоидная химия-М.: Академия, 2008. 2. Горбунцова С.В. Физическая и коллоидная химия (в общественном питании) –М., «Альфа-М»; «ИНФРА-М»; 2010г. 3. Липатников В.Е., Казаков К.М. Физическая и коллоидная химия.-М.: Высшая школа, 2005. 4. Ищенко А.А. Аналитическая химия (СПО).- М.: Академия, 2007. 5. Жванко Ю.Н., Панкратова Г.В. Аналитическая химия и технохимический контроль в общественном питании.-М.: Высшая школа, 1989. 6. Саенко О.Е. Аналитическая химия: учебник для средних профессиональных учебных заведений. - Ростов – на –Дону: Феникс, 2009. 7. Гурецкая В.Л. Органическая химия.-М.: Высшая школа, 2004. 8. Пустовалова Л.М. Органическая химия.-Ростов-на-Дону: Феникс, 2005. 9. Дуденко Н.В., Павлоцкая Л.Ф. и др. Биологическая химия. -Харьков: Прапор, 1999. Дополнительная литература 10. Габриелян О.С. Химия для профессий и специальностей технического профиля: учебник – М.: Академия, 2013. 11. Габриелян О.С. Химия в тестах, задачах и упражнениях: учебное пособие.- 7-е изд., стер.-М.: Академия, 2012. 12. Шапиро С.А. Шапиро М.А. Аналитическая химия-М., «Высшая школа», 2006.
ПРИЛОЖЕНИЕ Таблица. Стандартные энтальпии образования ХИМИЯ Методические указания и задания для контрольной работы для студентов заочной формы обучения специальности: 19.02.10. Технология продукции общественного питания
Луганск 2017 МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ ЛУГАНСКОЙ НАРОДНОЙ РЕСПУБЛИКИ ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ СРЕДНЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ ЛУГАНСКОЙ НАРОДНОЙ РЕСПУБЛИКИ «ЛУГАНСКИЙ ГОСУДАРСТВЕННЫЙ КОЛЛЕДЖ ЭКОНОМИКИ И ТОРГОВЛИ»
ХИМИЯ Методические указания и задания для контрольной работы для студентов заочной формы обучения специальности: 19.02.10. Технология продукции общественного питания
Луганск 2017
Методические указания и варианты контрольных заданий по химии для студентов специальности19.02.10. Технология продукции общественного питания заочной формы обучения. Сост. Берестовая М.Л., Луганск: ГОУ СПО ЛНР «Луганский государственный колледж экономики и торговли», 2017. - с. 40 В работе приведены общие методические указания к выполнению контрольных заданий, порядок выполнения работы, выбор заданий, краткие методические указания к решению типовых задач, охватывающих основные разделы химии, список рекомендуемой литературы.
СОДЕРЖАНИЕ Стр. Введение………………………………………………………….. 4
Методические указания по разделам …….……………………. 1. Основы химической термодинамики. Термохимия……. 6 2. Химическая кинетика и равновесие……………………… 7 3. Растворы……………………………………………………. 9 4. Коллоидно-дисперсные системы. Растворы высокомолекулярных соединений. Студни……………… 11 5. Основы качественного анализа…………………………… 12 6. Основы гравиметрического (весового) анализа…………. 14 7. Основы титриметрического (объемного) анализа………. 16 8. Белки. Жиры. Углеводы…………………………………… 18 9. Витамины. Ферменты……………………………………… 23 Методические указания по выполнению контрольной работы…………………………………………….. 25
Перечень вопросов контрольной работы……………………… 28
Литература………………………………………………………. 36
Прложение……………………………………………………….. 37 Введение Наука стала производительной силой нашего общества. Без применения достижения науки, и в частности химии, невозможно развитие современной промышленности и сельского хозяйства. Химия, являясь одной из фундаментальных естественнонаучных дисциплин, изучает материальный мир, законы его развития, химическую форму движения материи. В процессе изучения химических дисциплин вырабатывается научный взгляд на мир в целом. Знание химии необходимо для плодотворной творческой деятельности технологов любой специальности. Необходимо прочно усвоить основные законы, овладеть техникой химических расчетов, выработать навыки самостоятельного выполнения химических экспериментов и обобщения фактов. Знания химии необходимо для последующего успешного изучения общенаучных специальных дисциплин. Методические указания для выполнения контрольной работы по учебной дисциплине ЕН.03 Химия разработаны в соответствии с требованиями Федерального государственного образовательного стандарта по специальности 19.02.10. Технология продукции общественного питания. Целью изучения дисциплины является приобретение студентами теоретических знаний и практических умений в области химии. В результате изучения дисциплины студент должен: Уметь: - применять основные законы химии для решения задач в области профессиональной деятельности; - использовать свойства органических веществ, дисперсных и коллоидных систем для оптимизации технологического процесса; - описывать уравнениями химических реакций процессы, лежащие в основе производства продовольственных продуктов; - проводить расчеты по химическим формулам и уравнениям реакции; - использовать лабораторную посуду и оборудование; - выбирать метод и ход химического анализа, подбирать реактивы и аппаратуру; - проводить качественные реакции на неорганические вещества и ионы, отдельные классы органических соединений; - выполнять количественные расчеты состава вещества по результатам измерений; - соблюдать правила техники безопасности при работе в химической лаборатории. Должен знать: - основные понятия и законы химии; - теоретические основы органической, физической, коллоидной, аналитической химии; - понятие химической кинетики и катализа; - классификацию химических реакций и закономерности их протекания; - обратимые и необратимые химические реакции, химическое равновесие, смещение химического равновесия под действием различных факторов;
- окислительно-восстановительные реакции, реакции ионного обмена; - гидролиз солей, диссоциацию электролитов в водных растворах, понятие о сильных и слабых электролитах; - тепловой эффект химических реакций, термохимические уравнения; - характеристики различных классов органических веществ, входящих в состав сырья и готовой пищевой продукции; - свойства растворов и коллоидных систем высокомолекулярных соединений; - дисперсные и коллоидные системы пищевых продуктов; - роль и характеристики поверхностных явлений в природных и технологических процессах; - основы аналитической химии; - основные методы классического количественного и физико-химического анализа; - назначение и правила использования лабораторного оборудования и аппаратуры; - методы и технику выполнения химических анализов. Основная форма изучения дисциплины – самостоятельная работа студентов над рекомендуемой литературой в соответствии с методическими указаниями. В процессе изучения дисциплины студенты-заочники должны выполнить одну домашнюю контрольную работу по заданному варианту.
Методические указания по разделам
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-06-14; просмотров: 93; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.171.71 (0.018 с.) |

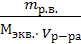 (·1000)
(·1000)


