
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 2. Химическая кинетика и равновесие.Содержание книги Поиск на нашем сайте
Химическая кинетика изучает скорость и механизм протекания химических реакций. Скорость химических реакций зависит от природы реагирующих веществ, от площади поверхности фаз, от концентрации реагентов, от температуры, от катализатора. Зависимость скорости реакции от концентрации выражает основной закон химической кинетики - закон действующих масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в реакции. Так, для химической реакции: mA + nB = C скорость определяется по формуле: Ự = k·[A]m · [B]n где k– константа скорости данной реакции. Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа: при увеличении температуры на каждые 10 градусов, скорость химической реакции увеличивается в 2 - 4 раза: Ự2= Ự1· Yt2 –t1/ 10 Ự1 – скорость химической реакции при начальной температуре t1; Ự2– скорость этой же реакции при повышенной температуре t2; Y – температурный коэффициент реакции. Все химические реакции можно разделить на обратимые и необратимые. Обратимыми называют реакции, продукты которых могут между собой реагировать с образованием исходных веществ. В обратимых реакциях скорость прямой реакции вначале имеет максимальное значение, а затем снижается из-за уменьшения концентрации исходных веществ. Обратная реакция, наоборот, протекает с увеличением скорости. Наконец, наступает такой момент, когда скорости прямой и обратной реакций становятся равными. Такое состояние называется химическим равновесием. Количественной характеристикой состояния химического равновесия является константа равновесия. Константа равновесия равна отношению произведения концентраций продуктов реакции к произведению концентраций исходных веществ после достижения равновесия (равновесных концентраций). Для реакции: aA + bB = cC + dD константа равновесия равна: K = [C]c [D]d / [A]a[B]b Константа равновесия– величина безразмерная, не зависит от концентрации реагирующих веществ и изменяется только с изменением температуры.
Решение типовых задач
Задача 1: Как изменится скорость реакции 2NO(г)+ O2(г) →2NO2(г), если давление в системе увеличить в 2 раза?
Решение: Скорость данной реакции, согласно закону действующих масс, определяется по формуле: Ự = k·[NO]2 · [O2] Увеличение давления в газовой системе пропорционально увеличивает концентрацию веществ. Следовательно, увеличение давления в два раза, означает, что концентрации NO и O2 тоже увеличатся в два раза. Скорость реакции при увеличенном давлении будет определяться: Ự1= k·[2NO]2 · [2O2] = 1 · 22 · 2 = 8 Чтобы найти как изменится скорость реакции, записываем соотношение: Ự1/ Ự = 8 / 1 = 8 Ответ: скорость реакции увеличится в 8 раз.
Задача 2: Температурный коэффициент скорости реакции равен 2. Как изменится скорость реакции при повышении температуры от 250 до 450 ? Дано: Решение: t1= 250 Согласно правилу Вант-Гоффа: t2= 450 Ự2= Ự1· Yt2 –t1/ 10 Y = 2 Подставляем значения из условия задачи: _______________ Ự2= Ự1· 245-25/ 10 = Ự1· 220/ 10 = Ự1· 22 = Ự1· 4 V2=? Ответ: скорость реакции увеличится в 4 раза.
Задача 3: При некоторой температуре равновесие: 2SO2+ O2 ↔ 2SO3 установилось при следующих концентрациях: [SO2] = 0,06 моль/л, [O2] = 0,03 моль/л, [SO3] = 0,04 моль/л. Вычислите константу равновесия при этой температуре. Дано: Решение: [SO2] = 0,06 моль/л Записываем формулу константы равновесия, [O2] = 0,03 моль/л исходя из уравнения реакции: [SO3] = 0,04 моль/л. 2SO2+ O2 ↔2SO3 ___________________ К=? К= [SO3]2 / [SO2] 2 · [O2] Подставляем значения из условия задачи: К= 0,042 / 0,062 · 0,03 = 0,0016 / 0,0036 · 0,03 = 14,8 Ответ: К = 14,8
Задача 4: Укажите, как повлияет: а) повышение давления; б) повышение температуры; в) увеличение концентрации кислорода на равновесие системы:
2CO (г) + O2 (г) ↔ 2CO2 (г) + Q Решение: а) Изменение давления смещает равновесие реакций с участием газообразных веществ. Определим количество молей газообразных веществ до и после реакции по стехиометрическим коэффициентам: 3 моль 2 моль 2CO (г) + O2 (г) ↔ 2CO2 (г) По принципу Ле Шателье, при увеличении давления, равновесие смещается в сторону образования меньшего количества моль газообразных веществ, следовательно равновесие сместится вправо, т.е. в сторону образования СО2, в сторону прямой реакции (→). б) По принципу Ле Шателье, при повышении температуры, равновесие смещается в сторону эндотермической реакции (-Q), т.е. в сторону обратной реакции – реакции разложения СО2 (←), т.к. по закону сохранения энергии: Q - 2CO (г) + O2 (г) ↔ 2CO2 (г) + Q в) При увеличении концентрации кислорода равновесие системы смещается в сторону получения СО2 (→) т.к. увеличение концентрации реагентов (жидких или газообразных) смещает в сторону продуктов, т.е. в сторону прямой реакции.
Тема 3. Растворы. Существуют различные способы выражения концентрации: - Массовая доля растворенного вещества(ω) - отношение массы растворенного вещества (г, кг) к массе всего раствора в процентах - показывает, сколько граммов растворенного вещества содержится в 100 г раствора: ω = m р.в. / m р-ра · 100 %; m р-ра = Vр-ра · ρ р-р; mр-ра= m в-ва + mрастворителя; - Молярная концентрация См или М (молярность)– показывает количество молей растворенного вещества, содержащихся в 1л раствора: СM= υ р.в. / Vр-ра = m р.в. / V р-ра · M; - Нормальная или эквивалентная концентрация Сн или н (нормальность) – показывает число эквивалентов растворенного вещества, содержащихся в 1 л раствора: сн = Важнейшим свойством разбавленных растворов является осмос -односторонний переход растворителя через полупроницаемую мембрану из раствора с меньшей концентрацией в раствор с большей концентрацией. Сила, обуславливающая осмос, называется осмотическим давлением. Осмотическое давление зависит от концентрации раствора и температуры. Для разбавленных растворов неэлектролитов эта зависимость выражается уравнением Вант– Гоффа: осмотическое давление прямо пропорционально концентрации раствора и абсолютной температуре: Pocм= υ·R·T/V где V — объем раствора; υ — число молей растворенного вещества; R —универсальная газовая постоянная (R = 8,313 ·103 Дж/град моль); Т — абсолютная температура. Так как отношение υ/V— представляет собой концентрацию раствора См, выражаемую в моль/л, можно написать: Pocм= Cм· R·T Пользуясь уравнением, можно рассчитать осмотическое давление раствора, если известны его концентрация и температура. Зная Рoсм при заданной температуре, можно определить концентрацию растворов.
Решение типовых задач
Задача 1: Вычислите массовую долю раствора, полученного при растворении 4г хлорида кальция(СaCI2) в 396 мл воды (ρ= 1 г/мл). Дано: Решение: m(СaCI2) = 4 г Записываем формулу массовой доли раствора, исходя V(Н2О) = 396мл из условия задачи: ---------------------- m(СaCI2) ·100%
ω(р-ра) =? ω(р-ра) = ---------------------; m(р-ра) Из уравнения следует, что для вычисления массовой доли необходимо знать массу раствора, определяем ее по формуле: m (р-ра) = m(СaCI2) + m(Н2О) = 4г+ 396г= 400г, m(Н2О) = V(Н2О) · ρ(Н2О) = 396мл ·1 г/мл= 396г; Подставляем полученные данные, и данные задачи в уравнение массовой доли раствора: 4г ·100% ω(р-ра) = ------------ = 1%; 400г Ответ: массовая доля раствора равна 1%.
Задача 2: Сколько граммов серной кислоты(H2SO4) содержится в 150 мл 0,2М раствора? Дано: Решение: V(р-ра) = 150мл Записываем исходную формулу для определения См= 0,2М молярной концентрации раствора: -------------------------- m(Н2SO4) =? m(Н2SO4) СM= ---------------------------- М(Н2SO4) · V(р-ра) Из формулы выводим: m(Н2SO4) = СM · М(Н2SO4) · V(р-ра); Вычисляем молярную массу серной кислоты: М(Н2SO4) = 1·2 + 32 + 16·4 = 98 (г/моль); Объем раствора переводим из миллилитров в литры: V(р-ра) = 150мл = 0,15л Подставляем числовые значения в формулу: m(Н2SO4) = 0,2·98·0,15 = 2,94 (г) Ответ: масса серной кислоты равна 2,94г.
Задача 3. Вычислите молярную и нормальную 20 % раствора хлорида кальция плотностью 1,178 г/мл. Дано: Решение: ω = 20 % Найдеммассу раствора ρ = 1,178 г/мл _ mр-ра = V·ρ = 1000 · 1,178 = 1178 г. С -? Найдем массу CaCl2, содержащуюся в 1178 г. Сн -? 20 % раствора
20 г CaCl2 содержится в 100 г раствора х г — в 1178 г раствора х = 235,6 г. Молярность определим с помощью соотношения: С = υ /V υ = m/M = 235,6/111 = 2,1 моль M(CaCl2) = 40+35,5·2 = 111 г/моль С = 2,1/1 = 2,1 М Нормальная концентрация определяется с помощью соотношения: Сн = mр.в. / Мэкв V Мэ = М/ кол-во атомов Ме · валентность Ме =111/2 = 55,5 г/моль Сн = 235,6/55,5 · 1 = 4,2 н Ответ: С = 2,1 М; Сн = 4,2 н
|
||||||||
|
Последнее изменение этой страницы: 2021-06-14; просмотров: 79; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.149.237.52 (0.011 с.) |

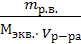 (·1000)
(·1000)


