Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Структурная организация мицелл слюны⇐ ПредыдущаяСтр 14 из 14
Почему же кальций и фосфаты не выпадают в осадок? Это обусловлено тем, что слюна является коллоидной системой, содержащей агрегаты достаточно малых нерастворимых в воде частиц (0,1-100 нм), находящихся во взвешенном состоянии. В коллоидной системе заложено две противоположные тенденции: её неустойчивость и стремление к самоупрочению, стабилизации. Суммарная величина большой поверхности коллоидных частиц резко увеличивает её способность поглощать поверхностным слоем другие вещества, что повышает устойчивость этих частиц. В случае органических коллоидов наряду с электролитами, которые являются ионными стабилизаторами, стабилизирующую роль выполняют белки.
Вещество, находящееся в дисперсном состоянии, образует нерастворимое «ядро» коллоидной степени дисперсности. Оно вступает в адсорбционное взаимодействие с ионами электролита (стабилизатор), находящегося в жидкой (водная) фазе. Молекулы стабилизатора диссоциируют в воде и участвуют в образовании двойного электрического слоя вокруг ядра (адсорбционный слой) и диффузного слоя вокруг такой заряженной частицы. Весь комплекс, состоящий из нерастворимого в воде ядра, дисперсной фазы и слоёв стабилизатора (диффузный и адсорбционный), охватывающих ядро, получил название мицеллы.
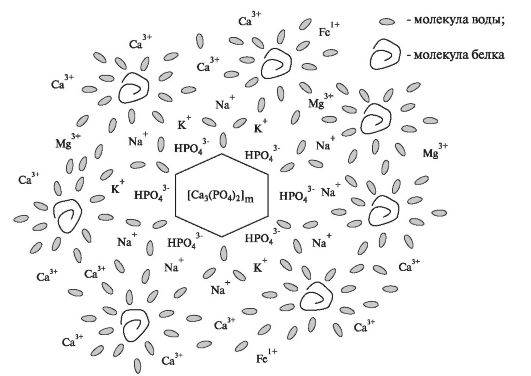
Какова же вероятная структурная организация мицелл в слюне? Предполагают, что нерастворимое ядро мицеллы образует фосфат кальция [Са3(РO4)2] (рис. 6.7).
Рис. 6.7. Предполагаемая модель строения мицеллы слюны с «ядром» из фосфата кальция.
На поверхности ядра сорбируются находящиеся в слюне в избытке молекулы моногидрофосфата (НРO42-). В адсорбционном и диффузных слоях мицеллы находятся ионы Са2+, являющиеся противоионами. Белки (в частности муцин), связывающие большое количество воды, способствуют распределению всего объёма слюны между мицеллами, в результате чего она структурируется, приобретает высокую вязкость, становится малоподвижной.
В кислой среде заряд мицеллы может уменьшиться вдвое, так как ионы моногидрофосфата связывают протоны H+. Появляются ионы дигидрофосфата - Н2РО4- вместо моногидрофосфата НРO4-. Это снижает устойчивость мицеллы, а ионы дигидрофосфата такой мицеллы не участвуют в процессе реминерализации эмали. Подщелачивание приводит к увеличению содержания фосфат-ионов, которые соединяются с Ca2+, образуя плохо растворимые соединения Са3(РO4)2, осаждающиеся в виде зубного камня.
Изменение структуры мицелл в слюне также приводит к образованию камней в протоках слюнных желёз и развитию слюннокаменной болезни.
Микрокристаллизация слюны
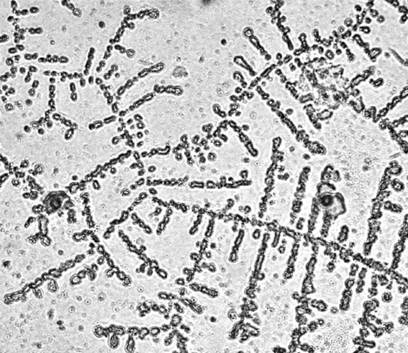
П.А. Леус (1977) впервые показал, что на предметном стекле после высушивания капли слюны формируются структуры, имеющие различное строение. Установлено, что характер микрокристаллов слюны имеет индивидуальные особенности, которые могут быть связаны с состоянием организма, тканей полости рта, характером питания и экологической обстановкой. При высушивании слюны здорового человека под микроскопом видны микрокристаллы, имеющие характерный рисунок сформированных «листьев папоротника» или «коралловых ветвей» (рис. 6.8).
Рис. 6.8. Строение микрокристаллов слюны здорового человека.
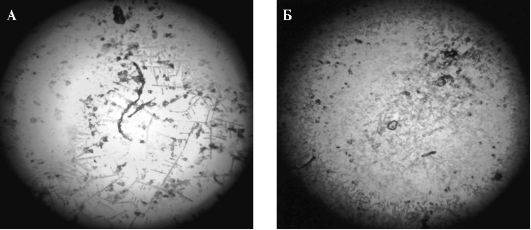
Существует определённая зависимость вида рисунка от степени вязкости слюны. При низкой вязкости микрокристаллы представлены мелкими, бесформенными, рассеянными, редко расположенными образованиями без чёткой структуры. В них включаются отдельные участки в виде тонких, слабо выраженных «листьев папоротника» (рис. 6.9, А). Напротив, при высокой вязкости смешанной слюны микрокристаллы плотно расположены и в основном хаотично ориентированы. Имеется большое количество зернистых и ромбовидных структур более тёмного цвета по сравнению с аналогичными образованиями, обнаруживаемыми в смешанной слюне с нормальной вязкостью (рис. 6.9, Б).
Рис. 6.9. Строение микрокристаллов смешанной слюны: А - слюна пониженной вязкости; Б - слюна повышенной вязкости. Употребление воды, насыщенной минералами с высокой электропроводностью (коралловая вода), нормализует вязкость и восстанавливает структуру жидких кристаллов ротовой жидкости.
Характер рисунка микрокристаллов также меняется при патологии зубочелюстной системы. Так для компенсированной формы течения кариеса характерен чёткий рисунок удлинённых кристаллопризматических структур, сросшихся между собой и занимающих всю поверхность капли. При субкомпенсированной форме течения кариеса в центре капли видны отдельные дендритные кристаллопризматические структуры небольших размеров. При декомпенспрованной форме кариеса по всей площади капли просматривается большое количество изометрически расположенных кристаллических структур неправильной формы.
С другой стороны, имеются сведения о том, что микрокристаллизация слюны отражает состояние организма в целом, поэтому предлагается использовать кристаллообразование слюны как тест-систему для экспресс-диагностики некоторых соматических заболеваний или общей оценки состояния организма.
Белки слюны
В настоящее время методом двухмерного электрофореза в смешанной слюне обнаружено около 1009 протеинов, из них 306 идентифицировано.
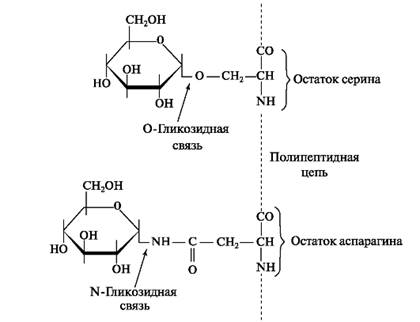
Большинство белков слюны является гликопротеинами, в которых количество углеводов достигает 4-40%. Секреты различных слюнных желёз содержат гликопротеины в различных пропорциях, что и определяет разницу в их вязкости. Так, наиболее вязкая слюна - секрет подъязычной железы (коэффициент вязкости 13,4), затем подчелюстной (3,4) и паротидной (1,5). В условиях стимуляции могут синтезироваться неполноценные гликопротеины и слюна становится менее вязкой. Слюнные гликопротеины неоднородны и различаются по мол. массе, подвижности в изоэлектрическом поле и содержанию фосфата. Олигосахаридные цепи в слюнных белках связываются с гидроксильной группой серина и треонина О-гликозидной связью или присоединяется к остатку аспарагина через N-гликозидную связь (рис. 6.10).
Рис. 6.10. Присоединение моносахаридных остатков в гликопротеинах через О- и N- гликозидные связи.
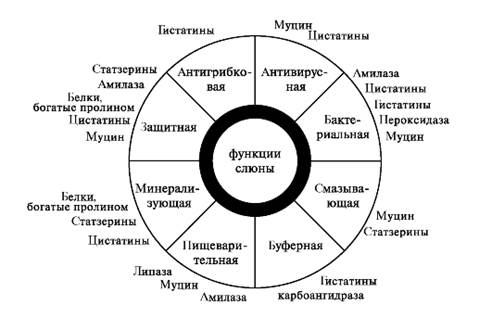
Источниками белков в смешанной слюне являются: 1. Секреты больших и малых слюнных желёз; 2. Клетки - микроорганизмы, лейкоциты, слущенный эпителий; 3. Плазма крови. Белки слюны выполняют множество функций (рис. 6.11). При этом один и тот же белок может участвовать в нескольких процессах, что позволяет говорить о полифункциональности слюнных белков.
Рис. 6.11. Полифункциональность белков смешанной слюны [Levine, 199].
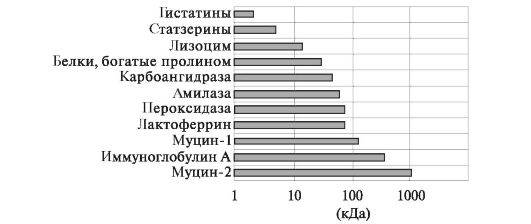
Секреторные белки. Ряд белков слюны синтезируются слюнными железами и представлены муцином (две изоформы М-1, М-2), белками, богатыми пролином, иммуноглобулинами (IgA, IgG, IgM), калликреином, паротином; ферментами - α-амилазой, лизоцимом, гистатинами, цистатинами, статзерином, карбоангидразой, пероксидазой, лактоферрином, протеиназами, липазой, фосфатазами и другими. Они имеют разную мол. массу; наибольшей обладают муцины и секреторный иммуноглобулин А (рис. 6.12). Эти белки слюны на слизистой оболочке полости рта формируют пелликулу, которая обеспечивает смазку, защищает слизистую от воздействия факторов внешней среды и протеолитических ферментов, выделяемых бактериями и разрушенными полиморфоядерными лейкоцитами, а также предотвращает её высушивание.
Рис. 6.12. Молекулярный вес некоторых основных секреторных белков слюны [по Levine М., 1993].
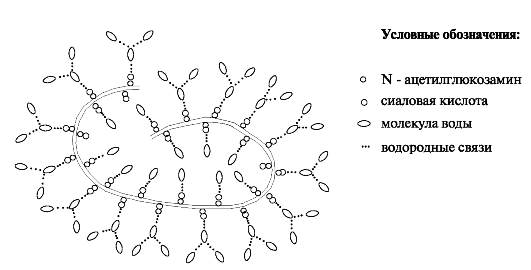
Муцины - высокомолекулярные белки, обладающие множеством функций. Обнаружены две изоформы этого белка, которые различаются по мол. массе: муцин-1 - 250 кДа, муцин-2 - 1000 кДа. Муцин синтезируется в поднижнечелюстных, подъязычных и малых слюнных железах. В полипептидной цепи муцина содержится большое количество серина и треонина, а всего их насчитывается около 200 на одну полипептидную цепь. Третьей, наиболее часто встречающейся аминокислотой в муцине, является пролин. К остаткам серина и треонина через 0-гликозидную связь присоединены остатки N-ацетил-нейраминовой кислоты, N-ацетилгалактозамина, фруктозы и галактозы. Сам белок напоминает по своему строению гребенку: короткие углеводные цепи, как зубья, торчат из жесткой, богатой пролином, полипептидной основы (рис. 6.13).
Рис. 6.13. Структура слюнного муцина.
Благодаря способности связывать большое количество воды муцины придают слюне вязкость, защищают поверхность от бактериального загрязнения и растворения фосфата кальция. Бактериальная защита обеспечивается совместно с иммуноглобулинами и некоторыми другими белками, присоединенными к муцину. Муцины присутствуют не только в слюне, но также в секретах бронхов и кишечника, семенной жидкости и выделениях из шейки матки, где играют роль смазки и защищают подлежащие ткани от химических и механических повреждений.
Олигосахариды, связанные с муцинами, обладают антигенной специфичностью, что соответствует группоспецифическим антигенам, которые присутствуют также в виде сфинголипидов и гликопротеинов на поверхности эритроцитов и в виде олигосахаридов в молоке и моче. Способность секретировать группоспецифические вещества в составе слюны передается по наследству. Концентрация группоспецифических веществ в слюне равна 10- 130 мг/л. Они в основном поступают с секретом малых слюнных желёз и точно соответствуют группе крови. Исследование группоспецифических веществ в слюне используется в судебной медицине для установления группы крови в тех случаях, когда это невозможно сделать иначе. В 20% случаев встречаются индивидуумы, у которых гликопротеины, содержащиеся в секретах, лишены характерной антигенной специфичности А, В или Н.
Белки, богатые пролином (ББП). Впервые об этих белках в 1971 г. сообщил Оппенхеймер. Они были открыты в слюне околоушных желёз и составляют до 70% от общего количества всех белков в этом секрете. Мол. масса ББП колеблется от 6 до 12 кДа. Исследование аминокислотного состава выявило, что 75% от общего числа аминокислот приходится на пролин, глицин, глутаминовую и аспарагиновую кислоты. Это семейство объединяют несколько белков, которые по свойствам делят на 3 группы: кислые ББП; основные ББП; гликозилированные ББП.
ББП выполняют в полости рта несколько функций. В первую очередь, они легко адсорбируются на поверхности эмали и являются компонентами приобретенной пелликулы зуба. Кислые ББП, входящие в состав пелликулы зуба, связываются с белком статерином и препятствуют его взаимодействию с гидроксиапатитом при кислых значениях рН. Таким образом, кислые ББП задерживают деминерализацию эмали зуба и ингибируют излишнее осаждение минералов, то есть поддерживают постоянство количества кальция и фосфора в эмали зуба. Кислые и гликозилированные ББП также способны связывать определенные микроорганизмы и таким образом участвуют в образовании микробных колоний в зубном налёте. Гликозилированные ББП участвуют в смачивании пищевого комка. Предполагают, что основные ББП играют определённую роль в связывании танинов пищи и тем самым защищают слизистую оболочку полости рта от их повреждающего действия, а также придают вязко-эластические свойства слюне.
Антимикробные пептиды в смешанную слюну попадают с секретом слюнных желёз из лейкоцитов и эпителия слизистой оболочки. Они представлены кателидинами; α- и β-дефензинами; кальпротектином; пептидами с высокой пропорцией специфических аминокислот (гистатины).
Гистатины (белки, богатые гистидином). Из секретов околоушных и подчелюстных слюнных желёз человека выделено семейство основных олиго- и полипептидов, отличающихся большим содержанием гистидина. Исследование первичной структуры гистатинов показало, что они состоят из 7-38 аминокислотных остатков и имеют большую степень сходства между собой. Семейство гистатинов представлено 12 пептидами с разной мол. массой. Считают, что отдельные пептиды этого семейства образуются в реакциях ограниченного протеолиза, либо в секреторных везикулах, либо при прохождении белков через железистые протоки. Гистатины -1 и -2 значительно отличаются от других членов этого семейства белков. Установлено, что гистатин-2 является фрагментом гистатина-1, а гистатины-4-12 образуются при гидролизе гистатина-3 при участии ряда протеиназ, в частности, калликреина.
Хотя биологические функции гистатинов окончательно не выяснены, уже установлено, что гистатин-1 участвует в образовании приобретенной пелликулы зуба и является мощным ингибитором роста кристаллов гидроксиапатитов в слюне. Смесь очищенных гистатинов подавлялает рост некоторых видов стрептококков (Str. mutans). Гистатин-5 подавляет действие вируса иммунодефицита и грибков (Candida albicans). Одним из механизмов такого антимикробного и антивирусного действия является взаимодействие гистатина-5 с различными протеиназами, выделенными из микроорганизмов ротовой полости. Также показано, они связываются с специфическими рецепторами грибов и формируют каналы в их мембране, обеспечивающий транспорт в клетку ионов K+, Mg2+ с мобилизацией АТФ из клетки. Мишенью для гистатинов в микробных клетках также являются митохондрии.
α- и β-Дефензины - низкомолекулярные пептиды с мол. массой 3-5 кДа, имеющие β-структуру и богатые цистеином. Источником α-дефензинов являются лейкоциты, а β-дефензинов - кератиноциты и слюнные железы. Дефензины действуют на грамположительные и грамотрицательные бактерии, грибы (Candida albicans) и некоторые вирусы. Они формируют ионные каналы в зависимости от типа клеток, а также агрегируют с пептидами мембран и таким образом обеспечивают перенос ионов через мембрану. Также в бактериальных клетках дефензины подавляют синтез белков.
Кателидины - пептиды, имеющие структуру α-спирали и не содержащие остатков цистеина; присутствуют в слюне, на поверхности слизистых оболочек и кожи. Кателидины способны связываться с липополисахаридами и двухвалентными катионами бактериальных мембран, что облегчает их встраивание в мембраны. В мембранах грамположительных и грамотрицательных бактерий, вирусов и паразитов каталидины формируют ионные каналы или поры.
В антимикробной защите также участвует белок кальпротектин - пептид, обладающий мощным противомикробным действием и попадающий в слюну из эпителиоцитов и нейтрофильных гранулоцитов.
Статерины (белки, богатые тирозином). Из секрета околоушных слюнных желёз выделены фосфопротеины, содержащие до 15% пролина и 25% кислых аминокислот, мол. масса которого равна 5,38 кДа. Они вместе с другими секреторными белками ингибирует спонтанную преципитацию фосфорнокальциевых солей на поверхности зуба, в ротовой полости и в слюнных железах. Статерины связывают Ca2+, ингибируя его осаждение и образование гидроксиапатитов в слюне. Также эти белки обладают способностью не только тормозить рост кристаллов, но и фазу нуклеации (образование затравки будущего кристалла). Определяются в эмалевой пелликуле и связываются N- концевой областью с гидроксиапатитами эмали. Статерины совместно с гистатинами ингибируют рост аэробных и анаэробных бактерий.
Лактоферрин - гликопротеин, содержащийся во многих секретах. Особенно его много в молозиве и слюне. Он связывает железо (Fe3+) бактерий и нарушает окислительно-восстановительные процессы в бактериальных клетках, оказывая тем самым бактериостатическое действие.
Иммуноглобулины. Иммуноглобулины подразделяют на классы в зависимости от структуры, свойств и антигенных особенностей их тяжёлых полипептидных цепей. В слюне присутствуют все 5 классов иммуноглобулинов - IgA, IgAs, IgG, IgM, IgE. Основным иммуноглобулином полости рта (90%) является секреторный иммуноглобулин А (SIgA, IgA2), который выделяется околоушными слюнными железами. Остальные 10% IgA2 секретируются малыми и поднижнечелюстными слюнными железами. Цельная слюна у взрослых содержит от 30 до 160 мкг/мл SIgA. Дефицит IgA2 встречается в одном случае на 500 человек и сопровождается частыми вирусными инфекциями. Все другие виды иммуноглобулинов (IgE, IgG, IgM) определяются в меньшем количестве. Они поступают из плазмы крови путём простой транссудации через малые слюнные железы и зубодесневую бороздку.
Лептин - белок с мол. массой 16 кДа участвует в процессах регенерации слизистой оболочки. Связываясь с рецепторами кератиноцитов, вызывает экспрессию факторов роста кератиноцитов и эпителия. Через фосфорилирование сигнальных белков STAT-1 и STAT-3 эти факторы роста способствуют дифференцировке кератиноцитов.
Гликопротеин 340 (gp340, ГП 340) - белок, богатый цистеином, с мол. массой 340 кДа; относится к антивирусным белкам. Являясь агглютинином ГП 340 в присутствии Ca2+ связывается с аденовирусами и вирусами, вызывающими гепатит, ВИЧ-инфекцию. Он также взаимодействует с бактериями ротовой полости (Str. mutans, Helicobacter pylori и др.) и подавляет их сцепление при образовании колоний. Ингибирует активность эластазы лейкоцитов и таким образом защищает белки слюны от протеолиза.
В слюне также обнаружены специфические белки - саливопротеин, способствующий отложению фосфорнокальциевых соединений на поверхности эмали зубов, и фосфопротеин - кальций-связывающий белок с высоким сродством к гидроксиапатиту, участвующий в образовании зубного камня и зубного налёта.
Помимо секреторных белков в смешанную слюну из плазмы крови поступают альбумины и глобулиновые фракции.
Ферменты слюны. Ведущую роль среди защитных факторов слюны играют ферменты различного происхождения - α-амилаза, лизоцим, нуклеазы, пероксидаза, карбоангидраза и др. В меньшей мере это относится к амилазе - основному ферменту смешанной слюны, участвующему в начальных этапах пищеварения.
Гликозидазы. В слюне определяется активность эндо- и экзогликозидаз. К эндогликозидазам в первую очередь относится α-амилаза слюны.
α-Амилаза. Слюнная α-амилаза расщепляет α(1-4)-гликозидные связи в крахмале и гликогене. По своим иммунохимическим свойствам и аминокислотному составу слюнная α-амилаза идентична панкреатической амилазе. Определенные различия между этими амилазами обусловлены тем, что слюнная и панкреатическая амилазы кодируются различными генами (АМУ1 и АМУ2).
Изоферменты α-амилазы представлены 11 белками, которые объединяют в 2 семейства: А и В. Белки семейства А имеют мол. массу 62 кДа и содержат остатки углеводов, а изоэнзимы семейства В лишены углеводного компонента и имеют меньшую мол. массу - 56 кДа. В смешанной слюне идентифицирован фермент, который отщепляет углеводный компонент и путём дегликозилирования изоамилаз, и белки семейства А превращаются в протеины семейства В.
α-Амилаза выделяется с секретом паротидной железы и губных мелких желёз, где концентрация ее составляет 648-803 мкг/мл и не связана с возрастом, но меняется в течение суток в зависимости от чистки зубов и приёма пищи.
Помимо α-амилазы в смешанной слюне определяется активность еще нескольких гликозидаз - α-L-фукозидазы, α- и β-глюкозидаз, α- и β-галактозидаз, α-D-маннозидазы, β-глюкуронидазы, β-гиалуронидазы, β-N-ацетилгексозаминидазы, нейраминидазы. Все они имеют различное происхождение и разные свойства. α-L-Фукозидаза выделяется с секретом околоушных слюнных желёз и расщепляет α-(1-2) гликозидные связи в коротких олигосахаридных цепях. Источником β-N-D-ацетилгексозаминидазы в смешанной слюне являются секреты больших слюнных желёз, а также микрофлоры полости рта.
α- и β-глюкозидазы, α- и β-галактозидазы, β-глюкуронидаза, нейраминидаза и гиалуронидаза имеют бактериальное происхождение и наиболее активны в кислой среде. β-D-гиалуронидаза катализирует гидролиз β-(14) гликозидных связей в гиалуроновой кислоте и других гликозаминогликанов. Изменение гиалуронидазной активности в слюне коррелирует с числом грамотрицательных бактерий и возрастает при воспалении десны. Вместе с гиалуронидазной активностью возрастает активность β-глюкуронидазы, которая в норме подавляется ингибитором β-глюкокуронидазы, поступающего из плазмы крови.
Показано, что, несмотря на большую активность кислых гликозидаз в слюне, эти ферменты способны расщеплять гликозидные цепи в слюнных муцинах с образованием сиаловых кислот и аминосахаров.
Лизоцим - белок с мол. массой около 14 кДа, полипептидная цепь которого состоит из 129 аминокислотных остатков и свёрнута в компактную глобулу. Трёхмерная конформация полипептидной цепи поддерживают 4 дисульфидные связи. Глобула лизоцима состоит из двух частей: в одной содержатся аминокислоты, имеющие гидрофобные группы (лейцин, изолейцин, триптофан), в другой части преобладают аминокислоты с полярными группами (лизин, аргинин, аспарагиновая кислота).
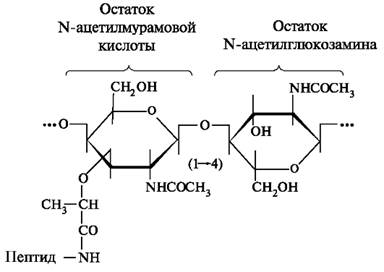
Источником лизоцима в ротовой жидкости являются слюнные железы. Лизоцим синтезируется эпителиальными клетками протоков слюнных желёз. Со смешанной слюной в ротовую полость поступает примерно 5,2 мкг лизоцима в 1 минуту. Другим источником лизоцима являются нейтрофилы. Бактерицидное действие лизоцима основано на том, что он катализирует гидролиз α(1-4)-гликозидной связи, соединяющей N-ацетилглюкозамин с N-ацетилмурамовой кислотой в полисахаридах клеточной оболочки микроорганизмов, что способствует разрушению муреина в стенке бактериальной клетки (рис. 6.14).
Рис. 6.14. Структурная формула муреина, присутствующего в мембране грамположительных бактерий.
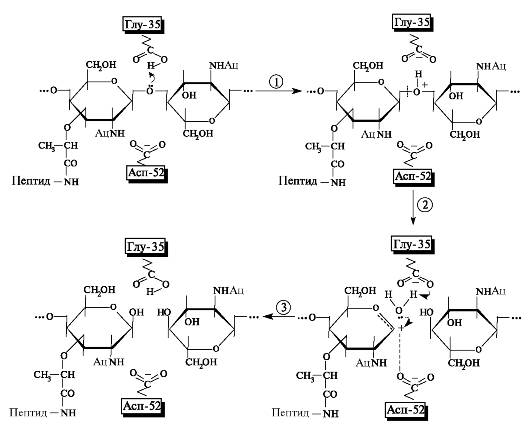
При размещении гексасахаридного фрагмента муреина в активном центре макромолекулы лизоцима все моносахаридные звенья сохраняют конформацию кресла, кроме кольца 4, которое попадает в слишком тесное окружение боковыми радикалами остатков аминокислот. Кольцо 4 принимает более напряжённую конформацию полукресла и при этом уплощается. Гликозидная связь между кольцами 4 и 5 располагается в непосредственной близости с аминокислотными остатками активного центра асп-52 и глу-35, которые и принимают активное участие в ее гидролизе (рис. 6.15).
Рис. 6.15. Гидролиз β(1-4) гликозидной связи в муреине ферментом лизоцимом.
Через гидролитическое расщепление гликозидной связи в полисахаридной цепи муреина разрушается бактериальная клеточная стенка, что составляет химическую основу антибактериального действия лизоцима.
Наиболее чувствительны к лизоциму грамположительные микроорганизмы и некоторые вирусы. Образование лизоцима снижается при некоторых видах заболеваний полости рта (стоматиты, гингивиты, пародонтиты).
Карбоангидраза - фермент, относящийся к классу лиаз. Катализирует расщепление связи С-О в угольной кислоте, что приводит к образованию молекул СО2 и Н2О.
В ацинарных клетках околоушных и поднижнечелюстных слюнных желёз синтезируется карбоангидраза VI типа и в составе секреторных гранул секретируется в слюну. Это белок с мол. массой 42 кДа и составляет около 3% от общего количества всех белков в паротидной слюне.
Секреция карбоангидразы VI в слюну подчиняется циркадным ритмам: её концентрация очень низкая во время сна и растёт в дневное время после пробуждения и завтрака. Эта циркадная зависимость очень схожа с β-амилазой слюны и доказывает положительную корреляцию между уровнем активности слюнной амилазы и концентрацией карбоангидразы VI. Это доказывает, что эти два фермента секретируются по схожим механизмам и, возможно, имеются в одних и тех же секреторных гранулах. Карбангидраза регулирует буферную ёмкость слюны. Новейшие исследования показали, что карбоангидраза VI связывается с пелликулой эмали и сохраняет свою ферментативную активность на поверхности зуба. На пелликуле карбоангидраза VI участвует в превращении гидрокарбоната и продуктов метаболизма бактерий в СО2 и Н2О. Ускоряя удаление кислот с поверхности зуба, карбоангидраза VI защищает эмаль зубов от деминерализации. Низкую концентрацию карбоангидразы VI в слюне обнаруживают у людей с активным кариозным процессом.
Пероксидазы относятся к классу оксидоредуктаз и катализируют окисление донора H2O2. Последняя в полости рта образуется микроорганизмами и её количество зависит от метаболизма сахарозы и аминосахаров. Катализирует образование H2O2 фермент супероксиддисмутаза (рис. 6.16).
Рис. 6.16. Реакция дисмутирования супероксид-аниона ферментом супероксиддисмутазой.
Слюнные железы секретируют в полость рта ионы тиоцианатов (SCN-), Cl-, I-, Br-. В смешанной слюне в норме присутствуют слюнная пероксидаза (лактопероксидаза) и миелопероксидаза, а при патологических состояниях появляется глутатионпероксидаза.
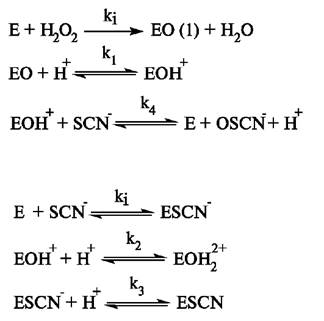
Слюнная пероксидаза относится к гемопротеинам и образуется в ацинарных клетках околоушных и поднижнечелюстных слюнных желёз. Она представлена множественными формами с мол. массой 78, 80 и 28 кДа. В секрете околоушной железы активность фермента в 3 раза выше, чем в поднижнечелюстной. Слюнная пероксидаза окисляет тиоцианаты SCN-. Механизм окисления SCN- включает несколько реакций (рис. 6.17).
Рис. 6.17. Этапы окисления тиоцианатов слюнной пероксидазой.
Наибольшее окисление SCN- слюнной пероксидазой протекает при рН 5,0-6,0, поэтому антибактериальный эффект этого фермента увеличивается при кислых значениях рН. Образующийся гипотиоцианат (ОSCN-) при рН <7,0 подавляет рост Str. mutans и оказывает в 10 раз более мощное антибактериальное действие, чем Н2О2. Вместе с тем при понижении рН возрастает опасность деминерализации твёрдых тканей зубов.
В процессе очистки и выделения слюнной пероксидазы было обнаружено, что фермент находится в комплексе с одним из ББП, что, по-видимому, позволяет участвовать этому ферменту в защите эмали зуба от повреждения.
Из полиморфноядерных лейкоцитов освобождается миелопероксидаза, окисляющая ионы Cl-, I-, Br-. Результатом взаимодействия системы «пероксидаза-перекись водорода-хлор» является образование гипохлорита (HOCl-). Объектом действия последнего являются аминокислоты белков микроорганизмов, которые превращаются в активные альдегиды или другие токсичные продукты. В связи с этим способность слюнных желёз, наряду с пероксидазой, экскретировать в значительных количествах ионы SCN-, Cl-, I-, Br-. В также следует отнести к функции антимикробной защиты.
Таким образом, биологическая роль присутствующих в слюне пероксидаз заключается в том, что, с одной стороны, продукты окисления тиоцианатов, галогенов ингибируют рост и метаболизм лактобацилл и некоторых других микроорганизмов, а с другой стороны, предотвращается аккумуляция молекул Н2О2 многими видами стрептококков и клетками слизистой оболочки полости рта.
Протеиназы (протеолитические ферменты слюны). В слюне отсутствуют условия для активного расщепления белков. Это обусловлено тем, что в ротовой полости нет денатурирующих факторов, а также присутствует большое количество ингибиторов протеиназ белковой природы. Низкая активность протеиназ позволяет сохранять белки слюны в нативном состоянии и полноценно выполнять свои функции.
В слюне здорового человека определяется невысокая активность кислых и слабощелочных протеиназ. Источником протеолитических ферментов в слюне преимущественно являются микроорганизмы и лейкоциты. В слюне присутствуют трипсиноподобные, аспартильные, сериновые и матриксные металлопротеиназы.
Трипсиноподобные протеиназы расщепляют пептидные связи, в образовании которых принимают участие карбоксильные группы лизина и аргинина. Из слабощелочных трипсиноподобных протеиназ в смешанной слюне наиболее активен калликреин. Кислый трипсиноподобный катепсин В в норме практически не определяется и его активность возрастает при воспалении. Катепсин D - кислая протеиназа лизосомного происхождения отличается тем, что в организме и в ротовой полости отсутствует специфический для неё ингибитор. Катепсин D освобождается из лейкоцитов, а также из воспалённых клеток, поэтому его активность увеличивается при гингивите и пародонтите.
Матриксные металлопротеиназы в слюне появляются при разрушении межклеточного матрикса тканей пародонта, а их источником являются десневая жидкость и клетки.
Белковые ингибиторы протеиназ. Слюнные железы являются источником большого количества секреторных ингибиторов протеиназ. Они представлены цистатинами и низкомолекулярными кислотостабильными белками.
Кислотостабильные белковые ингибиторы выдерживают нагревание до 90○С при кислых значениях рН, не теряя при этом своей активности. Это низкомолекулярные белки с мол. массой 6,5-10 кДа, способные подавлять активность калликреина, трипсина, эластазы и катепсина G.
Цистатины. В 1984 г. две группы японских исследователей независимо друг от друга сообщили о присутствии в слюне еще одной группы секреторных белков - слюнных цистатинов. Слюнные цистатины синтезируются в серозных клетках околоушных и поднижнечелюстных слюнных желёз. Это кислые белки с мол. массой 9,5-13 кДа. Всего обнаружено 8 слюнных цистатинов, из них 6 белков охарактеризовано (цистатин S, удлиненная форма цистатина S-HSP-12, SA, SN, SAI, SAIII). Слюнные цистатины ингибируют активность трипсиноподобных протеиназ - катепсинов В, Н, L, G, в активном центре которых присутствует остаток аминокислоты цистеина.
Цистатины SA, SAIII участвуют в образовании приобретённой пелликулы зубов. Цистатин SA-III содержит 4 остатка фосфосерина, которые вовлекаются в связывание с гидроксиапатитами эмали зуба. Высокая степень адгезии этих белков, вероятно, связана с тем, что цистатины имеют сходство в аминокислотной последовательности с другими адгезивными белками - фибронектином и ламинином.
Считают, что через ингибирование активности цистеиновых протеиназ слюнные цистатины выполняют антимикробную и антивирусную функции. Они также защищают белки слюны от ферментативного расщепления, поскольку секреторные белки могут функционировать только в интактном состоянии.
В смешанную слюну человека из плазмы крови попадают α1- ингибитор протеиназ (α1-антитрипсин), и α2-макроглобулин (α2-М).
α1-Антитрипсин определяется только в одной трети исследуемых образцов слюны. Это одноцепочечный белок, состоящий из 294 аминокислотных остатков, который синтезируется в печени. Он конкурентно ингибирует микробные и лейкоцитарные сериновые протеиназы, эластазу, коллагеназу, а также плазмин и калликреин.
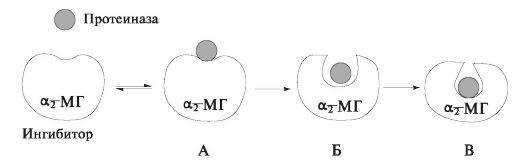
α2-Макроглобулин - гликопротеин с мол. массой 725 кДа, состоящий из 4 субъединиц и способный ингибировать любые протеиназы (рис. 6.18). Синтезируется в печени и в слюне определяется только у 10% обследуемых здоровых людей.
Рис. 6.18. Схема механизма ингибирования протеиназы α2-макроглобулином:
В смешанной слюне большая часть белковых ингибиторов протеиназ находится в комплексе с протеолитическими ферментами, и только небольшое количество в свободном состоянии. При воспалении количество свободных ингибиторов в слюне уменьшается, а находящиеся в комплексах ингибиторы подвергаются частичному протеолизу и теряют свою активность.
Поскольку слюнные железы являются источником ингибиторов протеиназ, то их используют для приготовления лекарственных препаратов («Трасилол», «Контрикал», «Гордокс» и др.).
Нуклеазы (РНК-азы и ДНК-азы) играют важную роль в осуществлении защитной функции смешанной слюны. Основным источником их в слюне являются лейкоциты. В смешанной слюне обнаружены кислые и щелочные РНК-азы и ДНК-азы, отличающиеся разными свойствами. В экспериментах было показано, что эти ферменты резко замедляют рост и размножение многих микроорганизмов в ротовой полости. При некоторых воспалительных заболеваниях мягких тканей полости рта их количество увеличивается.
Фосфатазы - ферменты класса гидролаз, отщепляющие неорганический фосфат от органических соединений. В слюне они представлены кислой и щелочной фосфатазами.
• Кислая фосфатаза (pH 4,8) содержится в лизосомах и попадает в смешанную слюну с секретами больших слюнных желёз, а также из бактерий, лейкоцитов и эпителиальных клеток. В слюне определяется до 4 изоферментов кислой фосфатазы. Активность фермента в слюне, как правило, увеличивается при пародонтите и гингивите. Имеются противоречивые сведения об изменении активности этого фермента при кариесе зубов. • Щелочная фосфатаза (рН 9,1-10,5). В секретах слюнных желёз здорового человека активность щелочной фосфатазы низка и её происхождение в смешанной слюне связывают с клеточными элементами. Активность этого фермента, также как и кислой фосфатазы, увеличивается при воспалении мягких тканей полости рта и кариесе. Вместе с тем полученные данные об активности этого фермента очень противоречивы и не всегда укладываются в определенную схему.
6.5. САЛИВАДИАГНОСТИКА
Исследование слюны относится к неинвазивазивным методам и проводится для оценки возрастного и физиологического статуса, выявления соматических заболеваний, патологии слюнных желёз и тканей полости рта, генетических маркёров, мониторинга лекарственных средств.
С появлением новых количественных методик для лабораторных исследований всё чаще используют смешанную слюну. Преимуществом таких методов по сравнению с исследованием плазмы крови являются: • неинвазивный сбор слюны, что делает удобным её получение, как у взрослых, так и у детей; • отсутствие у пациента стресса при проведении процедуры получения слюны; • возможность использовать простые приборы и приспособления для получения слюны; • отпадает необходимость присутствия врача и среднего медицинского персонала при заборе слюны; • существует возможность повторного и неоднократного получения материала для исследований; • слюна может определённое время сохраняться на холоде до проведения исследований.
|
|||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 184; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.137.64 (0.117 с.) |