
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Круговорот элементов, преобладающих в атмосфереСодержание книги
Поиск на нашем сайте
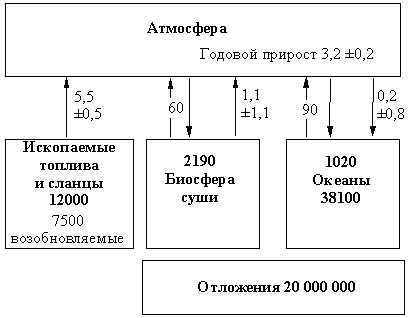
Между литосферой, гидросферой, атмосферой и живыми организмами Земли постоянно происходит обмен химическими элементами. Этот процесс имеет циклический характер: переместившись из одной сферы в другую, элементы вновь возвращаются в первоначальное состояние. Круговорот элементов имел место в течение всей истории Земли, насчитывающей 4,5 млрд. лет. Гигантские массы химических веществ переносятся водами Мирового океана. В первую очередь это относится к растворенным газам – диоксиду углерода, кислороду, азоту. Холодная вода высоких широт растворяет газы атмосферы. Поступая с океаническими течениями в тропический пояс, она их выделяет, так как растворимость газов при нагревании уменьшается. Поглощение и выделение газов происходит также при смене теплых и холодных сезонов года. Огромное влияние на природные циклы некоторых элементов оказало появление жизни на планете. Это, в первую очередь, относится к круговороту главных элементов органического вещества – углерода, водорода и кислорода, а также таких жизненно важных элементов как азот, сера и фосфор. Живые организмы оказывают влияние и на круговорот многих металлических элементов. Несмотря на то, что суммарная масса живых организмов Земли меньше массы земной коры в миллионы раз, растения и животные играют важнейшую роль в перемещении химических элементов. Деятельность человека также оказывает влияние на круговорот элементов. Особенно заметным оно стало в последнее столетие. При рассмотрении химических аспектов глобальных изменений в круговоротах химических элементов следует учитывать не только изменения в природных круговоротах за счет добавления или удаления присутствующих в них химических веществ в результате обычных циклических и/или вызванных человеком воздействий, но и поступление в окружающую среду химических веществ, ранее не существовавших в природе. Рассмотрим несколько наиболее важных примеров циклического перемещения и миграции химических элементов. Углерод – основной элемент жизни – содержится в атмосфере в виде диоксида углерода. В океане и пресных водах Земли углерод находится в двух главных формах: в составе органического вещества и в составе взаимосвязанных неорганических частиц: гидрокарбонат-иона НСО3–, карбонат иона СО32– и растворенного диоксида углерода СО2. Большое количество углерода сосредоточено в виде органических соединений в животных и растениях. Много «неживого» органического вещества имеется в почве. Углерод литосферы содержится также в карбонатных минералах (известняк, доломит, мел, мрамор). Часть углерода входит в состав нефти, каменного угля и природного газа. Связующим звеном в природном круговороте углерода является диоксид углерода (рис. 1).
Рис. 1. УПРОЩЕННАЯ СХЕМА глобального цикла углерода. Числа в рамках отражают размеры резервуаров в миллиардах тонн – гигатоннах (Гт). Стрелки показывают потоки, а связанные с ними числа выражены в Гт/год. Самыми крупными резервуарами углерода являются морские отложения и осадочные породы на суше. Однако бoльшая часть этого вещества не взаимодействует с атмосферой, а подвергается круговороту через твердую часть Земли в геологических временных масштабах. Поэтому эти резервуары играют лишь второстепенную роль в сравнительно быстром цикле углерода, протекающем с участием атмосферы. Следующим по величине резервуаром является морская вода. Но и здесь глубинная часть океанов, где содержится основное количество углерода, не взаимодействует с атмосферой так быстро, как их поверхность. Самыми маленькими резервуарами являются биосфера суши и атмосфера. Именно небольшой размер последнего резервуара делает его чувствительным даже к незначительным изменениям процентного содержания углерода в других (больших) резервуарах, например, при сжигании ископаемых топлив. Современный глобальный цикл углерода состоит из двух меньших циклов. Первый из них заключается в связывании диоксида углерода в ходе фотосинтеза и новом образовании его в процессе жизнедеятельности растений и животных, а также при разложении органических остатков. Второй цикл обусловлен взаимодействием диоксида углерода атмосферы и природных вод: СО2 + Н2О Н2СО3 НСО3– СО32– + Са2+ = СаСО3↓ В последнее столетие в углеродный цикл существенные изменения внесла хозяйственная деятельность человека. Сжигание ископаемого топлива – угля, нефти и газа – привело к увеличению поступления диоксида углерода в атмосферу. Это не очень сильно влияет на распределение масс углерода между оболочками Земли, но может иметь серьезные последствия из-за усиления парникового эффекта. Кислород на Земле содержится, в основном, в литосфере в виде диоксида кремния и силикатов. Кроме того, кислород есть в составе воды, образующей гидросферу. В атмосфере кислород находится в молекулярном виде. Он является продуктом процессов жизнедеятельности растений и в то же время одним из основных условий существования жизни на Земле. Образование свободного кислорода связано со световой энергией Солнца. Исходным сырьем для образования кислорода служит вода. Почти весь свободный кислород на Земле – это результат реакции фотосинтеза органического вещества из воды и диоксида углерода. Некоторое количество кислорода образуется при разложении воды в верхних слоях атмосферы. Кислород входит в состав многих органических соединений. Между живыми организмами и атмосферой происходит постоянный обмен кислородом. Несмотря на выделение кислорода зелеными растениями, его содержание в атмосфере не увеличивается. Одновременно с фотосинтезом происходит разложение органического вещества, при этом поглощается практически весь выделившийся кислород. Часть кислорода расходуется на окисление неорганических веществ. Незначительное количество атмосферного кислорода участвует в цикле образования и разрушения озона. Водород на Земле находится, преимущественно, в гидросфере в составе воды. Содержание его в литосфере и атмосфере сравнительно невелико. Он входит также в состав органических веществ. Огромные массы водорода, наряду с кислородом, участвуют в круговороте воды – одном из наиболее мощных циклических процессов на планете. Особенностью водорода является его способность (наряду с гелием) уходить из поля тяготения Земли благодаря своей малой атомной массе. Эти потери компенсируются выделением водорода из мантии. Молекулярный водород поступает в атмосферу Земли в результате вулканической деятельности, его выделяют также некоторые бактерии. После появления на нашей планете живых организмов водород стал связываться в органическом веществе. Азот, вследствие исключительной прочности молекулы N2, почти полностью сосредоточен в атмосфере. Часть газообразного азота растворена в природных водах, которые содержат и растворенные азотсодержащие органические вещества и неорганические ионы: катион аммония, нитрит-ион и нитрат-ион. Поскольку азот не образует нерастворимых солей, он только в редких случаях накапливается в литосфере. Так, в южноамериканской пустыне Атакама есть скопления нитрата натрия, который, несмотря на высокую растворимость в воде, сохраняются благодаря исключительно сухому климату. Слово «азот» буквально означает «безжизненный», поскольку он не поддерживает дыхание. Однако этот элемент является обязательной составной частью белков. Поэтому азот в значительном количестве содержится в живых организмах и «мертвом» органическом веществе. Азот непрерывно перемещается между атмосферой, океаном, живыми организмами и почвой. В атмосфере под действием электрических разрядов азот переходит сначала в монооксид азота, а затем в диоксид азота. Влага воздуха и кислород превращают диоксид азота в азотную кислоту. 4NO2 + 2H2O + O2 = 4HNO3 Соединения азота легко растворяются в атмосферных осадках и попадают на поверхность Земли. Большое значение в связывании атмосферного азота имеет жизнедеятельность клубеньковых бактерий, обитающих на корнях бобовых растений. Ферменты этих бактерий превращают молекулярный азот в соединения, которые затем усваиваются растениями. Из растений связанный азот поступает в организмы животных, в основном, в виде аминокислот и белков. После гибели живых организмов органические вещества превращаются в неорганические соединения, снова усваиваемые растениями. Часть азота в почвах превращается в молекулярный азот и переходит в атмосферу. Молекулярный азот образуется также при полном окислении органических веществ. Соединения азота попадают в атмосферу с выбросами промышленных предприятий и транспорта, а в природные воды – с бытовыми и промышленными отходами. Слишком большое количество растворимых соединений азота в почве приводит к росту их содержания в продуктах питания и питьевой воде, это может стать причиной серьезных заболеваний. Соединения азота накапливаются в водоемах и вызывают зарастание озер и водохранилищ. Пока подобные явления наблюдаются лишь в отдельных районах, где в окружающую среду попадает много соединений азота. В целом же природа пока справляется с тем количеством связанного азота, которое производится человеком.
Сера содержится в атмосфере в небольших количествах, в основном, в виде сероводорода и диоксида серы. Довольно много этого элемента (в виде сульфат-ионов) находится в гидросфере. В литосфере сера встречается в виде простого вещества (самородная сера) и в составе многочисленных минералов – сульфидов и сульфатов металлов. Кроме того, соединения серы есть в углях, сланцах, нефти, природном газе. Сера входит в состав многих белков, поэтому она всегда содержится в организмах животных и растений. Выделяясь из глубин Земли, газообразные соединения серы (преимущественно диоксид серы и сероводород) растворяются в подземных водах. Здесь они образуют малорастворимые сульфиды (главным образом пирит – дисульфид железа FeS2) и сульфаты (в частности, сульфат кальция CaSO4). Образуется также самородная сера: 2H2S + SO2 = 3S + 2H2O Газообразные соединения серы попадают в почву, атмосферу и Мировой океан, где их поглощают серные бактерии. Поглощение соединений серы бактериями происходит и в почве. Малорастворимые сульфиды, содержащиеся в горных породах, в результате жизнедеятельности некоторых бактерий частично окисляются, превращаясь в легко растворимые сульфаты: FeS + 2O2 = FeSO4 Водорастворимые сульфаты выносятся с поверхности суши с речным стоком, поставляя сульфат-ионы в Мировой океан. В результате активного связывания серы в земной коре, гидросфере и живых организмах, содержание сероводорода и диоксида серы в атмосфере мало и непостоянно. Под действием кислорода и озона эти вещества постепенно превращаются в серную кислоту: 2SO2 + О2 SO2 + О3 = SО3 + О2 SО3+ H2О = H2SO4 H2S + 2О3 = H2SO4 + О2 Серная кислота возвращается на землю с атмосферными осадками Хозяйственная деятельность людей приводит к увеличению содержания соединений серы в атмосфере и гидросфере. В результате изменений в методах животноводства и земледелия (выпас, вспашка, мелиорация) увеличились выбросы серосодержащих соединений в виде пыли. Еще больше серы попадает в атмосферу в форме диоксида серы при обжиге сульфидных руд. Это, в свою очередь, вызывает увеличение потока серы, попадающей из атмосферы в океаны и на поверхность суши. Природные воды загрязняются также удобрениями с полей и стоками промышленных предприятий. Таким образом, человеческая деятельность существенно изменила круговорот серы между атмосферой, океанами и поверхностью суши. Эти изменения сильнее, чем воздействие человека на цикл углерода. Как и в случае глобального цикла углерода, техногенные выбросы серы в окружающую среду мало влияют на распределение масс этого элемента на поверхности Земли. Однако повышенное содержание серы в промышленных и бытовых отходах создают опасность для жизни на обширных территориях. Массированный выброс диоксида серы в атмосферу порождает кислотные дожди, которые могут выпадать далеко за пределами индустриальных районов. Загрязнение природных вод растворимыми соединениями серы несет угрозу живым организмам внутренних водоемов и прибрежных областей морей.
Фосфор содержится в земной коре и живых организмах в небольших количествах; тем не менее, он имеет очень большое значение для растений и животных. Без этого элемента невозможен синтез белков. Кроме того, фосфор входит в состав костей и зубов. Именно недостаточное количество фосфора чаще всего ограничивает рост массы живого вещества. Значительная часть фосфора содержится в почвах. Фосфор образует многочисленные минералы (например, фосфориты), однако они не часто встречаются в горных породах в больших количествах. В атмосфере фосфор практически отсутствует. В природных водах фосфор присутствует в составе органических соединений и взвешенных твердых частиц. Лишь небольшая его часть находится в растворе в виде ортофосфат-иона РО43– и гидроортофосфат-иона НРО42–. В океане «органический» фосфор многократно переходит от одного живого организма к другому и медленно накапливается в донных отложениях в виде малорастворимых фосфатов. Эти потери фосфора компенсируются только из одного источника – выветривающихся горных пород суши, куда они попадают со дна океанов в результате длительных геологических процессов. Деятельность человека нарушила природный круговорот фосфора. Соединения фосфора используются для производства удобрений и моющих средств. Это приводит к загрязнению водоемов соединениями фосфора. В таких условиях фосфор перестает быть элементом, ограничивающим рост массы живых существ, особенно водорослей и других водных растений. Натрий – один из главных элементов, аккумулированных в земной коре в процессе ее выплавления. Он легко освобождается из структур силикатов при выветривании кристаллических пород. Катион Na+ переносится с континентальным стоком в океан. С «солеными ветрами» натрий частично возвращается на сушу. Существенно меньшее количество элемента выносится с поверхности суши в океан с ветровой пылью. Натрий постоянно присутствует в почвах. Он принимает активное участие в засолении почв, в которых образует соли с хлорид- и сульфат-ионами. В организмах соли натрия играют существенную роль. Хлорид натрия является обязательным компонентом жидких тканей животных и клеточного сока растений, поэтому он в больших количествах поглощается растительными и особенно животными организмами. Из растительных остатков соли натрия легко выщелачиваются. Натрий активно адсорбируется осадками морей, поэтому большая его масса содержится в осадочной оболочке. Хлор, в отличие от натрия, содержится в гранитном слое в небольших количествах. Он вовлекается в круговорот не за счет разрушения горных пород, а благодаря процессам дегазации мантии и выносу вулканических газов. Этот элемент перемещается между оболочками Земли параллельно с натрием. Он аккумулируется в океанской воде в форме хлорид-ионов. Значительные массы хлора, так же как и натрия, многие миллионы лет мигрируют с поверхности суши в Мировой океан. Вторая особенность глобального геохимического цикла хлора, выраженная еще более сильно, чем в цикле натрия – активная миграция в атмосфере в составе аэрозолей и возврат значительных масс этого элемента на сушу. На территориях, где отсутствуют стоки, хлор вместе с натрием накапливается в почве и замкнутых водоемах. Хлор имеет важное физиологическое значение. Он содержится в живых организмах в виде хлороводородной кислоты, ее солей (преимущественно хлорида натрия). Поэтому значительные массы хлора, наряду с натрием, участвуют в биологическом круговороте. Кальций относится к главным элементам земной коры. Содержание этого элемента уменьшается от глубин Земли к гранитному слою литосферы. Кальций в земной коре образует многочисленные минералы. При выветривании силикатов освобождается большое количество этого элемента. Его водорастворимые соединения, главным образом гидрокарбонат, поступают в природные воды и мигрируют с ними в океан. Хотя этот процесс развивается на протяжении более 2 млрд. лет, концентрация элемента в океанической воде всего лишь в 30 раз больше, чем в речных водах. Это обусловлено низкой растворимостью карбоната кальция, а главное – активным поглощением элемента планктонными организмами и выведением его в осадок. Данные процессы способствуют накоплению кальция в составе мощных толщ известняков, доломитов, известковых глин. Кальций играет важную роль в физиологии организмов. В растениях он участвует в углеводном и азотном обмене, животным он необходим для построения костного скелета. Кальций участвует и во многих других биохимических процессах. Таким образом, для процессов глобального массообмена кальция главное значение имеют биологический круговорот и водная миграция иона в системе суша – океан. Калий вместе с другими щелочными и щелочно - земельными химическими элементами аккумулировался в земной коре в процессе ее выплавления. Калий входит в состав наиболее распространенных силикатов. При их разрушении этот элемент, в основном, переходит в глинистые минералы. В то же время он частично высвобождается и вовлекается в водную миграцию. Ионы калия активно абсорбируются дисперсным минеральным веществом, а также поглощаются высшими растениями, поэтому калий более прочно удерживается в пределах суши, чем кальций и натрий. В океан некоторое количество калия выносится в виде ионов, однако большая масса элемента переносится в форме взвесей глинистых частиц. Калий активно мигрирует в системе поверхность океана – атмосфера – поверхность океана в составе аэрозолей. Этот элемент играет важную роль в жизни растений и животных. Он принимает участие в фотосинтезе, влияет на обмен веществ, частично сохраняется в мертвом органическом веществе. Широкое использование минеральных удобрений пока не оказывает заметного влияние на круговорот калия, однако миграция его сильно возросла в результате эрозии почв. Кремний – второй (после кислорода) по массе элемент земной коры. Он интенсивно накапливался в веществе литосферы в процессах его выплавления. Кремний в виде высокодисперсного кремнезема (SiO2) повсеместно содержится в природных водах и используется многими морскими организмами для построения скелета. Биологический круговорот кремния в океане обусловлен преимущественно жизнедеятельностью диатомовых и радиоляриевых планктонных водорослей и последующим растворением их скелетов. Для водной миграции кремния характерно преобладающее движение от суши к океану, которое не компенсируется в обратном направлении. Значительное количество кремния перемещается в виде растворимых соединений, однако в составе обломочного материала его выносится во много раз больше. Свинец накапливается в земной коре не только за счет выплавления его из вещества мантии, но и в результате радиоактивного распада изотопов урана (238U, 235U) и тория (232Th). При выветривании горных пород катионы свинца высвобождаются, большая часть их сорбируется высокодисперсными глинистыми частицами и гидроксидами железа, а меньшая поступает в грунтовые воды. В составе взвесей, а также в виде органических соединений, простых и комплексных ионов свинец выносится с речным стоком и осаждается преимущественно в дельтах и узкой прибрежной полосе шельфа. Небольшое количество свинца, попадающее в океан, выпадает в осадок благодаря биофильтрации морской воды организмами планктона. Таким образом, Мировой океан – глобальный аккумулятор растворимых форм свинца. На суше свинец поглощается растениями. Во время лесных пожаров значительные массы элемента поступают в атмосферу (в виде дыма). Кроме того, свинец содержится в высокодисперсной минеральной пыли. «Время жизни» свинецсодержащих аэрозолей составляет около 7 суток. Годовая добыча свинца значительно превышает и вынос растворимых форм, и годовой захват растительностью этого элемента. Техногенное рассеяние свинца, в отличие от рассеяния газообразных веществ, не распространяется на большие пространства, а сосредотачивается, в основном, вдоль автомагистралей, это связано с использованием тетраэтилсвинца в качестве антидетонатора автомобильных бензинов. Цинк обычно сопутствует свинцу в земной коре, однако биосферная геохимия этих элементов существенно различается. В отличие от свинца, цинк – один из главных микроэлементов, он входит в состав многих ферментов, участвует в синтезе рибонуклеиновых кислот и хлорофилла. Большая часть цинка в растениях связана с легко разрушающимися тканями и быстро удаляется из растительных остатков (в отличие от свинца, который прочно фиксирован в растительных остатках). Водорастворимые формы цинка составляют очень небольшую часть от общей массы металла, однако они активно вовлекаются в водную миграцию. Цинк активно участвует в массообмене между сушей и атмосферой. С атмосферными осадками на поверхность суши водорорастворимых форм цинка выпадает значительно больше, чем захватывается ветром в атмосферу в виде минеральной пыли. Из приведенных примеров круговоротов видно, что глобальная система циклической миграции химических элементов обладает высокой способностью к саморегуляции, при этом огромную роль в круговороте химических элементов играет биосфера. В то же время хозяйственная деятельность человека вызывает деформацию природных циклов массообмена и, следовательно, изменение состава окружающей среды. Эти изменения происходят значительно быстрее, чем совершаются процессы генетической адаптации организмов и видообразования. Зачастую хозяйственные действия настолько непродуманны или несовершенны, что создают острую экологическую опасность. Изучение процессов массообмена, связывающих в единое целое все оболочки Земли, должно помочь в создании системы контроля за эколого-геохимическим состоянием окружающей среды и разработке научно обоснованного прогноза экологических последствий хозяйственных действий и новых технологий.
26. Круговорот серы и фосфора Фосфор входит в состав нуклеиновых кислот, АТФ, ферментов, костной ткани и эмали зубов и является важным биогенным элементом. Природный источник фосфора — горные породы, из которых он высвобождается при эрозии. Большая часть фосфора при этом снова теряется, т.к. вода смывает его в море, где он связан в морских осадках. В мелководных морских осадках фосфор доступен для рыб, которых в свою очередь поедают морские птицы. Они возвращают фосфор в круговорот со своими экскрементами (гуано), снова смываемыми в море, где их используют планктонные организмы и рыбы. Фосфор, содержащийся в почве, поглощают корни растений и используют его в процессах обмена веществ: синтез АТФ, нуклеиновых кислот и других органических соединений. При поедании растений животными происходит перераспределение фосфора, и он включается в органические соединения животных. При разложении погибших растений и животных редуцентами соединения фосфора возвращаются в почву и воды. Вследствие легкой окисляемости фосфор в свободном состоянии в природе не встречается. Из природных соединений фосфора самым важным является ортофосфат кальция, который в виде минерала фосфорита иногда образует большие залежи. Богатейшие месторождения фосфоритов находятся в Южном Казахстане в горах Каратау. Фосфор, как и азот, необходим для всех живых существ, так как он входит в состав некоторых белков как растительного, так и животного происхождения. В растениях фосфор содержится главным образом в белках семян, в животных организмах - в белках молока, крови, мозговой и нервной тканей. В виде кислотного остатка фосфорной кислоты фосфор входит в состав нуклеиновых кислот - сложных органических полимерных соединений, принимающих непосредственное участие в процессах передачи наследственных свойств живой клетки. Сырьем для получения фосфора и его соединений служат фосфориты и апатиты. Природный фосфорит или апатит измельчают, смешивают с песком и углем и накаливают в печах с помощью электрического тока без доступа воздуха всех живых организмах. Основной источник его - горные породы (главным образом изверженные). Представлен он в основном апатитом и фторапатитом. В осадочных породах это обычно вивианит, вавелит, фосфорит. С образованием биосферы высвобождение фосфора из горных пород усилилось, в результате произошло значительное перераспределение его. В превращениях фосфора большую роль играет живое вещество. Организмы усваивают фосфор из почв, водных растворов. Фосфор входит в состав белков, нуклеиновых кислот, и других органически соединений. Особенно много фосфора в костях животных. С гибелью организмов фосфор возвращается в почву, он концентрируется в виде морских фосфатных конкреций, отложений костей рыб, что создает условия для образования богатых фосфором пород, которые в свою очередь служат источником фосфора в биогенном цикле.
КРУГОВОРОТ СЕРЫ. Сера встречается в природе как в свободном состоянии (самородная сера), так и в различных соединениях. Очень распространены соединения серы с различными металлами. Из соединений серы в природе распространены также сульфаты, главным образом, кальция и магния. Наконец, соединения серы содержатся в организмах растений и животных. Сера широко используется в народном хозяйстве. В виде серного цвета серу используют для уничтожения некоторых вредителей растений. Она применяется также для приготовления спичек, ультрамарина (синяя краска), сероуглерода и ряда других веществ. Круговорот серы происходит в атмосфере и литосфере. Поступление серы в атмосферу происходит в виде сульфатов, серного ангидрида и серы из литосферы при вулканических извержениях, в виде сероводорода за счет распада пирита (FeS2) и органических соединений. Антропогенным источником поступления серы в атмосферу являются тепловые электростанции и другие объекты, где происходит сжигание угля, нефти и других углеводородов, а поступление серы в литосферу, в частности в почву, происходит с удобрениями и органическими соединениями. Перенос соединений серы в атмосфере осуществляется воздушными потоками, а выпадение на земную поверхность либо в виде пыли, либо с атмосферными осадками в виде дождя (кислотные дожди) и снега. На поверхности Земли в почве и водоемах происходит связывание сульфатных и сульфитных соединений серы кальцием с образованием гипса (CaSO4). Помимо этого происходит захоронение серы в осадочных породах с органическими остатками растительного и животного происхождения, из которых в дальнейшем происходит образование угля и нефти. В почве изменение соединений серы происходит с участием сульфобактерий, использующих сульфатные соединения и выделяющих сероводород, который поступая в атмосферу и окисляясь снова переходит в сульфаты. Кроме этого сероводород в почве может восстанавливаться до серы, которая денитрифицирующими бактериями окисляется до сульфатов. Среднее содержание серы в земной коре 0,047%. Сера входит в состав белков, витаминов, ферментов и играет важную роль в жизнедеятельности организмов. В почвах она находится в виде сульфатов (SO42-) — это основная доступная форма серы, которая восстанавливается автотрофами и включается в белки. В нефти встречаются её органические соединения. В иле водоёмов, в областях, лишённых кислорода (в аэробных условиях), сульфатредуцирующие бактерии восстанавливают сульфаты до сероводорода (H2S), при этом выделяется кислород. Другие виды бактерий, например, зелёные серобактерии, окисляют сероводород до серы (S). После гибели бактерий сера попадает в донные отложения, куда серу привносят также остатки растений и животных, создавая скопления самородной серы биохимического происхождения. Тианобактерии осуществляют аэробное окисление сероводорода до сульфатов (H2S ® SO42-), которые являются доступными для растений.
Демонстрационный опытВзаимодействие оксида углерода (IV) с раствором гидроксида кальция. Опыт служит иллюстрацией части круговорота углерода в природе, связанной с его изъятием из общего цикла. Происходит связывание газа CO2 в недоступные для живых организмов карбонаты.
27. Проекты с экологическим содержанием
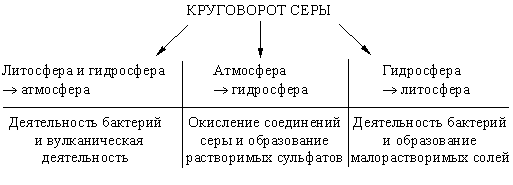
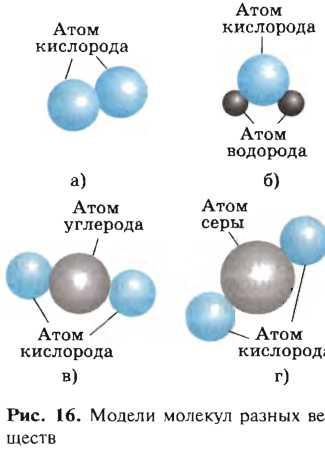
VII. Задачи с экологическим содержанием (6 часов) 28. Задачи с экологическим содержанием Основные понятия химии Предмет химии. Вещества. Задание 1. Согласны ли вы со следующими высказываниями: · Сегодня на Земле нет людей, которые не пользовались бы продукцией химической промышленности. · Сегодня на Земле нет людей, которые не ощущали бы на себе вредных воздействий работы химической промышленности. · Большинство химических предприятий безвредно для природы. · Безвредных химических предприятий не бывает. · Если продукция нового химического предприятия будет нравиться людям, его обязательно нужно построить. · Новое химическое предприятие нужно строить только в том случае, если оно не будет вредить природе и людям. · Развитие химической промышленности приносит больше вреда, чем пользы, и развивать ее не нужно. · Развитие химической промышленности приносит больше пользы, чем вреда, и нужно максимально развивать ее, даже если это вредит природе. Какие из этих высказываний сделаны хемофилами, а какие – хемофобами? К какой группе вы относите себя? Задание 2 . На рисунке приведены модели молекул некоторых веществ. Какие из этих веществ есть в атмосфере Земли? Что вы можете сказать об источниках их появления и об их значении для живых существ?
Задание 3. Приведите примеры физических тел и веществ, присутствие которых в природе (воде, почве, воздухе) является загрязнением. Какой вид загрязнения является более заметным: загрязнение физическими телами (например, осколками бутылок, обрывками бумаги) или загрязнение веществами (например, метан в атмосфере или соли свинца в воде)? Согласны ли вы с тем, что более заметное загрязнение является и более вредным? Почему?
|
||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 147; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.58.191.60 (0.031 с.) |

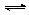 Н2СО3
Н2СО3
 кислород
кислород


