
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Раздел 1. Органическая химияСодержание книги
Поиск на нашем сайте КОМПЛЕКТ контрольно-оценочных средств для проведения текущей и промежуточной аттестации по общеобразовательной дисциплине ОУД. 10 ХИМИЯ
ППССЗ 23.02.03. «Техническое обслуживание и ремонт автомобильного транспорта»
Промежуточная аттестация в форме дифференцированного зачёта
Костомукша
Контрольно-оценочные средства по общеобразовательной учебной дисциплине «Химия»разработаны на основе Федерального компонента государственного стандарта среднего общего образования по дисциплине, примерной программы общеобразовательной учебной дисциплины «Химия» для профессиональных образовательных организаций, рекомендованной ФГАУ «ФИРО» от 21.07.2015, с учетом Примерной основной образовательной программы среднего общего образования, одобренной решением федерального учебно-методического объединения по общему образованию (протокол от 28 июня 2016 г. № 2/16-з), Федеральных государственных образовательных стандартов по профессии 23. 02.03 «Техническое обслуживание и ремонт автомобильного транспорта»
Организация - разработчик: Государственное бюджетное профессиональное образовательное учреждение Республики Карелия «Костомукшский политехнический колледж»
Разработчик Е.Г. Филимоненкова, преподаватель химии и биологии.
СОДЕРЖАНИЕ
1.Паспорт комплекта оценочных средств
Освоение содержания общеобразовательной учебной дисциплины «Химия» обеспечивает достижение студентами следующих результатов: (из примерной программы)
• личностных: - чувство гордости и уважения к истории и достижениям отечественной химической науки; химически грамотное поведение в профессиональной деятельности и в быту при обращении с химическими веществами, материалами и процессами; - готовность к продолжению образования и повышения квалификации в избранной профессиональной деятельности и объективное осознание роли химических компетенций в этом; - умение использовать достижения современной химической науки и химических технологий для повышения собственного интеллектуального развития в выбранной профессиональной деятельности; • метапредметных: - использование различных видов познавательной деятельности и основных интеллектуальных операций (постановки задачи, формулирования гипотез, анализа и синтеза, сравнения, обобщения, систематизации, выявления причинно-следственных связей, поиска аналогов, формулирования выводов) для решения поставленной задачи, применение основных методов познания (наблюдения, научного эксперимента) для изучения различных сторон химических объектов и процессов с которыми возникает необходимость сталкиваться в профессиональной сфере; использование различных источников для получения химической информации, умение оценить ее достоверность для достижения хороших результатов в профессиональной сфере; • предметных: - сформированность представлений о месте химии в современной научной картине мира; понимание роли химии в формировании кругозора и функциональной грамотности человека для решения практических задач; - владение основополагающими химическими понятиями, теориями, законами и закономерностями; уверенное пользование химической терминологией и символикой; - владение основными методами научного познания, используемыми в химии: наблюдением, описанием, измерением, экспериментом; умение обрабатывать, объяснять результаты проведенных опытов и делать выводы; готовность и способность применять методы познания при решении практических задач; - сформированность умения давать количественные оценки и производить расчеты по химическим формулам и уравнениям; - владение правилами техники безопасности при использовании химических веществ; - сформированность собственной позиции по отношению к химической информации, получаемой из разных источников. 2.Критерии оценивания: При выставлении оценки учитывается количество процентов выполненных правильно заданий: 90% -100% - оценка "5" 75% - 89 % - оценка "4" 60% - 74 % - оценка "3" 45% - 59 % - оценка "2
Комплект оценочных средств Задания для текущего контроля знаний обучающихся (темы рабочей программы) Проверка предметных результатов: − владение представлениями о современной химической науке, ее участии в решении важнейших проблем человечества; −владение химическим мышлением для определения химических аспектов природных, социально-экономических и экологических процессов и проблем; − сформированность системы комплексных социально ориентированных знаний о закономерностях развития природы. − владение умениями проведения наблюдений за отдельными химическими объектами, процессами и явлениями, их изменениями в результате природных и антропогенных воздействий; Основные понятия органической химии. Теория строения органических соединений. Название углеводорода Формула углеводорода А) этан 1) CH2 Б) метилен 2) CH4 В)гексен 3) C6H12 Г) бутан 4) C8H16 Д) бутен 5) C2H6 Е) пентан 6) C5H12 Ж) гексан 7) C4H10 З) пропилен 8) C3H6 И) метан 9) C6H14 К) октен 10) C4H8
Самостоятельная работа «Написание формул изомеров и гомологов» Цель: закрепить теоретические знания по теме, развивать навыки самостоятельной работы с текстом учебника. Задание: написать формулы всех возможных изомеров и двух гомологов для октана нонана, декана. Инструкция по выполнению работы:
Самостоятельная работа «Подготовка реферативных сообщений и презентаций. Цель: расширить теоретические знания по теме, развивать навыки самостоятельной работы с текстом, интернет ресурсами. Задание: Подготовка реферативных сообщений на темы:
Контрольная работа Зачет № 1 по теме «Теория строения органических соединений»
1.Тип гибридизации атомов углерода в молекуле СН3 -СН2 -СН2-- СН3 а) sp2 б) sp3 в) sp 2. Угол между осями углеродного атома для sp3- гибридных орбиталей равен: а) 109° 28¢ б) 120° в) 180° 3. В sp –гибридизации не участвуют орбитали второго энергетического уровня атома углерода в количестве: а) одного б) двух в) трех 4. К классу спиртов относятся органические вещества с функциональной группой: а) -С= О б) –ОН в) -С= О ê ê Н ОН 5.Соединения с незамкнутой цепью атомов углерода в молекуле называются: а) ациклическими б) карбоциклическими 6. Все спирты имеют в названии суффикс: а) –ен б) –ол в) –аль 7.Изомеры отличаются друг от друга: а) количеством атомов б) строением молекул в) свойствами 8.Вещества: СН3- СН2 -СН3 и СН3- СН2- СН- СН3 являются: ê СН3 а) гомологами б) изомерами в) ни гомологами, ни изомерами. 9.Реакциями элиминирования называются 10.Реакция, уравнение которого: СН3 -СН=СН2 + Н2 ®СН3 -СН2- СН3, относится к реакциям: а) замещения б) присоединения в) элиминирования. 11. Реакция, уравнение которой приведено в п.10, является реакцией: а) гидрирования б) галогенирования в) полимеризации.
Ключ для проверки зачета № 1 вопр. 1 б 5 б 9 - 2 а 6 в 10 б 3 б 7 б в 11 а 4 б 8 в Тема 1.2. Контрольная работа Тема: «Непредельные углеводороды» Вариант 1 1.написать формулы следующих соединений: а) 3,3-диметилбутин-1, б) 3,4-диметилпентин- в) 2,5 –диметилгексен-2, г) 5,6-диметил-4-этилгептен-2. 2.какое правило выполняется при гидрогалогенировании и гидратации алкинов? Написать уравнения реакций 2-х стадий взаимодействия бромоводорода с: а) пропином, б) бутином-1. 3.Рассчитать объем ацетилена, который получен из 640 г карбида кальция. Вариант 2 1. написать формулы следующих соединений: а) 2-бромбутадиен-1,3 б) 2-метил-4-этилпентадиен-1,3 в) 3,3-диметипентин-1 г) 2,3,4-триметилпентен-2. 2.Какая реакция называется реакцией Кучерова? Какие условия ее проведения? Написать уравнения реакций взаимодействия с водой: а) ацетилена, б) пропина 3.Рассчитать объем этилена при гидрировании, которого образовалось 90 г этана. Самостоятельная работа «Составление формул и название веществ» Цель: закрепить теоретические знания по теме, развивать навыки самостоятельной работы с текстом. Задание: 1. Назовите следующие вещества по международной номенклатуре: А) СН3 – СН2- СН – СН2- СН3 б) СН3 – СН2- С = СН2- СН3 В) СН2= СН2- СН – СН= СН2 г) СН3 - СН2- СН – СН-СН3
2. Напишите структурные формулы следующих углеводородов: А) 2 метилгексан; Б) 3 этилпентан; В) 2,2 диметилгексин-1; Г) 2 пропилпентен-1. Инструкция по выполнению работы: 1.Найти в тексте учебника или в тетради план названия веществ. Посмотреть примеры. Назвать вещества. 2.Найти в тексте учебника или в тетради план написания структурных формул. Посмотреть примеры. Написать формулы.
Самостоятельная работа «Подготовка реферативных сообщений и презентаций.» Цель: расширить теоретические знания по теме, развивать навыки самостоятельной работы с текстом, интернет ресурсами. Задание: Подготовка реферативных сообщений на темы:
ТЕМА 1.3. ТЕСТ «СПИРТЫ И ФЕНОЛЫ» .1 Определите схему уравнение реакции, в результате которой образуется этанол
А C2H6 + Br2 →; … Б C2H5OH + HBr →; … В C2H4 + H2O →; … Г C2H2 + H2O →. 2. Укажите по номенклатуре IUPAC название вещества, формула которого
Б этин; В эстер; Г этер. В вашем распоряжении есть пробирка, пробиркодержатель, нагревательный прибор, вода, бытовые и лекарственные средства. Отметьте препараты, с помощью которых можно провести качественную реакцию (минимум стадий) на многоатомный спирт А «Лизоформ»: формалина 40 частей, калийного мыла 40 частей, этилового спирта 20 частей; микроудобрение, средство защиты растений «Медный купорос»; Б «Альмагель» 5 мл суспензии, которая содержит 0,3 г гидроксида алюминия, 0,1 г гидроксида магния, 0,8 г сорбита; В Уксус 9% -ный; сода; этиловый спирт 95% -ный — 25 мл; Г «Крот»: натрий гидроксид; микроудобрение, средство защиты растений «Медный купорос»; «Глицерин»: раствор для наружного применения 85% -ный по 25 г во флаконах. Для проведения реакции взяли насыщенный одноатомный спирт массой 92 г и натрий в избытке. В результате реакции выделился газ объемом 22,4 л (н.у.). Определите молекулярную формулу спирта. Укажите число атомов водорода в его молекуле.
ОТВЕТЫ НА ЗАДАНИЯ ТЕСТА «СПИРТЫ И ФЕНОЛЫ» . В 2 Г 3 Б 4 А 5- Б 6- В В 8- Б 9- А 10-Г 11- А 12- А Б 14- Б 15- Б 16- Г 17- А 18- Г Г 2-А 3-Д 4-В 20 1-Д 2-Г 3-В 4-А 25 7 26 353 27 6 Самостоятельная работа №5 «Составление формул и название веществ» Цель: закрепить теоретические знания по теме, развивать навыки самостоятельной работы с текстом. Задание:1. Назовите следующие вещества по международной номенклатуре: А) СН3 – СН2- СН – СН2- ОН б) ОН– СН2- СН - СН2- ОН СН3СН3 В) СН2- СН2- СН – СН- СН2 г) ОН– СН2- СН – СН-СН3 ОН С2Н5 С3Н7
2. Напишите структурные формулы следующих углеводородов: А) 2 метилгексановая кислота; Б) 3 этилпентаналь; В) 2,2 диметилгексаналь; Г) 2 пропилпентановая кислота. Инструкция по выполнению работы: 1.Найти в тексте учебника или в тетради план названия веществ. Посмотреть примеры. Назвать вещества. 2.Найти в тексте учебника или в тетради план написания структурных формул. Посмотреть примеры. Написать формулы. Самостоятельная работа «Подготовка реферативных сообщений и презентаций.» Цель: расширить теоретические знания по теме, развивать навыки самостоятельной работы с текстом, интернет ресурсами. Задание: Подготовка реферативных сообщений на темы:
ТЕСТ: Углеводороды (С ответами) 1.К углеводам относятся: A) глюкоза, крахмал, сахароза B) все сладкие на вкус вещества C) сахароза, глицин, угольная кислота D) целлюлоза, гидролаза, фруктоза E) крахмал, целлюлоза, рибоза 2.В кровь человека углеводы поступают в виде: A) гликогена B) сахарозы C) глюкозы D) крахмала E) целлюлозы 3. К моносахаридам относятся: A) мальтоза, глюкоза, целлюлоза B) глюкоза, сахароза, крахмал C) фруктоза, мальтоза, целлюлоза D) глюкоза, фруктоза, рибоза E) целлюлоза, глюкоза, сахароза 4.В результате гидролиза сахарозы образуются: A) гидролаза и сахарин B) уксусная кислота и этанол C) галактоза и глицин D) глюкоза и фруктоза E) крахмал и этанол 5.В процессе фотосинтеза в растениях из углекислого газа и воды образуется: A) глюкоза B) сахароза C) крахмал D) угольная кислота E) рибоза 6.Качественная реакция на обнаружение глюкозы: A) обесцвечивание бромной воды B) реакция «серебряного зеркала» C) взаимодействие с металлическим натрием D) взаимодействие с раствором хлорида железа (II) E) взаимодействие с хлоридом бария 7.При растворении сахарозы в воде происходит: A) образование карамели B) гидролиз сахарозы с образованием глюкозы C) гидролиз сахарозы с образованием фруктозы D) образование осадка D) углеводов E) альдегидов 9.К дисахаридам относится: A) фруктоза B) глюкоза C) сахароза D) целлюлоза E) крахмал 10.К 50 г 9%-го раствора глюкозы прилили 150 г 8%-го раствора аммиачного комплекса серебра [Ag(NH3)2]OH. Какова масса выпавшего при реакции осадка (г)? A) 5,4 г B) 4 г C) 4,5 г D) 7 г E) 10 г
ТЕСТ: «Карбоновые кислоты» 1. Многообразие органических соединений обусловлено A) Окислительно-восстановительными свойствами углерода. B) Способностью образовывать различные функциональные группы. C) Строением ядра атома углерода. D) Способностью атомов углерода соединяться между собой и образовывать различные цепи. E) Способностью атома углерода образовывать донорно-акцепторные связи. 2. Функциональная группа альдегидов называется A) Гидроксильной B) Аминогруппой C) Карбонильной D) Кетоногруппой E) Карбоксильной 3. Группу атомов, определяющих характерные химические свойства данного класса веществ, называют A) Функциональной группой. B) Гомологической разностью. C) Радикалом. D) Структурным звеном. E) Полимером. 4. В уравнении реакции между аммиачным раствором оксида серебра (I) и метановой кислотой сумма коэффициентов равна A) 6 B) 3 C)5 D) 4 E) 2 5. Массовая доля углерода в масляной кислоте A) 36,5% B) 48,6% C) 46,3% D)54,5 % E) 45,5% 6. К гомологическому ряду с общей формулой CnH2n+1COOH относятся кислоты: 1. СН3 – (СН2)16 – СООН 2. СН3 – (СН2)5 – СООН 3. СН3 – (СН2)7 – СН = СН – (СН2)7 – СООН 4. СН3 – СН = СН – (СН2)7 – СООН 5. С17Н31СООН A)1, 2. B) 1,5. C) 2, 3. D) 4, 5.
E) 2,5. 7. Расположите в генетический ряд вещества
1. пропаналь 2. пропан 3. пропанол 4. 1-хлорпропан 5. пропановая кислота A) 24315 B) 45123 C) 25134 D) 32145 E) 12345 8. Название кислоты A) 2-метилмасляная B) 2-метилпропановая C) 2,4 диметилпентановая D) 2,3-диметилкапроновая E) 3-метилбутановая 9. Группа, в которой вещества имеют только s - связи A) C 3 H 8; CH 3 OH B) C2H6; HCOH C) C4H10; HCOOH D) C3H6; HCOH E)C3H4; C2H5OH 10. Масса муравьиного альдегида, если его объем составляет (при н.у.) 56м3 A) 85 кг B) 65 кг C) 75 кг D) 45 кг E) 55 кг
Тема 1. 4. Самостоятельная работа №7 «Составление формул и название веществ» Цель: закрепить теоретические знания по теме, развивать навыки самостоятельной работы с текстом. Задание: 1. Напишите структурные формулы следующих веществ: А) аминоуксусная кислота; Б) 2 метил аминомасляная; В) 2,2 диметиламинобутановая кислота; Г) 2 пропил аминопентановая кислота. Инструкция по выполнению работы: 1.Найти в тексте учебника или в тетради план написания структурных формул. Посмотреть примеры. Написать формулы.
Самостоятельная работа № 8 «Подготовка реферативных сообщений и презентаций.» Цель: расширить теоретические знания по теме, развивать навыки самостоятельной работы с текстом,
Б 8 в 14 а 20 а Б 9 в 15в 21б Б 10 б 16а 2 в В 11 б 17б 23а Б 12б 18а 24б Раздел 2 Тема 2. 1. Основные понятия и законы
Самостоятельная работа №1 «Составление химических формул по валентности. Определение относительной молекулярной массы.»
Цель: закрепить теоретические знания по теме, развивать навыки самостоятельной работы с текстом. Задание: 1. Зная валентность составить формулы следующих веществ: А) хлорид железа (2,3 валентные); Б) гидроксиды калия, бария, алюминия; В) нитраты серебра, ртути, никеля; Г) сульфаты кальция, кобальта, натрия. Инструкция по выполнению работы: 1.Найти в таблице растворимости катионы и анионы, посмотреть их валентность. Написать формулы. 2. Найдите относительные молекулярные массы веществ: кислород, озон, серная кислота, сернистая кислота, гидроксид меди, фосфат кальция. Инструкция по выполнению работы: 1.Найти в учебнике или тетради формулу для расчета. Написать формулы. Рассчитайте относительные молекулярные массы.
Тема 2. 2. Периодический закон и В - 1. 1 - уровень. 1. Главная подгруппа восьмой группы периодической сис - темы Д. И. Менделеева называется: а) галогены; б) щелочные металлы; в) благородные газы. 2. Порядковый номер химического элемента равен числу: а) нейтронов; б) протонов; в) электронов. 3. У какого из предложенных элементов слабее выражены металлические свойства: Mq; Na; Al; Si. 2 - уровень. 1. Определите количество элементарных частиц в атоме хлора. 2. Допишите уравнение ядерной реакции С + n → Be +? 3 - уровень. 1.Определите состав ядра изотопа фосфора с массовым числом 31. 4 - уровень. Решите задачу. Медь имеет два нуклида с массой 63 и 65. Вычислите массовую долю каждого из нуклидов в природной смеси меди, если её атомная масса составляет 63,546. В - 2. 1 - уровень1. Первая ядерная реакция была осуществлена: а) Резерфордом; б) Бором; в) Беккерелем. 2. Нуклоны - общее название: а) нейтронов и электронов; б) электронов и протонов; в) протонов и нейтронов. 3. У какого из элементов металлические свойства выра - жены сильнее: Вi; P; N; Sb. 2 - уровень 1. Определите количество элементарных частиц в атоме цинка. 2. Допишите уравнение ядерной реакции U → Np? 3 - уровень. 1. Определите состав ядра изотопа калия с массовым числом 41. 4 - уровень. Решите задачу. Один из предсказанных Д.И.Менделеевым элементов, ко- торый принадлежит четвёртому периоду, образует оксид, в кор ом массовая доля кислорода составляет 34,87%.
Самостоятельная работа
«Написание схем строения атомов химических элементов, электронных и графических формул» Цель: закрепить теоретические знания по теме, развивать навыки самостоятельной работы с текстом. Задание: 1. Зная положение элемента в периодической системе составьте схемы строения, электронные и графические формулы: А) углерод, кремний, фосфор, хлор. Б) титан, бром. В) медь, мышьяк. Г) йод, серебро. Инструкция по выполнению работы: 1.Найти в таблице Д.И.Менделеева каждый элемент, посмотреть в тексте учебника примеры написания формул. Написать формулы.
Самостоятельная работа «Подготовка реферативных сообщений и презентаций.» Цель: расширить теоретические знания по теме, развивать навыки самостоятельной работы с текстом, интернет ресурсами. Задание: Подготовка реферативных сообщений на темы: · Жизнь и деятельность Д.И. Менделеева. · «Периодическому закону будущее не грозит разрушением...».
Тест. Тема 2.3 Тема 2. 4 Строение вещества Контрольная работа по теме «Теория электролитической диссоциации.» Задание № 1 Даны уравнения. Вариант 1 Вариант2 + 2+ _ 2- 1)Fe O + 2 H = H2 O + Fe$ 1) H 2 Si O 3 + 2OH = 2H 2 O + SiO 3 + 2+ + _ 2) H + CU (OH) 2 = Cu + 2H 2 O 2) H + OH = H 2 O 2- + 2+ _ 3) Si O 3 + 2 H = H 2 Si O 3 3) Cu + 2OH = Cu (OH) 2 + 2- _ 2- 4) 2 H + CO 3 = CO 2 + H 2 O 4) SO 2 + 2OH = SO 3 + H 2 O 0 + 2+ 0 + _ 5) Zn + 2H = Zn + H 2 5) NH 4 + OH = NH 3 + H 2 O 1 – й уровень. а) Свойства какого класса электролитов описаны этими ионными уравнениями? б) Для любого из приведённых ионных уравнений (по выбору) запишите два молекулярных уравнения. 2 – уровень. В заданиях 1, 3, 5 не будут даны продукты (т.е. правые части уравнений): А) аналогично 1-му уровню; Б) закончите ионные уравнения; В) для одного из законченных и одного из незаконченных в задании ионных запишите по одному молекулярному уравнению.
3 – уровень. В задании все уравнения будут незавершёнными, т.е. без правых частей: А) аналогично 1- му уровню; Б) допишите ионные уранения; В) конкретизируйте их молекулярными уравнениями. ЗАДАНИЕ 2.
Даны переходы. Вариант 1. Ca Ca O Ca (OH) 2 Ca (NO 3) 2 Ca C O 3 Вариант 2. S S O 2 H 2 SO 3 N a 2 SO 3 S O 2 А) Б) Аналогично 1- му уровню В) 3 –й уровень. Вариант 1 Si... N a 2 Si O 3... Si O 2 Si Вариант 2. Сu... Сu SO 4 Сu (OH) 2... Сu А) Аналогично 1 –му уровню; Б) заполните пропуски звеньев в этой цепочке; В) запишите молекулярные уравнения переходов; Г) там, где это имеет место, рассмотрите уравнения в свете ОВР и в свете ТЭД. ЗАДАНИЕ 3 (дополнительное) Предложите: А) по одному (1-й уровень); Б) по два (2 –й уровень); В) по три (3 –й уровень); Ионных и молекулярных уравнений качественных реакций для Варианта 1 Вариант 2 Сульфата железа (I I I) Хлорида бария
Самостоятельная работа «Определение растворимости веществ по таблице» Цель: закрепить теоретические знания по теме, развивать навыки самостоятельной работы с текстом. Задание: 1. Оиределить растворимость следующих веществ: А) гидроксиды железа (2,3 валентные); Б) гидроксиды калия, бария, алюминия; В) карбонаты кальция, аммония, никеля; Г) сульфаты кальция, кобальта, бария. Инструкция по выполнению работы: 1.Найти в таблице растворимости катионы и анионы, составьте из них формулы. Написать формулы и указать растворимость.
Самостоятельная работа «Подготовка реферативных сообщений и презентаций.» Цель: расширить теоретические знания по теме, развивать навыки самостоятельной работы с текстом, интернет ресурсами. Задание: Подготовка реферативных сообщений на темы: · Растворы вокруг нас. · Вода как реагент и как среда для химического процесса. · Типы растворов. · Современные методы обеззараживания воды. · Вклад отечественных ученых в развитие теории электролитической диссоциации. · Устранение жесткости воды на промышленных предприятиях.
Классификация |
Контрольная работа
Вариант 2
1. К основаниям относится каждое из 2-х веществ
а) H2O, Na2O б) KOH, NaOH в) HPO3, HNO3 г) KOH, Na Cl
2. Оксиду меди (II) соответствует формула:
а) Cu2O б) Cu (OH)2 в) Cu OH г) CuO
3. Формула сульфита натрия:
а) Na2SO4 б) Na2S в) Na2SO3 г) Na2SiO3
4. Среди перечисленных веществ кислой солью является
а) гидроксид бария б) гидроксокарбонат калия
в) гидрокарбонат меди г) гидрид кальция;
5. Какой из элементов может образовать амфотерный оксид?
а) натрий б) сера в) фосфор г) алюминий
6. К основным оксидам относится
а) MgO б) SO2 в) B2O3 г) Al2 О3
7. Оксид натрия реагирует с каждым из двух веществ:
а) водой и оксидом кальция
б) кислородом и водородом
в) сульфатом калия и гидроксидом натрия
г) фосфорной кислотой и оксидом серы (IV)
8. Установите соответствие между формулой исходных веществ и продуктами реакций
| Формулы веществ | Продукты взаимодействия |
| а) Fe + HCl → | 1) FeCl2 |
| б) Fe(OH)2 + CO2 → | 2) FeCl2 + H2 |
| в) Fe(OH)2 + HCl → | 3) FeCl2 + H2O |
| 4) FeCO3 + H2 | |
| 5) FeCO3 + H2O |
9. Осуществите цепочку следующих превращений:
а) Mg → MgO→MgCl2→Mg(OH)2 → MgO
б) C → CO2 → Na2CO3 → Na2SO4 → BaSO4
10. Какая масса сульфата бария образуется при взаимодействии 30,6 г оксида бария с достаточным количеством серной кислоты?
+
Таблица ответов.
| 1 вариант | 2 вариант |
| 1 в | 1б |
| 2 б | 2 г |
| 3 а | 3 в |
| 4 б | 4 в |
| 5 б | 5 г |
| 6 в | 6 а |
| 7 а | 7 г |
| 8 - 253 | 8 - 253 |
| 10- 87 г | 10 – 46,6 г |
Тема 2. 6.
Химические реакции
Контрольная работа
Задание 2.
1-й уровень. Сколько граммов осадка образуется при взаимодействии 160 15% раствра Сu SO 4 с необходимым количеством Na О Н?
Дополнительный вопрос. Каково это количество вещества щёлочи?
2-й уровень. Какой объём водорода(н.у.) образуется при взаимодействии 650 мг цинка, содержащего 20 % примесей, с необходимым количеством соляной кислоты. Каково это количество вещества кислоты?
Дополнительный вопрос. Сколько молекул водорода при этом получится?
3-й уровень. Какой объём углекислого газа (н.у.) образуется при взаимодействии 250 кг известняка, содержащего 20 % примесей, с необходимым количеством азотной кислоты. Каково это количество вещества кислоты?
Дополнительный вопрос. Сколько ионов каждого вида образуется в результате реакции.
Даны схемы реакций:
1) гидроксид железа (III) оксид желез(III) + вода;
Fe (OH) 3 Fe 2 O 3 + H 2 O
2) нитрат бария + сульфат железа (III) сульфат бария + нитрат железа(III);
3 Ba NO 3) 2 + Fe 2 (SO 4) 3 3 Ba SO 4 + 2Fe (NO 3) 3
2) серная кислота + алюминий сульфат алюминия + водород;
3H 2 SO 4 + 2Al Al 2 (SO 4)3 + 3 H 2
4) оксид фосфора (V) + вода фосфорная кислота.
Р 2 О 5 + 3Н 2 О = 2 Н 3 Р О 4
Задание 3.
1 –й уровень. Укажите типы реакций, запишите одно из уравнений по выбору) для реакций:
А) соединения или разложения; б) обмена или замещения.
1. А - или реакции соединения, или реакции разложения (по выбору),
Д) 3H 2 + N 2 = 2 NH 3 -- соединение; E) H 2 O 2 = H 2 O + O 2 – разложение
1б) обмена или замещения:
Са + 2 Н 2 О + Са (О Н)2 Н 2 – замещения
Са 3 (Р О 4) 2 + 6K NO 3 = 2K 3 Р О 4 + 3Са (NO 3)2 - обмена
2- й уровень. Укажите типы реакций, запишите одно из уравнений:
1. или реакции соединения, или реакции разложения (по выбору),
В) 2KNO3 = 2K NO 3 + O 2 -- разложение; Г) P 2 O 5 + 3 H 2 O = 2 H 3 P O 4 -- соединение;
Самостоятельная работа «Обратимость химических реакций»
Цель: закрепить теоретические знания по теме, развивать навыки самостоятельной работы с текстом.
Задание: Прочитать в учебнике параграф, кратко законспектировать. Выполнить задания в конце параграфа
.
Самостоятельная работа «Составление окислительно- восстановительных реакции.»
Цель: закрепить теоретические знания по теме, развивать навыки самостоятельной работы с текстом.
Задание: Прочитать в учебнике параграф, кратко законспектировать. Выполнить задания в конце параграфа.
Вариант №1
| При выполнении заданий А1-А10 из предложенных вариантов ответов выберите тот, который вы считаете правильным. 2 балла за каждое верно выполненное задание. |
А1. Характеристика реакции, уравнение которой 4Fe + 6H2O + 3O2 →4Fe(OH)3:
1) Соединения, ОВР 2) Замещения ОВР 3) Обмена не ОВР 4) Разложения ОВР
А2. Какая масса угля вступает в реакцию, термохимическое уравнение которой С+О2 = СО2 + 402 кДж, если при этом выделилось 1608 кДж теплоты?
1) 4,8 г 2) 48 г 3) 120 г 4) 240 г
Вариант №2
| При выполнении заданий А1-А10 из предложенных вариантов ответов выберите тот, который вы считаете правильным. 2 балла за каждое верно выполненное задание. |
А1. Характеристика реакции, уравнение которой 4KClO3 → 2KCl + 3O2:
1) Соединения, ОВР 2) Замещения ОВР 3) Обмена не ОВР 4) Разложения ОВР
А2. Какое количество теплоты выделится при взаимодействии 5,6 л водорода и избытком хлора. Термохимическое уравнение Н2+Сl2 = 2HCl + 92,3 кДж.
1) 2,3 кДж 2) 23 кДж 3) 46 кДж 4) 230 кДж
Вариант №3
| При выполнении заданий А1-А10 из предложенных вариантов ответов выберите тот, который вы считаете правильным. 2 балла за каждое верно выполненное задание. |
А1. Характеристика реакции, уравнение которой N2 + 3H2→ 2NH3:
1) Соединения, ОВР 2) Замещения ОВР 3) Обмена не ОВР 4) Разложения ОВР
А2. Какое количество теплоты необходимо для синтеза 67,2 л оксида азота (II). Термохимическое уравнение N2+O2 = 2NO – 90,4 кДж.
1) 45,2 кДж 2) 135,6 кДж 3) 180,8 кДж 4) 226 кДж
Ответы к Варианту №1
| А1 | А2 | А3 | А4 | А5 | А6 | А7 | А8 | А9 | А10 |
| 1 | 2 | 2 | 1 | 3 | 3 | 3 | 3 | 1 | 2 |
| В1 | В2 | В3 | ||||||||||||||||||||||||
|
|
|
С1.
8KI + 5H2SO4 →
|
||
|
Последнее изменение этой страницы: 2021-05-11; просмотров: 194; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.220 (0.011 с.) |

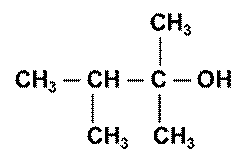 А 1,1,2-триметилпропан-1-ол; …. Б 1,1-диметил-2-метилпропан-1-ол;
А 1,1,2-триметилпропан-1-ол; …. Б 1,1-диметил-2-метилпропан-1-ол;


