Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Роль витамина К в свертывании крови.
Факторы свертывания крови (II, VII, IX, X) содержат в своем составе остатки γ-карбоксиглутаминовой кислоты, которые, посредством ионов Са++, обеспечивают связь этих ферментов с фосфолипидами клеточных мембран. В отсутствии ионов Са++ кровь не свертывается. γ-карбоксилирование глутаминовой кислоты катализируется карбоксилазой, коферментом которой является витамин К. В связи с этим при недостатке витамина К нарушается γ-карбоксилирование выше названных факторов свертывания, что сопровождается кровоточивостью, подкожными и внутренними кровоизлияниями. Биохимия межклеточного матрикса. Организация межклеточного матрикса. Общие сведения о структуре коллагеновых белков. Фибриллообразующие коллагены. Коллагены, ассоциированные с фибриллами. Нефибриллярные (сетевидные) типы коллагена. Коллагены, образующие микрофибриллы. Межклеточный матрикс — комплекс органических и неорганических компонентов, заполняющих пространство между клетками. Для разных тканей характерен свой межклеточный матрикс. Эпителиальные клетки преимущественно объединяются с помощью гликопротеинов, кальций-связывающих белков. Особая структура межклеточного матрикса присуща тканям мезенхимного происхождения, которые выполняют механическую, защитную и трофическую функции. Они подразделяются на: · ● собственно соединительную ткань — рыхлую неоформленную, плотную оформленную и неоформленную; · ● ткани со специальными свойствами — жировую, пигментную, ретикулярную; · ● скелетные ткани — костную и хрящевую. Эти виды соединительной ткани широко представлены во всём организме, и в частности, в области головы и шеи. Для соединительной ткани характерно наличие большого количества межклеточного вещества (внеклеточный матрикс), состоящего из коллагеновых белков, протеогликанов и гликопротеинов, а также небольшого числа клеток, расположенных друг от друга на значительном расстоянии. В образовании межклеточного вещества участвуют фибробласты, хондробласты, остеобласты, одонтобласты, цементобласты и другие бластные клетки. Особенностью минерализованных тканей является присутствие в межклеточном веществе неорганических ионов, образующих соли и кристаллы.
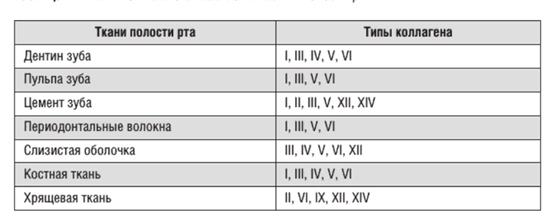
Межклеточный матрикс содержит молекулы, способные путём самосборки образовывать комплексы. Благодаря определённому расположению центров связывания на молекулах и специфичности их взаимодействий формируется высокоупорядоченная трёхмерная структура межклеточного матрикса, определяющая её функциональные свойства. Специализированной формой внеклеточного матрикса нормальной ткани является базальная мембрана, образующая дискретную структуру, которая отделяет один клеточный слой от другого. Она отвечает не только за разграничение различных структур и поддержание архитектоники тканей, но и влияет на их дифференцировку, миграцию и фенотипирование клеток. Базальная мембрана служит барьером для макромолекул. Основными компонентами внеклеточного матрикса являются различные виды коллагена и неколлагеновые белки. Основу межклеточного матрикса составляет семейство коллагеновых белков, относящихся к гликопротеинам и содержащих в большом количестве остатки глицина, пролина и гидроксипролина. Коллагены представлены 20 белками, из которых одна часть является собственно коллагенами, а другая содержат только коллагеноподобные домены. Все типы коллагенов в зависимости от структуры делят на несколько групп: фибриллообразующие, ассоциированные с фибриллами коллагена, сетевидные, микрофибриллы, заякоренные фибриллы и др. Для обозначения каждого типа коллагена используют определённую формулу, в которой a-цепи записывают арабскими цифрами, а тип коллагена — римскими. Значительная масса коллагенов, присутствующих в тканях полости рта, относится к фибриллообразующим. Локализация основных типов коллагеновых белков в тканях полости рта представлена.
Фибриллообразующие коллагены Все фибриллобразующие коллагены отличаются по аминокислотному составу и содержанию углеводов. Молекулы коллагенов I, II, III, V, XI типов имеют форму фибрилл и построены из структурных единиц, называемых тропоколлагенами. Молекулы тропоколлагена (Мr 300 кДа) имеют толщину 1,5 нм и длину 300 нм. Они образованы тремя полипептидными цепями, обозначаемые как a-цепи. Каждая из них содержит около 1000 аминокислотных остатков и представляет собой плотную левозакрученную спираль, заключающую в себе три аминокислотных остатка на виток. Одна треть аминокислотных остатков в коллагене представлена глицином (30%), пятая часть — пролином в сумме с 3- и 4- гидроксипролином (21%), поэтому первичную структуру коллагена можно представить в виде схемы гли — х — у-, где х — чаще всего пролин или гидроксипролин, а у — другие аминокислоты. Всего в a-цепи встречается около 330 таких повторов.
Глицин повторяющейся последовательности гли — х — у- необходим для формирования фибриллярной структуры, так как радикал любой другой аминокислоты не помещается между тремя пептидными цепями в центре тройной спирали. Пролин и гидроксипролин ограничивает вращение полипептидной цепи. Радикалы аминокислот, располагающиеся в положении — х — и –у-, находятся на поверхности тройной спирали. Распределение кластеров радикалов по длине коллагеновой молекулы обеспечивает самосборку многомолекулярных коллагеновых структур. Три a-цепи образуют структуру, слегка закрученную в спираль. Формируя фибриллы, молекулы тропоколлагена (тримеры) располагаются ступенчато, смещаясь относительно друг друга на одну четверть длины, что придает фибриллам характерную исчерченность. Депонируясь в тканях, сформированные фибриллы коллагена стабилизируются посредством образования ковалентных поперечных связей. Коллаген I типа [a1(I)]2 a2 содержит 33% глицина, 13% пролина, 1% гидроксилизина и малое количество углеводов. Определяется в составе костей, дентина, пульпы зуба, цемента, периодонтальных волокон. Этот тип коллагеновых волокон участвует в процессах минерализации. Коллаген II типа [a1(II)]3 присутствует в хрящах и образуется в нехрящевых тканях на ранних стадиях развития. Данный тип коллагена содержит небольшое количество 5-гидроксилизина (менее 1%) и отличается высоким содержанием углеводов (более 10%). Коллаген III типа [a1(III)]3 присутствует в стенках кровеносных сосудов. Отличительной особенностью этого коллагена является наличие большого количества гидроксипролина. В составе a-цепей присутствует цистеин, а сама молекула коллагена слабо гликозилирована. Коллаген V типа [a1(V)a2(V)a3(V)] представляет собой гибридную молекулу, состоящую из различных цепей: a1(V), a2(V) и a3(V). Фибриллярные коллагены могут иметь в своём составе 2 и более различных типов коллагенов. Так, в некоторых тканях присутствуют гибридные молекулы, содержащие цепи коллагена V и XI типов. Коллагены, ассоциированные с фибриллами В организации межклеточного матрикса слизистой оболочки, хряща и цемента корня зуба участвуют коллагены IX, XII, XIV типов. Коллагеновые белки этого класса не способны формировать фибриллы, но, связываясь с фибриллярными коллагенами, они ограничивают длину, толщину и ориентацию фибрилл коллагенов I и II типов. Особенностью коллагенов, ассоциированных с фибриллами, является наличие в их структуре как глобулярных, так и фибриллярных доменов. a-Цепи коллагена IX типа [a1(IX)a2(IX)a3(IX)] состоят из 3 фибриллярных и 4 глобулярных доменов. Они объединены поперечными ковалентными связями с фибриллами коллагена II типа. Молекула коллагена IX типа также содержит боковую гликозаминогликановую цепь и большое количество положительно заряженных групп, поэтому к ней могут присоединяться отрицательно заряженные молекулы гиалуроновой кислоты и хондроитинсульфата. В аналогичные взаимодействия с фибриллярными коллагенами I типа вступают коллагены XII типа. Этот тип локализуется в хряще, цементе, а также в слизистой оболочке полости рта в местах соединения эпителия с субэпителиальными слоями. Коллаген IX типа является трансмембранным белком, с помощью которого lamina densa (тёмная пластинка базальной мембраны, располагающаяся на границе с сосочковым слоем дермы) прикрепляется к коллагеновым фибриллам сосочкового слоя дермы.
Нефибриллярные (сетевидные) типы коллагена К группе нефибриллярных коллагенов относят коллагеновые белки IV, VIII и X типов, которые отличаются по длине и размеру и способны формировать сетевидные структуры. Наиболее распространен, в том числе и в тканях полости рта, коллаген IV типа, являющийся основным структурным белком базальных мембран. Он содержит 1 a1(IV) и 2 a2(IV) цепи. Пептидные цепи коллагена IV типа после секреции не подвергаются протеолитической модификации, и поэтому сохраняют структуру N- и С-концевых глобулярных доменов (NC1, 7S и NC2). В отличие от фибриллярных коллагенов, a-цепи молекулы коллагена IV типа содержат «неколлагеновые» аминокислотные области не только в N- и С-концевых отделах, но и по всей длине молекулы. Концевые домены NC1, 7S коллагеновых мономеров в процессе самоагрегации взаимодействуют между собой и образуют связи «конец в конец», что приводит к формированию димеров и тримеров. Суперспирализацию обеспечивают боковые взаимодействия и связи «конец в конец». В результате формируются трёхмерные структуры, подобные сетке с гексагональными ячейками размерами 170 нм. Коллаген X типа состоит из 3 идентичных цепей с молекурярной массой 59 кДа. Коллагены, образующие микрофибриллы К этой группе относят коллаген VI типа. Являясь короткоцепочечным белком, он образует микрофибриллы, располагающиеся между фибриллами интерстициальных коллагенов. Для него характерно присутствие в a-цепях больших глобулярных доменов в N- и С-концевых областях и короткого трёхспирального домена между ними. В процессе синтеза внутри клетки 2 молекулы этого коллагена соединяются антипараллельно с образованием димера, а из димеров образуются тетрамеры, которые секретируются из клетки. Вне клетки тетрамеры связываются «конец в конец» с формированием микрофибрилл. Молекулы этого коллагена как и коллаген IV типа содержат многочисленные последовательности арг-гли-асп (RGD), которые обеспечивают клеточную адгезию путём присоединения к мембранным адгезивным белкам — интегринам a1b1 и a2b1. Кроме того, коллаген VI типа способен связываться с фибриллами интерстициальных коллагенов, протеогликанами и гликозаминогликанами.
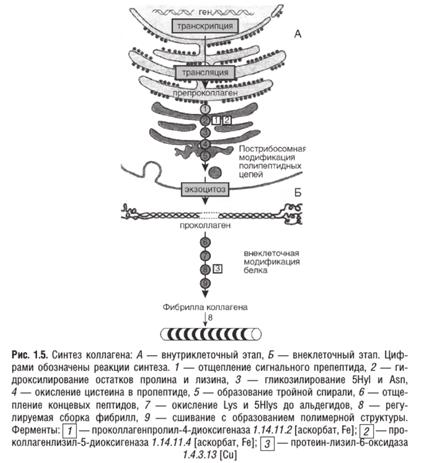
Синтез коллагена. Этапы внутриклеточного синтеза: транскрипция, трансляция, посттрансляционная модификация, роль аскорбиновой кислоты, формирование коллагеновых фибрилл вне клетки. Нарушения синтеза коллагеновых белков у человека. Коллаген синтезируют и поставляют в межклеточный матрикс почти все бластные клетки. Синтез и созревание коллагена является сложным многоэтапным процессом, который начинается в клетке и заканчивается в межклеточном матриксе. Нарушения синтеза коллагена, обусловленные мутацией в генах, а также в процессе трансляции и посттрансляционной модификации, сопровождаются появлением дефектных коллагенов. Поскольку около 50% всех коллагеновых белков содержатся в тканях скелета, 40% в дерме и 10% в строме внутренних органов, нарушения синтеза коллагена сопровождаются как костно-суставной системы, так и внутренних органов. Синтез коллагена происходит в два этапа. На внутриклеточном этапе происходит трансляция и посттрансляционная модификация полипептидных цепей, и на внеклеточном — модификации белка, завершающаяся образованием коллагеновых волокон.
Внутриклеточный этап синтеза коллагена. Пептидные a-цепи коллагена синтезируются на полирибосомах, связанных с мембранами эндоплазматической сети. Синтезированные пептидные цепи в цистернах подвергаются посттрансляционной модификации, которая включает: · ● удаление сигнального пептида проколлагеновой цепи при участии специфической протеиназы; · ● гидроксилирование остатков пролина и лизина, которое начинается в период трансляции полипептидной цепи вплоть до её отделения от рибосом. В реакциях гидроксилирования один атом кислорода присоединяется к четвёртому атому углерода в остатке пролина, а второй атом кислорода включается в янтарную кислоту, которая образуется при декарбоксилировании 2-оксоглутарата. Гидроксипролин необходим для стабилизации этой тройной спирали коллагена, поскольку его гидроксильные группы участвуют в образовании водородных связей между a-цепями. Внеклеточный этап — модификация молекул проколлагена. В межклеточном пространстве при участии протеолитических ферментов от молекулы проколлагена отщепляются N- и С-концевые пептиды и освобождается тройная спираль коллагена (тропоколлагена). Далее происходит процесс самосборки коллагеновых фибрилл, фиксированных межмолекулярными ковалентными связями (сшивками). В формировании этих связей участвуют остатки лизина и 5-гидроксилизина и их альдегидные производные, которые образуются вследствие окислительного дезаминирования. Окислительное дезаминирование лизина и 5-гидроксилизина происходит с участием лизилоксидазы. Особенностью этого фермента является присутствие Cu2+ в активном центре. Молекулы лизилоксидазы синтезируются в клетке в виде проферментов и после связывания с ионами Cu2+ упаковываются в везикулы, которые покидают клетку. На клеточной поверхности молекула пролизилоксидазы подвергается ограниченному протеолизу, и в сформировавшемся активном центре при участии ионов Cu2+ происходит окисление остатка тирозина до тирозинхинона. Образовавшаяся в активном центре хиноидная структура связывает остатки лизина в молекуле проколлагена с образованием фермент-субстратного комплекса. Дальнейшее дезаминирование лизина происходит в соответствии с реакциями.
На следующем этапе аллизин и 5-гидроксиаллизин конденсируются вместе с лизиловыми и гидроксилизиловыми остатками; формируются внутри- и межмолекулярные поперечные связи. В реакции конденсации аллизина с остатком лизина другой цепи образуется основание Шиффа. В случае альдольной конденсации двух остатков аллизина возникают альдольные межмолекулярные связи. Нарушение синтеза коллагеновых белков у человека Любые нарушения в синтезе коллагеновых белков клинически проявляются, в первую очередь, изменением со стороны зубочелюстной системы в виде кровоточивости дёсен, подвижности и выпадения зубов, множественного кариеса. Причины, приводящие к нарушению синтеза коллагеновых белков, различны - недостаток в организме аскорбиновой кислоты, ионов Cu2+, генетические дефекты и аутоиммунные состояния. Гидроксилирование лизина и пролина очень важный этап для последующего образования ковалентных связей между молекулами коллагена и сборкой коллагеновых фибрилл, зависящий от количества аскорбиновой кислоты. При цинге - заболевании, возникающем вследствие недостатка аскорбиновой кислоты, страдает гидроксилирование остатков пролина и лизина в структуре проколлагена. В результате образуются хрупкие и ломкие сосуды. Нарушение синтеза коллагена в пульпе и дентине приводит к развитию множественно- го кариеса, страдают периодонтальные связки. Подобные явления встречаются при врождённом дефиците лизилгидроксилазы (синдром Элерса-Данло-Русакова, тип IV). Высокая растворимость молекул коллагена проявляется при врождённом дефекте лизилоксидазы (синдром Элерса-Данло, тип V) или нарушении обмена меди (болезнь Менкеса), что связано с нарушением образования поперечных сшивок между микрофибриллами коллагена. Это приводит к ухудшению механических свойств связок периодонта, состояния тканей пародонта, вялости кожных покровов и возникновении дефектов в развитии скелета у людей, страдающих этим заболеванием. Нарушение структуры базальной мембраны возникает при появлении антител к белкам, формирующим архитектонику базальных мембран (синдром Гудпасчера), или мутации гена, кодирующего α-цепи коллагена IV типа (синдром Альпорта). При этих формах патологии наряду с поражением почек и других органов наблюдаются некариозные поражения твёрдых тканей зуба (гипоплазия эмали, уменьшение объёма и нарушение структуры дентина) и дистрофические изменения мягких тканей полости рта. Для исследования обмена коллагена в моче и плазме крови определяют концентрацию гидроксипролина, пролина, количество продуктов деградации коллагена I типа - N- и С-телопептиды. Характерным показателем распада коллагена является увеличение количества гидроксипролина в плазме крови и моче, а также повышение количества N- и С-телопептидов в плазме крови и содержания кальция, определяемого в моче утром до приёма пищи. О нарушении созревания коллагена свидетельствует рост количества пролина в плазме крови.
|
|||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 116; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.147.252 (0.024 с.) |