Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Гемостаз. Общая характеристика отдельных этапов. Классификация и номенклатура факторов свертывания крови. Каскадный механизм активации ферментов, участвующих в процессе гемостаза.
Гемостаз – сложная биологическая система приспособительных реакций, обеспечивающая сохранение жидкого состояния крови в сосудистом русле и остановку кровотечений из поврежденных сосудов путем тромбирования. Система гемостаза включает следующие компоненты: 1) cосудистую стенку (эндотелий); 2) форменные элементы крови (тромбоциты, лейкоциты, эритроциты); 3) плазменные ферментные системы (систему свертывания крови, систему фибринолиза, клекреин-кининовую систему); 4) механизмы регуляции. Функции системы гемостаза. 1. Поддержание крови в сосудистом русле в жидком состоянии. 2. Остановка кровотечения. 3. Опосредование межбелковых и межклеточных взаимодействий. 4. Опсоническая – очистка кровяного русла от продуктов фагоцитоза небактериальной природы. 5. Репаративная – заживление повреждений и восстановления целостности и жизнеспособности кровеносных сосудов и тканей. Факторы, поддерживающие жидкое состояние крови: 1) тромборезистентность эндотелия стенки сосуда; 2) неактивное состояние плазменных факторов свертывания крови; 3) присутствие в крови естественных антикоагулянтов; 4) наличие системы фибринолиза; 5) непрерывный циркулирующий поток крови. Этапы. По современным представлениям, в остановке кровотечения задействовано два механизма: 1) первичный гемостаз (сосудисто-тромбоцитарный), в котором принимают участие стенки сосудов, тромбоциты и отчасти эритроциты; 2) вторичный гемостаз, когда в процесс свертывания крови включаются белки плазмы крови (плазменные факторы свертывания крови). Следует отметить, что деление гемостаза на клеточные и плазменные является условным, так как в организме эти два звена свертывающей системы крови тесно связаны. Итак, при повреждении стенки кровеносного сосуда события следуют одно за другим таким образом:
При повреждении кровеносного сосуда кровотечение может продолжаться различное время. Если сосуд небольшой, то кровотечение быстро прекращается, происходит гемостаз. Выделяют 4 фазы гемостаза.
Первая фаза – сокращение поврежденного сосуда. Вторая фаза – образование в месте повреждения рыхлой тромбоцитарной пробки, или белого тромба. Имеющийся в участке повреждения сосуда коллаген служит связующим центром для тромбоцитов. При агрегации тромбоцитов освобождаются вазоактивные амины, например серотонин и адреналин, а также метаболиты простагландинов, например тромбоксан, которые стимулируют сужение сосудов. Третья фаза – формирование красного тромба (кровяной сгусток). Четвертая фаза – частичное или полное растворение сгустка. Различают три типа тромбов, или сгустков. Белый тромб образуется из тромбоцитов и фибрина; в нем относительно мало эритроцитов. Формируется он в местах повреждения сосуда в условиях высокой скорости кровотока (в артериях). Второй вид тромбов – диссеминированные отложения фибрина в очень мелких сосудах (в капиллярах). Третий вид тромбов – красный тромб. Он состоит из эритроцитов и фибрина. Морфология красного тромба сходна с морфологией сгустков, образующихся в пробирке. Красные тромбы формируются in vivo в областях замедленного кровотока при отсутствии патологических изменений в стенке сосуда или на измененной стенке сосуда вслед за инициирующей тромбоцитарной пробкой. Установлено, что в процессе свертывания крови участвуют компоненты плазмы, тромбоцитов и ткани, которые называются факторами свертывания крови. Факторы свертывания, связанные с тромбоцитами, принято обозначать арабскими цифрами (1, 2, 3 и т.д.), а факторы свертывания, находящиеся в плазме крови,– римскими цифрами (I, II, III и т.д.).
Факторы плазмы крови. Фактор I (фибриноген) – важнейший компонент свертывающей системы крови, так как биологической сущностью процесса свертывания крови является образование фибрина из фибриногена. Фибриноген состоит из 3 пар неидентичных полипептидных цепей, которые связаны между собой дисульфидными связями. Каждая цепь имеет олигосахаридную группу. Соединение между белковой частью и углеводными компонентами осуществляется посредством связи остатка аспарагина с N-ацетилглюкозамином. Общая длина молекулы фибриногена 46 нм, мол. масса 330000–340000. Синтезируется данный белок в печени, концентрация его в плазме крови человека составляет 8,2–12,9 мкмоль/л. Фактор II (протромбин) является одним из основных белков плазмы крови, определяющих свертывание крови. При гидролитическом расщеплении протромбина образуется активный фермент свертывания крови – тромбин. Концентрация протромбина в плазме крови 1,4–2,1 мкмоль/л. Он является гликопротеином, который содержит 11–14% углеводов, включая гексозы, гексозамины и нейраминовую кислоту. По электрофоретической подвижности протромбин относится к α2 -глобулинам, имеет мол. массу 68000–70000. Размеры большой и малой осей его молекулы соответственно 11,9 и 3,4 нм. Изоэлектрическая точка очищенного протромбина лежит в пределах рН от 4,2 до 4,4. Синтезируется данный белок в печени, в его синтезе принимает участие витамин К. Одна из специфических особенностей молекулы протромбина – способность связывать 10–12 ионов Са2+, при этом наступают конформационные изменения молекулы белка. Превращение протромбина в тромбин связано с резким изменением молекулярной массы белка (с 70000 до 35000). Есть основания считать, что тромбин является большим фрагментом молекулы протромбина. Фактор III (тканевый фактор, или тканевый тромбопластин) образуется при повреждении тканей. Это комплексное соединение липопротеиновой природы, отличается очень высокой мол. массой – до 167000000. Фактор IV (ионы Са2+). Известно, что удаление из крови ионов Са2+ (осаждение оксалатом или фторидом натрия), а также перевод ионов Са2+ в неионизированное состояние (с помощью цитрата натрия) предупреждает свертывание крови. Следует также помнить, что нормальная скорость свертывания крови обеспечивается лишь оптимальными концентрациями ионов Са2+. Для свертывания крови человека, декальцинированной с помощью ионообменников, оптимальная концентрация ионов Са2+ определена в 1,0–1,2 ммоль/л. Концентрация ионов Са2+ выше и ниже оптимальной обусловливает замедление процесса свертывания. Ионы Са2+ играют важную роль почти на всех фазах (стадиях) свертывания крови: они необходимы для образования активного фактора X и активного тромбопластина тканей, принимают участие в активации проконвертина, образовании тромбина, лабилизации мембран тромбоцитов и в других процессах. Фактор V (проакцелерин) относится к глобулиновой фракции плазмы крови. Он является предшественником акцелерина (активного фактора). Фактор V синтезируется в печени, поэтому при поражении этого органа может возникнуть недостаточность проакцелерина. Кроме того, существует врожденная недостаточность в крови фактора V, которая носит название парагемофилии и представляет собой одну из разновидностей геморрагических диатезов.
Фактор VII (антифибринолизин, проконвертин) – предшественник конвертина. Механизм образования активного конвертина из проконвертина изучен мало. Биологическая роль фактора VII сводится прежде всего к участию во внешнем пути свертывания крови. Синтезируется фактор VII в печени при участии витамина К. Снижение концентрации проконвертина в крови наблюдается на более ранних стадиях заболевания печени, чем снижение уровня протромбина и проакцелерина. Фактор VIII (антигемофильный глобулин А) является необходимым компонентом крови для формирования активного фактора X. Он очень лабилен. При хранении цитратной плазмы его активность снижается на 50% за 12 ч при температуре 37°С. Врожденный недостаток фактора VIII является причиной тяжелого заболевания – гемофилии А – наиболее частой формы коагулопатии. Фактор IX (антигемофильный глобулин В, Кристмас-фактор) принимает участие в образовании активного фактора X. Геморрагический диатез, вызванный недостаточностью фактора IX в крови, называют гемофилией В. Обычно при дефиците фактора IX геморрагические нарушения носят менее выраженный характер, чем при недостаточности фактора VIII. Фактор X (фактор Стюарта–Прауэра) назван по фамилиям больных, у которых был впервые обнаружен его недостаток. Он относится к α-глобулинам, имеет мол. массу 87000. Фактор X участвует в образовании тромбина из протромбина. У пациентов с недостатком фактора X увеличено время свертывания крови, нарушена утилизация протромбина. Клинически недостаточность фактора X выражается в кровотечениях, особенно после хирургических вмешательств или травм. Фактор X синтезируется клетками печени; его синтез зависит от содержания витамина К в организме. Фактор XI (фактор Розенталя) – антигемофильный фактор белковой природы. Недостаточность этого фактора при гемофилии С была открыта в 1953 г. Розенталем. Фактор XI называют также плазменным предшественников тромбопластина. Фактор XII (фактор Хагемана) участвует в пусковом механизме свертывания крови. Он также стимулирует фибринолитическую активность, кининовую систему и некоторые другие защитные реакции организма. Активация фактора XII происходит прежде всего в результате взаимодействия его с различными «чужеродными» поверхностями: кожей, стеклом, металлом и др. Врожденный недостаток данного белка вызывает заболевание, которое назвали болезнью Хагемана по фамилии первого обследованного больного, страдавшего этой формой нарушения свертывающей функции крови: увеличенное время свертывания крови при отсутствии геморрагии.
Фактор XIII (фибринстабилизирующий фактор) является белком плазмы крови, который стабилизирует образовавшийся фибрин, т.е. участвует в образовании прочных межмолекулярных связей в фибрин-полимере. Мол. масса 330000–350000. Белок состоит из трех полипептидных цепей, каждая из которых имеет мол. массу 110000.
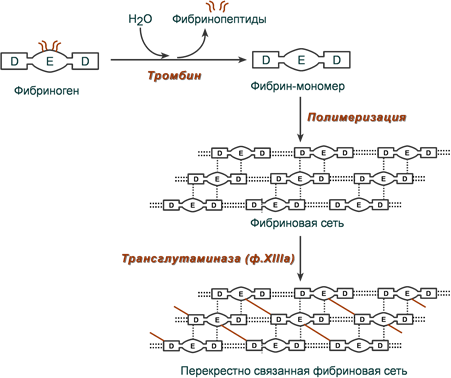
54. Превращение фибриногена в фибрин, образование тромба. Фибринолиз. Активаторы плазминогена и протеолитические ферменты как тромболитические лекарственные средства. Роль витамина К в свертывании крови. После появления большого количества тромбина начинается превращение фибриногена в фибрин. При этом тромбин отщепляет конечные А- и В-последовательности в α- и β цепях фибриногена с образованием растворимых фибрин-мономеров. После этого спонтанно начинается латеральная ассоциация фибрин-мономеров с образованием олигомеров и, в конечном итоге, еще непрочной (растворимой) фибриновой сети (фибрин-полимер).
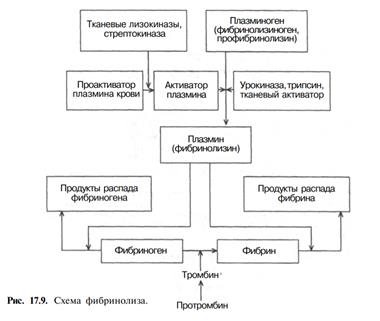
Далее фактор XIIIa (фибрин-стабилизирующий фактор, трансглутаминаза) в присутствии ионов Са2+ образует амидные связи между остатками лизина одной молекулы фибрин-полимера и остатками глутамина другой молекулы, чем связывает нити фибрин-полимера друг с другом. Ковалентно сшитые между собой нити фибрина образуют прочную трехмерную сеть, в которую включены тромбоциты, эритроциты и лейкоциты. Фибринолиз. В организме существует мощная фибринолитическая система, обеспечивающая возможность растворения (фибринолиз) сформировавшихся кровяных сгустков – тромбов (рис. 17.9). Ретрагированный сгусток фибрина в организме человека и животных под влиянием протеолитического фермента плазмы крови – плазмина подвергается постепенному рассасыванию с образованием ряда растворимых в воде продуктов гидролиза – пептидов. В норме плазмин находится в крови в форме неактивного предшественника – плазминогена. Превращение плазминогена в плазмин сопровождается отщеплением от полипептидной цепи 25% аминокислотных остатков. Катализируется эта реакция как активаторами крови, так и активаторами тканей *. Ведущая роль в этом процессе принадлежит кровяным активаторам. В норме активность кровяных активаторов плазминогена очень низкая, т.е. они находятся в основном в форме проактиваторов. Весьма быстрое превращение кровяного проактиватора в активатор плазминогена происходит под влиянием тканевых лизокиназ, а также стрептокиназы. Стрептокиназ а вырабатывается гемолитическим стрептококком и в обычных условиях в крови отсутствует. Однако при стрептококковой инфекции возможно образование стрептокиназы в большом количестве, что иногда приводит к усиленному фибринолизу и развитию геморрагического диатеза. Необходимо также иметь в виду, что наряду с фибринолитической системой крови человека имеется и система антифибринолитическая. Она состоит из различных антикиназ, антиплазмина и других антиактиваторов.
В практической медицине в лечебных целях ферментные препараты и их ингибиторы широко используются при нарушении свертывающей и противосвертывающей систем крови. Так, при тромбоэмболической болезни применяют ферменты, способствующие либо лизису образовавшегося тромба, либо снижению повышенной свертываемости крови. При состояниях, сопровождающихся развитием фибринолиза, используются ингибиторы ферментов. Исследования последних лет дают основание считать, что введение плазмина в сочетании с гепарином (антитромбином) может быть эффективным не только при лечении тромбоза легочной артерии, тромбофлебитов, но и при лечении инфаркта миокарда, если вводить эти препараты в первые часы после начала болезни. В качестве фибринолитических препаратов при инфаркте миокарда можно использовать также активаторы плазминогена – урокиназу и стрептокиназу. Новое перспективное направление – использование иммобилизованных ферментов (стрептодеказа и др.). Такие формы ферментов полностью сохраняют каталитическую активность, действие их в организме более длительно, а антигенность снижена. Следует помнить, что терапия тромболитическими препаратами требует хорошо организованного лабораторного контроля, так как протеолитическое действие плазмина не является строго специфическим только для фибрина – основного компонента тромба: введение плазмина может вызвать нежелательное расщепление многих важных для свертывания крови веществ, что в свою очередь может привести к серьезным осложнениям, в частности к развитию геморрагического диатеза.
|
|||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 174; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.200.136 (0.019 с.) |