
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ферменты плазмы: «собственные» и поступающие при повреждении клеток. Диагностическая ценность анализа ферментов плазмы.
Ферменты плазмы (сыворотки) крови Ферменты, которые обнаруживаются в норме в плазме или сыворотке крови, условно можно разделить на 3 группы: 1) секреторные, 2) индикаторные и 3) экскреторные. Секреторные ферменты,синтезируясь в печени, в норме выделяются в плазму крови, где играют определенную физиологическую роль. Типичными представителями данной группы являются ферменты, участвующие в процессе свертывания крови, и сывороточная холинэстераза. Индикаторные (клеточные) ферментыпопадают в кровь из тканей, где они выполняют определенные внутриклеточные функции. Одни из них находятся главным образом в цитозоле клетки (ЛДГ, альдолаза), другие – в митохондриях (глутаматдегидрогеназа), третьи – в лизосомах (β-глюкуронидаза, кислая фосфатаза) и т.д. Большая часть индикаторных ферментов в сыворотке крови определяется в норме лишь в следовых количествах. При поражении тех или иных тканей ферменты из клеток «вымываются» в кровь; их активность в сыворотке резко возрастает, являясь индикатором степени и глубины повреждения этих тканей. Экскреторные ферментысинтезируются главным образом в печени (лейцинаминопептидаза, щелочная фосфатаза и др.). В физиологических условиях эти ферменты в основном выделяются с желчью. Еще не полностью выяснены механизмы, регулирующие поступление данных ферментов в желчные капилляры. При многих патологических процессах выделение экскреторных ферментов с желчью нарушается, а активность в плазме крови повышается. Особый интерес для клиники представляет исследование активности индикаторных ферментов в сыворотке крови, так как по появлению в плазме или сыворотке крови ряда тканевых ферментов в повышенных количествах можно судить о функциональном состоянии и поражении различных органов (например, печени, сердечной и скелетной мускулатуры). При остром инфаркте миокарда особенно важно исследовать активность креатинкиназы, АсАТ, ЛДГ и оксибутиратдегидрогеназы. При заболеваниях печени, в частности при вирусном гепатите (болезнь Боткина), в сыворотке крови значительно увеличивается активность АлАТ и АсАТ, сорбитолдегидрогеназы, глутаматдегидрогеназы и некоторых других ферментов. Большинство ферментов, содержащихся в печени, присутствуют и в других органах тканей. Однако известны ферменты, которые более или менее специфичны для печеночной ткани. К таким ферментам, в частности, относится γ-глутамилтранспептидаза, или γ-глутамилтрансфераза (ГГТ). Данный фермент – высокочувствительный индикатор при заболеваниях печени. Повышение активности ГГТ отмечается при остром инфекционном или токсическом гепатите, циррозе печени, внутрипеченочной или внепеченочной закупорке желчных путей, первичном или метастатическом опухолевом поражении печени, алкогольном поражении печени. Иногда повышение активности ГГТ наблюдается при застойной сердечной недостаточности, редко – после инфаркта миокарда, при панкреатитах, опухолях поджелудочной железы. Органоспецифическими ферментамидля печени считаются также гистидаза, сорбитолдегидрогеназа, аргиназа и орнитинкарбамоилтрансфераза. Изменение активности этих ферментов в сыворотке крови свидетельствует о поражении печеночной ткани. В настоящее время особо важным лабораторным тестом стало исследование активности изоферментов в сыворотке крови, в частности изоферментов ЛДГ. Известно, что в сердечной мышце наибольшей активностью обладают изоферменты ЛДГ1 и ЛДГ2, а в ткани печени – ЛДГ4 и ЛДГ5. Установлено, что у больных с острым инфарктом миокарда в сыворотке крови резко повышается активность изоферментов ЛДГ1 и отчасти ЛДГ2. Изоферментный спектр ЛДГ в сыворотке крови при инфаркте миокарда напоминает изоферментный спектр сердечной мышцы. Напротив, при паренхиматозном гепатите в сыворотке крови значительно возрастает активность изоферментов ЛДГ4 и ЛДГ5 и уменьшается активность ЛДГ1 и ЛДГ2. Диагностическое значение имеет также исследование активности изоферментов креатинкиназы в сыворотке крови. Существуют по крайней мере 3 изофермента креатинкиназы: ВВ, ММ и MB. В мозговой ткани в основном присутствует изофермент ВВ (от англ. brain – мозг), в скелетной мускулатуре – ММ-форма (от англ. muscle – мышца). Сердце содержит гибридную МВ-форму, а также ММ-форму. Изоферменты креатинкиназы особенно важно исследовать при остром инфаркте миокарда, так как МВ-форма в значительном количестве содержится практически только в сердечной мышце. Повышение активности МВ-формы в сыворотке крови свидетельствует о поражении именно сердечной мышцы.
Форменные элементы крови. Особенности метаболизма в эритроцитах и лейкоцитах. Основные закономерности функционирования и взаимосвязь ренин-ангиотензин-альдостероновой и калликреин-кининовой систем. Вазоактивные пептиды. У человека в 1 мкл крови содержится 5•106 эритроцитов(красные кровяные клетки), которые образуются в костном мозге. Средняя продолжительность жизни этих клеток 125 дней. Разрушаются эритроциты в селезенке и печени. Большую часть гемоглобина взрослого человека составляет HbA1 (96–98% от общего содержания гемоглобина), в небольшом количестве присутствуют НbА2 (2–3%), а также HbF (менее 1%), которого много в крови новорожденных. Содержание лейкоцитовв 1 мкл крови составляет около 7•103, т.е. почти в 1000 раз меньше, чем эритроцитов. Лейкоциты в отличие от эритроцитов являются полноценными клетками с большим ядром и митохондриями и высоким содержанием нуклеиновых кислот.Лейкоцитыпредставлены клетками 3 типов: лимфоцитами (26% от общего числа лейкоцитов), моноцитами (7%) и полиморфно-ядерными лейкоцитами, или гранулоцитами (70%). При окрашивании различными красителями выявляются 3 типа гранулоцитов: нейтрофилы, эозинофилы и базофилы. Лимфоциты продуцируются в лимфатической ткани, основная их функция – образование антител, в частности иммуноглобулинов. В крови имеются кровяные пластинки, или тромбоциты (180-320•109/л), которые образуются из цитоплазмы мегакариоцитов костного мозга. Тромбоциты не могут считаться полноценными клетками, поскольку не содержат ядра, однако в них протекают все основные биохимические процессы: синтезируется белок, происходит обмен углеводов и липидов, осуществляется биологическое окисление, сопряженное с фосфорилированием, и т.д. Основная физиологическая функция кровяных пластинок – участие в процессе свертывания крови. Ренин-ангиотензин-альдостероновая система (РААС) Ренин – протеолитический фермент, продуцируемый юкстагломерулярными клетками, расположенными вдоль конечной части афферентных (приносящих) артериол, входящих в почечные клубочки. Восстановление объёма крови при обезвоживании организма Уменьшение общего объёма жидкости (в результате кровопотери, при обильной рвоте, диарее) вызывает высвобождение ренина. Снижение импульсации от барорецепторов предсердий и артерий в результате уменьшения внутрисосудистого объёма жидкости также приводит к выходу ренина в плазму крови. В результате увеличивается продукция ангитензина II (мощный стимулятор альдостерона). В результате в крови увеличивается концентрация альдостерона, что приводит к задержке ионов натрия. А это, в свою очередь, является сигналом для осморецепторов гиопталамуса и секреции из нервных окончаний передней доли гипофиза АДГ, стимулирующего реабсорбцию воды из собирательных трубочек. Ангиотензин II, оказывая сильное сосудосуживающее действие, повышает артериальное давление (АД), а также усиливает жажду. Поступающая с питьём вода в большей мере, чем это происходит в норме, задерживается в организме. Увеличение объёма жидкости, а также повышение АД приводит к устранению стимула, который вызвал активацию ренин-ангиотензиновой системы, секрецию альдостерона и восстановление объёма крови.
Ренин-ангиотензин-альдостероновая система (РААС): Калликреин-кининовой системе, поскольку она является связующим звеном между ними и единым координационным комплексом, объединяющим нервную, эндокринную и иммунную системы организма. Таким образом, следует считать, что информация о функциональном состоянии калликреин-кининовой системы является интегральным лабораторным показателем гомеостаза. Последний нарушается при различных повреждениях органов и тканей, в том числе воспалительных процессах различной этиологии и локализации. Сведения об изменениях активности отдельных компонентов калликреин-кининовой системы позволяют проводить оценку как характера и степени изменений биохимического гомеостаза во всех стадиях течения болезни, Вазоактивные пептиды. К группе пептидов, оказывающих влияние на тонус сосудов (вазоактивные), относятся брадикинин, каллидин и ангиотензин. Первый пептид содержит 9 остатков аминокислот, второй – 10, а третий – 8. Все они синтезируются из неактивных белковых предшественников в результате процесса посттрансляционной модификации.
|
|||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 139; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.139.233.43 (0.007 с.) |
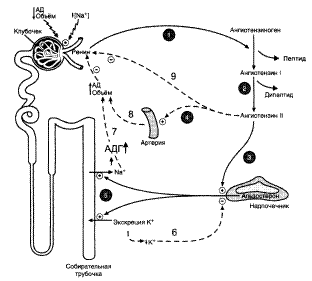 1 – ренин катализирует превращение ангиотензиногена (гликопротеин) в ангиотензин I (декапептид); 2 – ангиотензин I превращается в ангиотензин II под действием ангиотензин-превращающего фермента (АПФ – фермент, локализованный в эндотелиальных клетках, лёгких и плазме крови), отщепляющего 2 аминокислотных остатка от декапептида; 3 – ангиотензин II стимулирует синтез и секрецию альдостерона; 4 – ангиотензин II вызывает сужение сосудов периферических артерий; 5 – альдостерон стимулирует реабсорбцию Na+ и экскрецию К+; 6,7,8,9 – торможение секреции ренина и альдостерона по механизму отрицательной обратной связи. Пунктирные линии – регуляция по принципу обратной связи.
1 – ренин катализирует превращение ангиотензиногена (гликопротеин) в ангиотензин I (декапептид); 2 – ангиотензин I превращается в ангиотензин II под действием ангиотензин-превращающего фермента (АПФ – фермент, локализованный в эндотелиальных клетках, лёгких и плазме крови), отщепляющего 2 аминокислотных остатка от декапептида; 3 – ангиотензин II стимулирует синтез и секрецию альдостерона; 4 – ангиотензин II вызывает сужение сосудов периферических артерий; 5 – альдостерон стимулирует реабсорбцию Na+ и экскрецию К+; 6,7,8,9 – торможение секреции ренина и альдостерона по механизму отрицательной обратной связи. Пунктирные линии – регуляция по принципу обратной связи.


