
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Поверхневі явища та адсорбціяСодержание книги Поиск на нашем сайте Між дисперсною фазою та дисперсійним середовищем існує поверхня поділу, на якій відбувається їхня взаємодія. В дисперсних системах ця поверхня є великою, тому число молекул на поверхні сумірне з числом молекул у глибині фази. Поверхневі молекули енергетично відрізняються від молекул, що знаходяться у глибині фази, тому в поверхневих шарах спостерігаємо різноманітні явища, що визначають особливі властивості дисперсних систем. Енергетична нерівнозначність глибинних і поверхневих молекул зумовлена тим, що силове поле глибинної молекули є компенсованим за рахунок взаємодії із сусідніми молекулами тієї ж фази, при цьому рівнодіюча сил взаємодії дорівнює нулю. Силове поле поверхневої молекули, яка знаходиться на межі фаз, що відрізняються за полярністю, не компенсується сусідніми молекулами повністю, при цьому рівнодіюча спрямована в середину фази перпендикулярно до поверхні та має кінцеву величину. Рівнодіючу силу, віднесену до одиниці площі поверхні, називають внутрішнім тиском. Для води, наприклад, внутрішній тиск дорівнює 145×107 Па (14800 кг/см2). Силове поле поверхневої молекули та внутрішній тиск призводять до появи поверхневого натягу s – сили, яка діє на одиницю довжини контуру, що обмежує поверхню, по дотичній до поверхні і яка намагається її скоротити. Поверхневий натяг визначають також як роботу утворення одиниці поверхні в умовах ізотермічного оборотного процесу. Вимірюють s в Н/м або в Дж/м2. Для одиниці площі поверхні
тобто з точки зору термодинаміки поверхневий натяг – це вільна енергія одиниці площі поверхні. Поверхневий натяг залежить від температури. Зі зростанням температури поверхневий натяг зменшується прямолінійно аж до критичної температури, при якій зникає різниця між фазами і поверхневий натяг стає рівним нулю. Дисперсні системи мають дуже розвинені поверхні і підвищений запас вільної енергії, тому ці системи є здебільшого термодинамічно нестійкими. В них самочинно перебігають процеси, що призводять до зменшення вільної енергії. Це відбувається або за рахунок зменшення площі поверхні внаслідок самочинного злипання частинок дисперсної фази (коагуляція), або за рахунок зменшення поверхневого натягу, якщо на поверхні поділу фаз накопичуються поверхнево-активні речовини. При додаванні таких речовин у дисперсну систему відбувається їхнє самочинне накопичення в поверхневому шарі рідини, що призводить до різкого зниження поверхневого натягу. Такий процес є адсорбцією на рідкій поверхні. Адсорбцією називають самочинний процес зміни концентрації речовин у гетерогенній системі на межі поділу фаз. Якщо концентрація на межі поділу фаз зростає, то адсорбція є позитивною, а якщо концентрація у поверхневому шарі зменшується, то адсорбція є негативною. Фазу, на якій перебігає адсорбція, називають адсорбентом, а речовину, яка адсорбується, – адсорбатом або адсорбтивом. Величина адсорбції має розмірність [кмоль/м2], [моль/м2], [кмоль/кг], [моль/кг]. За впливом на поверхневий натяг поверхні поділу фаз речовини поділяють на поверхнево-активні (ПАР) та поверхнево-інактивні (ПІАР). ПАР – це речовини, які зменшують поверхневий натяг і зазвичай є дифільними молекулами R–OH, R–COOH, R–NH2, R–SO3H або їхніми іонізованими формами. ПІАР (поверхнево-інактивні речовини) прагнуть перейти з поверхні рідини в об’єм, тому введення їх в розчин призводить до збільшення поверхневого натягу на міжфазній поверхні. До них належать речовини, що добре сольватуються, зокрема неорганічні солі, кислоти, основи. У випадку, коли адсорбентом є рідина, а процес проходить на межі рідина – газ, для кількісного опису адсорбції використовують рівняння ізотерми адсорбції Гіббса
де Г(гамма) – надлишкова адсорбція розчиненої речовини (надлишок адсорбату в поверхневому шарі). Знак і величина Г визначаються похідною Для розрахунку поверхневої адсорбції за рівнянням Гіббса (2.1) експериментально визначають залежність поверхневого натягу від концентрації, а потім графічним, чисельним або аналітичним диференціюванням визначають поверхневу активність Обробка експериментальних даних полегшується, якщо відома залежність s=f(c) в аналітичному вигляді. З цією метою використовують рівняння Шишковського
де А та В – емпіричні константи, s0 та s – поверхневий натяг відповідно розчинника та розчину ПАР з концентрацією с. Константи рівняння Шишковського можуть бути використані для розрахунку адсорбції за рівнянням Ленгмюра
де a ¥ – гранична адсорбція, що відповідає максимальному заповненню активних центрів на поверхні адсорбенту, тобто утворенню насиченого моношару; К – константа, яка залежить від енергетики взаємодії адсорбату з адсорбентом (константа рівноваги для оборотного процесу адсорбція «десорбція). За рівнянням (2.3) визначають не надлишкову адсорбцію Г розчиненої речовини, а повну адсорбцію a на поверхні поділу фаз. При адсорбції газу і пари на твердій поверхні є можливим безпосереднє визначення їхньої кількості за збільшенням маси адсорбенту в результаті адсорбції чи за різницею тисків газу до та після адсорбції. У випадку, коли процес адсорбції газу та пари відбувається з утворенням мономолекулярного шару адсорбату, для опису процесу використовують теорію мономолекулярної адсорбції Ленгмюра. Рівняння Ленгмюра для величини рівноважної адсорбції а має вигляд:
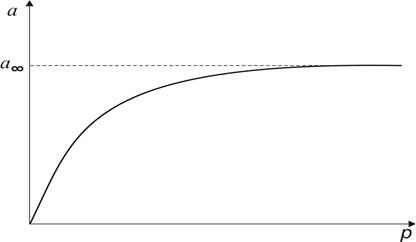
де р – рівноважний тиск адсорбату. В цьому випадку ізотерма адсорбції а = f (p) має форму кривої насичення (рис. 2.1).
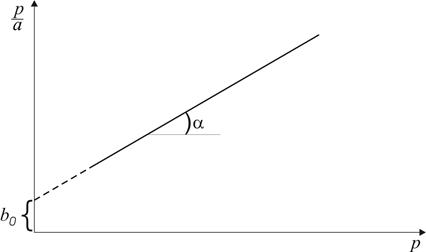
Рис. 2.1. Ізотерма мономолекулярної адсорбції за Ленгмюром Константи рівняння Ленгмюра a ¥ та К знаходять з лінеаризованої оберненої форми рівняння (2.4):
яке в координатах
Рис. 2.2. Залежність З рис. 2.2 випливає, що Якщо рівняння (2.5) помножити на р, отримаємо
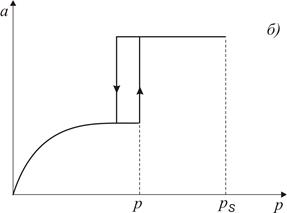
Залежність У тому випадку, коли під впливом зовнішніх умов (тиску, природи адсорбенту та адсорбату) адсорбція пари відбувається з утворенням полімолекулярного адсорбційного шару процес адсорбції не узгоджується з теорією Ленгмюра. В такому разі ізотерма адсорбції має S -подібний характер.
Рис. 2.3. Залежність Вперше такі ізотерми знайшли пояснення в рамках теорії Поляні, згідно з якою міжмолекулярні сили не насичені одним шаром молекул адсорбату, а інтенсивність їх знижується з відстанню від поверхні. Біля поверхні адсорбенту ці сили настільки значні, що призводять до конденсації пари в рідину. За міру інтенсивності міжмолекулярних сил прийнято адсорбційний потенціал e – роботу ізотермічного стиснення одного моля пари від тиску p до тиску насиченої пари ps, яка знаходиться в рівновазі з рідиною:
У теорії Поляні вважається, що залежність адсорбційного потенціалу e від адсорбційного об’єму Для опису багатошарової адсорбції пари на поверхні адсорбенту використовують теорію Брунауера, Еммета та Теллера (БЕТ). Основні положення теорії БЕТ наступні: 1) адсорбція полімолекулярна (на поверхні адсорбенту може утворитись шар товщиною в кілька молекул); 2) між молекулами адсорбенту та адсорбату у першому шарі та між молекулами адсорбату у наступних шарах діють сили Ван-дер-Ваальса; 3) процес хаотичний, тобто забудова наступних шарів починається при неповному заповненні попередніх шарів. Відповідно до цієї теорії адсорбція пари при постійній температурі описується рівнянням:
де a – рівноважна адсорбція речовини; a ¥ – ємність моношару (адсорбція в заповненому моношарі); С ‑ константа, що залежить від енергії взаємодії молекул в адсорбційному шарі; За експериментально одержаною ізотермою адсорбції за допомогою теорії БЕТ розраховують питому поверхню адсорбенту, використовуючи лінійну форму рівняння БЕТ:
Для цього будують графік залежності Питому поверхню адсорбенту можна обчислити, якщо відома площа S0, яку займає одна молекула адсорбату в адсорбційному шарі, за формулою
де NА ‑ число Авогадро. При адсорбції на межі тверде тіло – розчин необхідно враховувати взаємодію адсорбенту не тільки з молекулами розчиненої речовини, але й з молекулами розчинника. При адсорбції на твердих адсорбентах із розчинів розрізняють молекулярну адсорбцію (адсорбат адсорбується у вигляді молекул) та іонну адсорбцію з розчинів електролітів. При адсорбції з розчинів кількість адсорбованої речовини обчислюють за зменшенням її концентрації у розчині.
де c0 ‑ вихідна концентрація розчину; c ‑ рівноважна концентрація розчину після адсорбції; V ‑ об’єм розчину; m ‑ маса адсорбенту. При невеликих концентраціях розчину ізотерми адсорбції часто описуються рівнянням Фрейндліха:
де a ‑ кількість адсорбованої речовини; c ‑ рівноважна концентрація розчину; k, n ‑ емпіричні константи ( У широкому діапазоні концентрацій залежність адсорбції від c може проходити через максимум, мінімум, а величина адсорбції може набувати нульового значення. Така концентраційна залежність адсорбції стає зрозумілою, якщо врахувати можливість конкуренції між молекулами адсорбату і розчинника за поверхню адсорбенту. На процес молекулярної адсорбції впливають властивості адсорбенту, адсорбату та природа середовища. Полярні речовини краще адсорбуються полярними адсорбентами з розчинів неполярних розчинників і, навпаки, неполярні речовини краще адсорбуються неполярними адсорбентами з розчинів полярних розчинників. Особливістю адсорбції електролітів є її вибірковість. В першу чергу на кристалічній поверхні адсорбуються іони, що є одноіменними або ізоморфними з іонами поверхні (правило Панета-Фаянса). Чим більший заряд має іон, тим краще він адсорбується. З іонів однакового заряду краще адсорбуються іони більшого розміру. Капілярна конденсація Адсорбція пари на поруватих адсорбентах, як правило, супроводжується її капілярною конденсацією в порах при тисках p, які менше тиску насиченої пари ps над плоскою поверхнею. На стінках пор при малих відносних тисках Співвідношення між тисками насиченої пари над плоскою та викривленою поверхнею з радіусом кривизни r описує рівняння Томсона (лорда Кельвіна):
де s – поверхневий натяг рідини; VМ – молярний об’єм рідини; r – радіус кривизни поверхні рідини; р s – тиск над плоскою поверхнею; р – тиск над викривленою поверхнею; Т – абсолютна температура; R – універсальна газова стала. Ефект зниження тиску пари над викривленою поверхнею має місце лише для тонких капілярів з r < 10-7 м. Для таких капілярів радіус кривизни поверхні співпадає з радіусом капіляра. Це дає можливість використовувати рівняння Томсона (3.1) для встановлення зв’язку між об’ємами пор адсорбенту та їх радіусами (текстурні характеристики). Для з’ясування особливостей капілярної конденсації у випадку адсорбенту, що містить пори різної форми та розміру, розглянемо процес конденсації в порах математичного адсорбенту. Під математичним сорбентом розуміють ідеалізований адсорбент, пори якого мають однакову правильну форму та розмір. Процес адсорбції на будь-якому поруватому адсорбенті при невеликих тисках перебігає через утворення моно- та полімолекулярної плівки адсорбату. При таких тисках ізотерма адсорбції має форму ізотерми Ленгмюра. За умови, що адсорбована рідина змочує поверхню адсорбенту, утворюється адсорбційна плівка з увігнутим меніском в порах і з цих причин починається капілярна конденсація. Внаслідок цього ізотерма істинної адсорбції при підвищенні тиску переходить в ізотерму капілярної конденсації. Залежно від форми пор ізотерма капілярної конденсації буде мати різну форму (рис. 3.1, 3.2, 3.3).
Рис. 3.1. Форма пори (а) та ізотерма адсорбції (б) для конусоподібних пор За тиску p (див. рис. 3.1) пара стає насиченою відносно увігнутої поверхні і починає конденсуватись. В міру заповнення пори радіус кривизни поверхні збільшується і, як наслідок, тиск насиченої пари зростає до значення р s. Зі зменшенням тиску рідина зі стінок капіляра десорбується (випаровується). Ізотерма десорбції співпадатиме з ізотермою адсорбції внаслідок повної оборотності процесу.
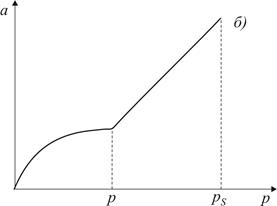
Рис. 3.2. Форма пори (а) та ізотерма адсорбції (б) для циліндричних пор, відкритих з одного кінця За тиску p (див. рис. 3.2) пара стає насиченою відносно увігнутої поверхні і починає конденсуватись. На відміну від конусоподібних пор радіус меніска при заповненні такої пори не змінюється, тому її заповнення відбувається при постійному тиску р, про що свідчить вертикальна частина ізотерми. Процес випаровування з пори відбувається при тому самому тиску, оскільки утворюється меніск такої ж форми. Таким чином, конденсація в циліндричних порах, закритих з одного кінця, є повністю оборотною.
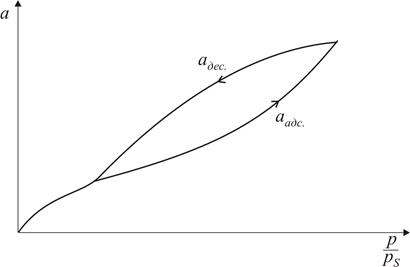
Рис. 3.3. Форма пори (а) та ізотерма адсорбції (б) для наскрізних циліндричних пор При адсорбції у наскрізних порах (рис. 3.3) при постійному тиску р утворюється плівка рідини, яка має форму пори (циліндра). Капілярна конденсація починається на циліндричному меніску (а не на сферичному, як у двох попередніх випадках). Внаслідок потовщення плівки на внутрішній поверхні пори радіус кривизни циліндричної увігнутої поверхні зменшується, тобто пара швидко і необоротно конденсується, поки пори повністю не наповняться рідиною. Десорбція протікає інакше: рідина випаровується з обох боків циліндричної пори, утворюючи два сферичних меніски, які рухаються назустріч. Радіус кривизни сферичних поверхонь при цьому залишається сталим. В результаті різних механізмів адсорбції і десорбції ізотерми прямого та зворотного процесу не співпадають і спостерігається явище капілярного гістерезису. Всі розглянуті приклади стосуються математичних сорбентів. Реальні адсорбенти мають капіляри різних розмірів та форм, тому конденсація в них починається при різних значеннях тиску пари адсорбату. При найнижчих тисках конденсація відбувається в найтонших капілярах, а в міру збільшення тиску пари адсорбату починають заповнюватись капіляри, які мають все більші і більші радіуси. Характерною особливістю капілярної конденсації є її неповна оборотність. Десорбція з пор відбувається при менших тисках ніж адсорбція, тому в порах залишається рідина. Лінія десорбції проходить лівіше ізотерми адсорбції, утворюючи петлю гістерезису (рис. 3.4). Ізотерми капілярної конденсації використовують для дослідження текстурних характеристик сорбенту, визначаючи загальний об’єм капілярів в сорбенті і їхній розподіл за радіусами.
Рис. 3.4. Ізотерма капілярної конденсації на адсорбентах, які мають пори різної форми та розміру Загальний об’єм капілярів, заповнених при даному значенні адсорбції a, розраховується за формулою
За допомогою лінії десорбції ізотерми капілярної конденсації для різних значень тиску розраховують радіус пор, які вже зайняті рідиною, за рівнянням Томсона:
За значеннями адсорбції а визначають об’єм поглинутої речовини Vпор. Будують інтегральну криву розподілу за радіусами Vпор = f(r). За допомогою графічного диференціювання інтегральної кривої одержують диференціальну криву розподілу капілярів за радіусами (текстурну характеристику), за якою визначають переважні розміри пор адсорбенту.
|
|||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 242; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.012 с.) |


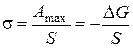 ,
,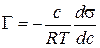 ,
,
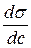 та концентрацією розчиненої речовини. Для ПАР
та концентрацією розчиненої речовини. Для ПАР 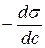 . Вона характеризує здатність молекул розчиненої речовини до адсорбції. При збільшенні вуглеводневого радикалу в молекулі ПАР на одну групу –СН2– поверхнева активність збільшується у 3,2 – 3,4 рази (правило Дюкло – Траубе або просто правило Траубе).
. Вона характеризує здатність молекул розчиненої речовини до адсорбції. При збільшенні вуглеводневого радикалу в молекулі ПАР на одну групу –СН2– поверхнева активність збільшується у 3,2 – 3,4 рази (правило Дюкло – Траубе або просто правило Траубе).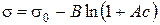 ,
,
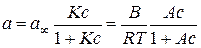 ,
,
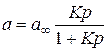 ,
,
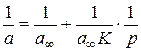 ,
,
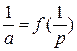 (рис. 2.2) має вигляд прямої.
(рис. 2.2) має вигляд прямої.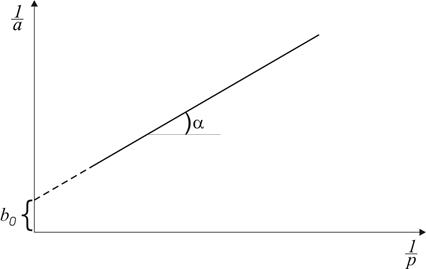
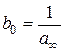 , а
, а 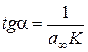 .
.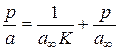 .
.
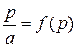 також є лінійною (рис. 2.3). На рис. 2.3
також є лінійною (рис. 2.3). На рис. 2.3 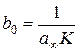 , а
, а 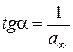 .
.
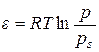 .
.
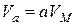 (VМ – молярний об’єм рідини, a – адсорбція) однакова для всіх температур і називається характеристичною кривою e = f(Va). Знаючи цю залежність та ізотерму адсорбції пари при одній температурі, можна розрахувати ізотерми адсорбції цієї пари при інших температурах.
(VМ – молярний об’єм рідини, a – адсорбція) однакова для всіх температур і називається характеристичною кривою e = f(Va). Знаючи цю залежність та ізотерму адсорбції пари при одній температурі, можна розрахувати ізотерми адсорбції цієї пари при інших температурах.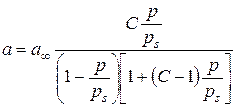 ,
,
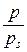 – відносний тиск.
– відносний тиск.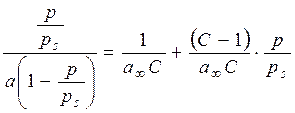 .
.
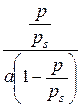 від
від 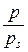 . За величиною відрізка, що відтинається прямою на осі ординат і дорівнює
. За величиною відрізка, що відтинається прямою на осі ординат і дорівнює 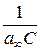 та за кутовим коефіцієнтом прямої
та за кутовим коефіцієнтом прямої 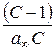 розраховують a ¥ .
розраховують a ¥ .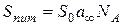 ,
,
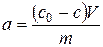 ,
,
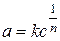 ,
,
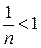 ).
).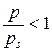 .
.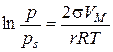 ,
,

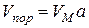 .
.
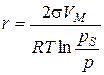 .
.



