
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Поверхневі явища та дисперсні системиСтр 1 из 7Следующая ⇒
Поверхневі явища та дисперсні системи Методичні вказівки до виконання розрахункових робіт для студентів напряму підготовки 6.051301 «Хімічна технологія» усіх форм навчання
Затверджено Методичною радою НТУУ «КПІ» Київ НТУУ «КПІ» 2011
Поверхневі явища та дисперсні системи [Текст]: метод. вказівки до викон. розрах. робіт для студ. напряму підготов. 6.051301 «Хімічна технологія» усіх форм навч. / Уклад.: О.С. Бережницька, М.Є. Пономарьов, І.О. Ренський, Т. М. Пилипенко, В. Г. Єфімова.- К.: НТУУ «КПІ», 2011.-60 с.-200 пр.
Гриф надано Методичною радою НТУУ»КПІ» (Протокол №… від….2011 р.) Навчальне видання
Поверхневі явища та дисперсні системи Методичні вказівки до виконання розрахункових робіт для студентів напряму підготовки 6.051301 «Хімічна технологія» усіх форм навчання
Укладачі: Бережницька Олександра Степанівна, канд. хім. наук, доц. Пономарьов Микола Євгенович, канд. хім. наук, доц. Ренський Ігор Олександрович Пилипенко Тетяна Миколаївна, канд. техн. наук Єфімова Вероніка Гаріївна, канд. техн. наук, доц.
Відповідальний редактор Г. А. Рудницька, канд. хім. наук, доц.
Рецензент О. О. Андрійко, д-р хім. наук, проф.
За редакцією укладачів Надруковано з оригінал-макета замовника
ВСТУП Хімія поверхневих явищ та дисперсних систем є фундаментальною хімічною дисципліною при підготовці фахівців в галузі хімії та хімічної технології. Будучи хімією реальних тіл, вона забезпечує неперервність зв’язку між загальнохімічними та хіміко-технологічними дисциплінами. Вона займає важливе місце серед інших наук, рівень розвитку яких визначає технічний прогрес, високу продуктивність та науково-технічну культуру проведення технологічних процесів. Курс «Поверхневі явища та дисперсні системи» будується на базі відомостей, засвоєних під час вивчення курсів неорганічної, аналітичної, органічної та фізичної хімії. Він поглиблює фундаментальні знання основних законів природознавства, які було отримано при вивченні попередніх дисциплін, сприяє формуванню інженерного мислення, дає теоретичну підготовку, що є необхідною для розуміння різноманітних технологічних процесів. Курс закладає фундамент для подальшого засвоєння спеціальних технологічних дисциплін та формує у майбутніх спеціалістів науковий погляд на світ у цілому. Практичне засвоєння курсу передбачає не тільки глибоке вивчення теоретичних положень, але й оволодіння методами розрахунку колоїдно-хімічних процесів, величин та параметрів, які їх характеризують.
У даних вказівках викладено питання теорії в об’ємі, що необхідний для правильного виконання розрахунків, наведено розв’язки типових задач та варіанти завдань для домашнього виконання. Деякі основні поняття курсу Дисперсними називаються гетерогенні системи, в яких одна фаза знаходиться в середовищі іншої у вигляді дрібних частинок. Частинки подрібненої фази утворюють дисперсну фазу, а неперервна фаза, що їх оточує, є дисперсійним середовищем. Частинки дисперсної фази є не окремими молекулами, а агрегатами молекул. Основними властивостями дисперсних систем є гетерогенність та дисперсність. Розміри частинок дисперсної фази суттєво більші за розміри молекул та іонів в істинних розчинах. Таким системам притаманні: сповільнена дифузія та малий осмотичний тиск, опалесценція, коагуляція (злипання часток) та електрофорез. Ступінь подрібнення дисперсної фази характеризують величиною дисперсності D. Дисперсність – величина, що обернена до розміру частинок:
де l – довжина ребракубічної частинки; d – діаметр сферичної частинки. Для характеристики частинок складнішої форми використовують еквівалентний діаметр, тобто діаметр такої сферичної частинки, яка в гідродинамічному потоці поводить себе, як дана частинка неправильної форми. Дисперсні системи часто характеризують величиною питомої поверхні – відношенням поверхні поділу фаз (S) до об’єму (V) або до маси дисперсної фази (m):
Тому для кубічних частинок:
а для сферичних частинок:
Дисперсні системи класифікують за різними ознаками: за розміром часток дисперсної фази, за агрегатним станом часток дисперсної фази та дисперсійного середовища, за характером взаємодії між частками дисперсної фази та дисперсійним середовищем, за механічними властивостями та ін.
У відповідності до класифікації за розмірами часток дисперсні системи поділяють на грубодисперсні (10-5... 10-3 м), мікродисперсні (10-7...10-5 м) та колоїднодисперсні (ультрамікродисперсні) (10-9...10-7 м). Системи, що містять частинки з розмірами, меншими ніж 10-9 м, є молекулярними та іонними, тобто гомогенними системами. Найбільш поширеною є класифікація дисперсних систем за агрегатним станом дисперсної фази та дисперсійного середовища (системи Т/Р – золі, суспензії, Т/Г – дими та пил, Р/Р – емульсії, Г/Р – піни, Т/Т – сплави і т. п.). Залежно від інтенсивності взаємодії частинок дисперсної фази та дисперсійного середовища системи поділяють на ліофільні (сильні взаємодії) та ліофобні (слабкі взаємодії). Капілярна конденсація Адсорбція пари на поруватих адсорбентах, як правило, супроводжується її капілярною конденсацією в порах при тисках p, які менше тиску насиченої пари ps над плоскою поверхнею. На стінках пор при малих відносних тисках Співвідношення між тисками насиченої пари над плоскою та викривленою поверхнею з радіусом кривизни r описує рівняння Томсона (лорда Кельвіна):
де s – поверхневий натяг рідини; VМ – молярний об’єм рідини; r – радіус кривизни поверхні рідини; р s – тиск над плоскою поверхнею; р – тиск над викривленою поверхнею; Т – абсолютна температура; R – універсальна газова стала. Ефект зниження тиску пари над викривленою поверхнею має місце лише для тонких капілярів з r < 10-7 м. Для таких капілярів радіус кривизни поверхні співпадає з радіусом капіляра. Це дає можливість використовувати рівняння Томсона (3.1) для встановлення зв’язку між об’ємами пор адсорбенту та їх радіусами (текстурні характеристики). Для з’ясування особливостей капілярної конденсації у випадку адсорбенту, що містить пори різної форми та розміру, розглянемо процес конденсації в порах математичного адсорбенту. Під математичним сорбентом розуміють ідеалізований адсорбент, пори якого мають однакову правильну форму та розмір. Процес адсорбції на будь-якому поруватому адсорбенті при невеликих тисках перебігає через утворення моно- та полімолекулярної плівки адсорбату. При таких тисках ізотерма адсорбції має форму ізотерми Ленгмюра. За умови, що адсорбована рідина змочує поверхню адсорбенту, утворюється адсорбційна плівка з увігнутим меніском в порах і з цих причин починається капілярна конденсація. Внаслідок цього ізотерма істинної адсорбції при підвищенні тиску переходить в ізотерму капілярної конденсації. Залежно від форми пор ізотерма капілярної конденсації буде мати різну форму (рис. 3.1, 3.2, 3.3).
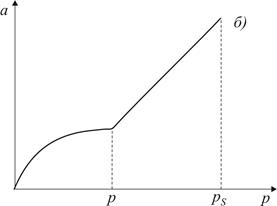
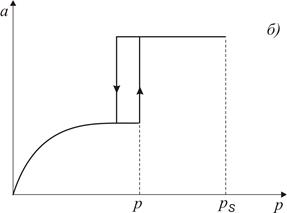
Рис. 3.1. Форма пори (а) та ізотерма адсорбції (б) для конусоподібних пор
За тиску p (див. рис. 3.1) пара стає насиченою відносно увігнутої поверхні і починає конденсуватись. В міру заповнення пори радіус кривизни поверхні збільшується і, як наслідок, тиск насиченої пари зростає до значення р s. Зі зменшенням тиску рідина зі стінок капіляра десорбується (випаровується). Ізотерма десорбції співпадатиме з ізотермою адсорбції внаслідок повної оборотності процесу.
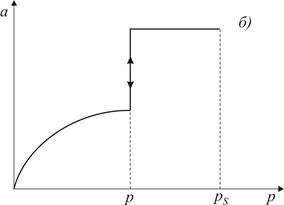
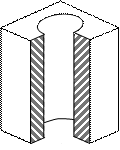
Рис. 3.2. Форма пори (а) та ізотерма адсорбції (б) для циліндричних пор, відкритих з одного кінця За тиску p (див. рис. 3.2) пара стає насиченою відносно увігнутої поверхні і починає конденсуватись. На відміну від конусоподібних пор радіус меніска при заповненні такої пори не змінюється, тому її заповнення відбувається при постійному тиску р, про що свідчить вертикальна частина ізотерми. Процес випаровування з пори відбувається при тому самому тиску, оскільки утворюється меніск такої ж форми. Таким чином, конденсація в циліндричних порах, закритих з одного кінця, є повністю оборотною.
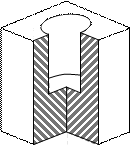
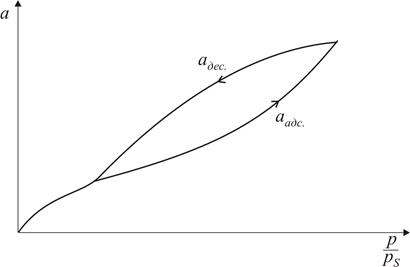
Рис. 3.3. Форма пори (а) та ізотерма адсорбції (б) для наскрізних циліндричних пор При адсорбції у наскрізних порах (рис. 3.3) при постійному тиску р утворюється плівка рідини, яка має форму пори (циліндра). Капілярна конденсація починається на циліндричному меніску (а не на сферичному, як у двох попередніх випадках). Внаслідок потовщення плівки на внутрішній поверхні пори радіус кривизни циліндричної увігнутої поверхні зменшується, тобто пара швидко і необоротно конденсується, поки пори повністю не наповняться рідиною. Десорбція протікає інакше: рідина випаровується з обох боків циліндричної пори, утворюючи два сферичних меніски, які рухаються назустріч. Радіус кривизни сферичних поверхонь при цьому залишається сталим. В результаті різних механізмів адсорбції і десорбції ізотерми прямого та зворотного процесу не співпадають і спостерігається явище капілярного гістерезису. Всі розглянуті приклади стосуються математичних сорбентів. Реальні адсорбенти мають капіляри різних розмірів та форм, тому конденсація в них починається при різних значеннях тиску пари адсорбату. При найнижчих тисках конденсація відбувається в найтонших капілярах, а в міру збільшення тиску пари адсорбату починають заповнюватись капіляри, які мають все більші і більші радіуси. Характерною особливістю капілярної конденсації є її неповна оборотність. Десорбція з пор відбувається при менших тисках ніж адсорбція, тому в порах залишається рідина. Лінія десорбції проходить лівіше ізотерми адсорбції, утворюючи петлю гістерезису (рис. 3.4).
Ізотерми капілярної конденсації використовують для дослідження текстурних характеристик сорбенту, визначаючи загальний об’єм капілярів в сорбенті і їхній розподіл за радіусами.
Рис. 3.4. Ізотерма капілярної конденсації на адсорбентах, які мають пори різної форми та розміру Загальний об’єм капілярів, заповнених при даному значенні адсорбції a, розраховується за формулою
За допомогою лінії десорбції ізотерми капілярної конденсації для різних значень тиску розраховують радіус пор, які вже зайняті рідиною, за рівнянням Томсона:
За значеннями адсорбції а визначають об’єм поглинутої речовини Vпор. Будують інтегральну криву розподілу за радіусами Vпор = f(r). За допомогою графічного диференціювання інтегральної кривої одержують диференціальну криву розподілу капілярів за радіусами (текстурну характеристику), за якою визначають переважні розміри пор адсорбенту. Контрольні завдання Для зручності виконання роботи радимо скопіювати сторінки із завданням та перенести в наведені після кожного завдання таблиці величини, необхідні для розрахунків відповідно до варіанту, який виконується, використовуючи посилання в тексті завдань.
Завдання 1. Розрахувати питому поверхню адсорбенту за ізотермою адсорбції речовини А, якщо відома площа, яку займає молекула речовини А на поверхні адсорбенту. Дані для розрахунку наведено в табл. 1.1 Додатку 1. Дані для розрахунку питомої поверхні адсорбенту за ізотермою адсорбції речовини А
Завдання 2. Побудувати криву капілярної конденсації, інтегральну та диференціальну криві розподілу об’єму пор адсорбенту за радіусами. Дані для розрахунку наведено в табл. 2.1 та в табл. 2.2 Додатку 2. Дані по конденсації парів А на адсорбенті В при температурі Т = 293 К
Мольний об’єм та поверхневий натяг адсорбатів при Т = 293 К
Завдання 3. Для монодисперсного гідрозолю (табл. 3.1 Додатку 3) відома гіпсометрична висота h½ сферичних частинок при температурі Т К. Визначити:
Всі необхідні для розрахунку дані наведено в табл. 3.1 Додатку 3 та табл. 2.3 Додатку 2.
Характеристики дисперсної фази монодисперсних гідрозолів
Характеристики дисперсійного середовища (Н2О) в залежності від температури
Завдання 4. На підставі експериментальних даних про зміну частинної концентрації (n, кількість частинок/м3) у часі при коагуляції золю (табл. 4.1 Додатку 4):
Необхідні дані для розрахунків приведено в табл. 4.1 Додатку 4.
ДОДАТКИ Додаток 1 Таблиця 1.1. Дані для розрахунку питомої поверхні адсорбенту за ізотермою адсорбції речовини А
Продовження табл. 1.1
Додаток 2 Таблиця 2.1. Дані по конденсації парів А на адсорбенті В при Т = 293 К
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
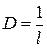 або
або 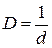 ,
,

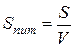 [м-1] або
[м-1] або 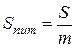 [м2 /кг].
[м2 /кг].
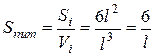 ,
,
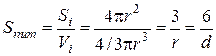 .
.
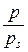 утворюється шар сконденсованого адсорбату. Утворена таким чином поверхня рідини буде при хорошому змочуванні мати увігнутий меніск. При такій формі поверхні сила притягання поверхневої молекули рідини суттєво більша, ніж для молекули на плоскій поверхні (у кожної молекули на увігнутій поверхні більша кількість сусідніх молекул рідини), тому тиск насиченої пари над увігнутим меніском p менше ps, і процес конденсації пари в порах починається при
утворюється шар сконденсованого адсорбату. Утворена таким чином поверхня рідини буде при хорошому змочуванні мати увігнутий меніск. При такій формі поверхні сила притягання поверхневої молекули рідини суттєво більша, ніж для молекули на плоскій поверхні (у кожної молекули на увігнутій поверхні більша кількість сусідніх молекул рідини), тому тиск насиченої пари над увігнутим меніском p менше ps, і процес конденсації пари в порах починається при 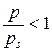 .
.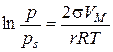 ,
,

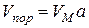 .
.
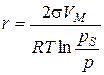 .
.



