
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Математическое выражение первого закона термодинамики в условиях закрытой системы.
Энергия закрытой термодинамической системы оценивается понятием внутренняя энергия, а работа - работа расширения. Исходя из этого базисная формулировка первого закона примет вид: Теплота, сообщаемая извне закрытой термодинамической системе, расходуется на изменение внутренней энергии системы и совершение работы расширения: Q = (U2 - U1) + L = D U + L, [Дж], (2.4) или, применительно к одному килограмму рабочего тела: q = D u + l , [Дж/кг]. (2.4а) Уравнения 2.4 и 2.4а являются математическим выражением первого закона термодинамики в условиях закрытой т.д.с. в алгебраической форме. Однако для проведения термодинамических исследований более удобной является их дифференциальная форма. Это связано с тем, что на изменение параметров состояния рабочего тела в термодинамическом процессе оказывает влияние не абсолютное значение энергии, а ее изменение. Наиболее простой вид дифференциальное уравнение первого закона термодинамики принимает в подвижной системе координат, когда начало отсчета, в каждый момент времени, совпадает с началом элементарного процесса (рис. 2.5).
Пусть 1 килограмм рабочего тела совершает некоторый конечный термодинамический процесс 1-2. На элементарном участке этого процесса (a-b) к рабочему телу подводится бесконечно малое количество теплоты d q, и при этом температура и удельный объем рабочего тела изменяются на бесконечно малые величины dT и dv. В результате бесконечно малого увеличения удельного объема dv рабочее тело совершает бесконечно малую работу d l по преодолению внешних сил. Если, при этом, в рабочем теле не происходит других явлений и отсутствует видимое движение, то уравнение первого закона термодинамики для элементарного процесса запишется в виде В уравнении 2.5 удельная внутренняя энергия и удельный объем являются параметрами состояния и следовательно величины du и dv будут полными дифференциалами. В отличии от них теплота является функцией термодинамического процесса и поэтому величина d q не является полным дифференциалом. Данный факт доказывается методом от противного.
Предположим, что d q=dq. Т. к. внутренняя энергия является параметром состояния рабочего тела она может быть представлена как функция от любых двух других параметров состояния, например u=f(p,v). Исходя из принятых предположений, расписав du как полный дифференциал, математическое выражение первого закона термодинамики для закрытой т.д.с. запишется в виде:
Если величина q является полным дифференциалом, то ее смешанные производные должны быть равны между собой: Полученное неравенство показывает, что d q ¹ dq, а следовательно величина d q не является полным дифференциалом. Входящая в уравнение 2.5 величина удельной внутренней энергии в отсутствии химических изменений является функцией термического состояния. В соответствии с этим она может быть выражена через два любых других параметра состояния. Если принять за основу функциональную зависимость u=f(v,T),тос учетом того, что изменение удельной внутренней энергии в процессе является полным дифференциалом можно записать что На основании опытов Гей-Люссака и Джоуля установлено, что для идеального газа внутренняя энергия является однозначной функцией от температуры и независит от удельного объема и давления, т.е. (¶ u / ¶ v)T=0 и (¶ u / ¶ p)T=0, значит уравнение 2.6 примет вид: Для выяснения физического смысла производной (¶ u / ¶ T)v=0 рассмотрим частный случай термодинамического процесса, протекающего при v=const Þ dv=0. В данном процессе закрытая термодинамическая система не совершает никакой работы: d l= pdv=0. Математическое выражение первого закона термодинамики для закрытой системы (2.5) с учетом (2.6а) запишется в виде:
Получили, что в соответствии с определением теплоемкости, рассматриваемая частная производная есть ничто иное как удельная массовая изохорная теплоемкость газа cv [Дж/кг×К].
Таким образом, изменение удельной внутренней энергии идеального газа в элементарном термодинамическом процессе, протекающем в закрытой т.д.с., определится как: Для любого конечного термодинамического процесса, при условии, что cv=const, конечное изменение удельной внутренней энергии рабочего тела определится интегрированием уравнения 2.7:
а в случае если cv = f(T) как: где Таким образом, дифференциальная форма уравнения 1ого за-кона термодинамики для идеального газа, находящегося в условия закрытой термодинамической системы, примет вид: Уравнение 2.8, являясь канонической формой выражения первого закона термодинамики, в инженерной практике имеет весьма ограниченное применение. Это связано с тем, что схема закрытой термодинамической системы отвечает лишь условиям работы эпизодически действующих тепловых машин (автоклавы, воздушные буферы). Основная же часть тепловых машин, непрерывно производящих работу за счет теплоты, работают в условиях открытой т.д.с., постоянно обмениваясь энергией и рабочим телом с окружающей средой.
|
|||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 185; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.66.13 (0.008 с.) |

 или, в соответствии с 2.2, оно примет вид:
или, в соответствии с 2.2, оно примет вид: . (2.5)
. (2.5) .
. .
.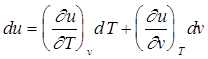 (2.6)
(2.6)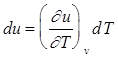 . (2.6(а))
. (2.6(а)) .
. . (2.7)
. (2.7)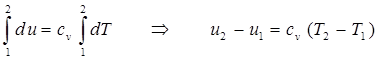 , [Дж/кг], (2.7(а))
, [Дж/кг], (2.7(а)) , [Дж/кг], (2.7(б))
, [Дж/кг], (2.7(б))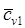 и
и  - средние удельные теплоемкости газа для интервалов температур от 0 °С до t1 и от 0 °С до t2. Если в термодинамическом процессе участвует произвольная масса газа, то изменение полной внутренней энергии рабочего тела определится как: D U = D u × G [Дж].
- средние удельные теплоемкости газа для интервалов температур от 0 °С до t1 и от 0 °С до t2. Если в термодинамическом процессе участвует произвольная масса газа, то изменение полной внутренней энергии рабочего тела определится как: D U = D u × G [Дж]. . (2.8)
. (2.8)


