
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Функции состояния и функции процесса. Энтропия. T-S диаграмма. ⇐ ПредыдущаяСтр 6 из 6
Величины, входящие в уравнения первого закона термодинамики подразделяются на две группы: - функции состояния - p, v, T, u, i; - функции процесса - q, l, l’. Изменение величин, являющихся функцией состояния рабочего тела, в конечном термодинамическом процессе 1-2 (рис. 2.10), определяется лишь начальным и конечным состоянием тела и не зависит от характера протекающего процесса.
В круговом процессе (цикле) 1-a-2-c-1 изменение этих величин будет равно нулю: Величины работы расширения l, располагаемой работы l’ и теплоты q являются функциями процесса. Из рисунка 2.10 видно, что работа расширения, совершаемая рабочим телом при переходе из состояния 1 в состояние 2 по процессам a и b, не одинакова. Для кругового процесса 1-a-2-c-1 работа определится как l = la - lc. Математическими характеристиками для работы расширения, как функции процесса, будут выражения:
Все сказанное в равной мере относится и к понятиям “располагаемая работа” и “теплота”. Соответственно величины d l, d l’ и d q не являются полными дифференциалами. Согласно первого закона термодинамики для любого элементарном процессе, протекающем в закрытой термодинамической системе с участием идеального газа, будет справедливо уравнение В 2.18 правая часть является полным дифференциалом, следовательно и левая часть тоже будет являться полным дифференциалом некоторой функции состояния, которую обозначим ds = d q / T: Для конечного процесса после интегрирования 2.19 примет вид: Величина S [Дж/К] называется энтропией. По своему физическому смыслу она представляет собой функцию состояния и для 1 кг массы рабочего тела (s [Дж/кг ×К] - удельная энтропия) является параметром состояния:
Если для вывода уравнения изменения энтропии идеального газа в термодинамическом процессе воспользоваться математическим выражением первого закона термодинамики для открытой системы, то можно получить: Абсолютное значение энтропии в технической термодинамике не определяется (интерес представляет разность энтропий в процессе). Однако можно условно принять за ноль (s=0) энтропию газа при p0=1 бар и t0=0 °С. В этом случае энтропия любого состояния газа может быть определена как: где p - абсолютное давление в барах. Энтропия произвольной массы рабочего тела определится как: S = G × s [Дж/К].
В практике термодинамических исследований, наряду с p-v диаграммой, для изображения термодинамических процессов широко применяется T-s диаграмма рис. 2.11 Пусть имеется график обратимого процесса в p-v координатах (рис. 2.11а). Этот же процесс можно изобразить и в T-s диаграмме, Для чего температуру в характерных точках цикла можно определить из уравнения состояния идеального газа, энтропию в начальной точке процесса принять произвольно или по уравнению 2.21, а изменение энтропии в конечном процессе 1-2 определить из уравнения 2.19а или 2.20б (рис. 2.11(б)). Изменение энтропии рабочего тела в элементарном термодинамическом процессе a- b определится как: ds= d q / T Þ d q=T ds. Как видно из рисунка 2.11б, величине d q будет соответствовать площадь фигуры a-b-ds, а это значит, что на T-s диаграмме можно изображать графически теплоту процесса. Из-за этого свойства T-s диаграмму называют тепловой. Количество тепла, подведенное к газу в конечном процессе 1-2 определится интегрированием Важнейшим свойством T-s диаграммы является то, что на ней можно графически, в заданном масштабе, изобразить количество теплоты, подводимое или отводимое от рабочего тела в данном процессе.
Знак теплоты, изображаемой на T-s диаграмме будет соответствовать знаку изменения энтропии ( * при подводе теплоты к системе ds > 0 Þ d q > 0, * при отводе теплоты от системы ds < 0 Þ d q < 0. Энтропия в обратимых термодинамических процессах зависит от теплообмена системы с окружающей средой. Изменение энтропии показывает направление теплообмена. Если теплообмен отсутствует, то s=const.
|
||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-27; просмотров: 111; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.31.209 (0.008 с.) |

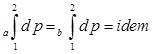 ,
, 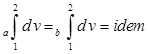 ,
, ,
,  ,
,  .
. . Соответственно dp, dv, dT, du и di будут являться полными дифференциалами.
. Соответственно dp, dv, dT, du и di будут являться полными дифференциалами. ,
,  .
.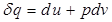 , d q не является полным дифференциалом. Однако, для данного случая, нетрудно подобрать интегрирующий множитель, обращающий уравнение в выражение полного дифференциала. Домножим обе части 2.8 на 1/Т:
, d q не является полным дифференциалом. Однако, для данного случая, нетрудно подобрать интегрирующий множитель, обращающий уравнение в выражение полного дифференциала. Домножим обе части 2.8 на 1/Т: . (2.18)
. (2.18) . (2.19)
. (2.19) . (2.19(а))
. (2.19(а))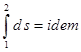 ,
,  . Т.к. понятие энтропии получено математически, то другого физического смысла оно не имеет.
. Т.к. понятие энтропии получено математически, то другого физического смысла оно не имеет.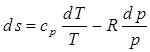 , (2.20)
, (2.20) . (2.20(а))
. (2.20(а))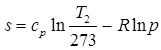 [Дж/кг×К], (2.21)
[Дж/кг×К], (2.21)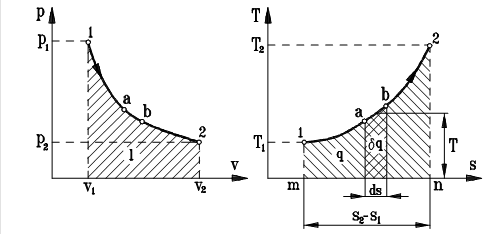
 , на рисунке 2.11б ей будет соответствует площадь фигуры m-1-2-n.
, на рисунке 2.11б ей будет соответствует площадь фигуры m-1-2-n. , причем всегда T > 0):
, причем всегда T > 0):


