
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Термодинамические процессы идеальных газов
Программа Классификация термодинамических процессов, изменения состояния рабочих тел. Общая схема исследования термодинамических процессов. Аналитическое исследование изохорного, изобарного, изотермического, адиабатного и политропного процесса, их графическое изображение в p-v и Т-s диаграммах. Обратимые и необратимые термодинамические процессы. Методические указания. Материал этой темы является основой для усвоения и понимания особенностей работы различных тепловых машин. В термодинамике переход рабочего тела из одного равновесного состояния в другое совершается в обратимом термодинамическом процессе. Определенная последовательность термодинамических процессов, в результате которой рабочее тело возвращается в первоначальное состояние, называется термодинамическим циклом. Общая схема исследования термодинамических процессов состоит из нескольких этапов: 1 - запись (вывод) уравнение процесса; 2 - характер изменения основных параметров рабочего тела; 3 - анализ особенностей энергообмена в процессе; 4 - определение теплоты и работы (q, l); 5 - определение изменения объема рабочего тела;6 - определение изменения калорических параметров рабочего тела (D u, D i, D s);7 - графическое изображение процесса в рабочей и тепловой диаграммах. Для успешного усвоения этой темы необходимо помнить об общих и особых моментах в аналитических зависимостях показателей процессов. Некоторые из них: • уравнение процесса записывается через основные или калорические параметры состояния рабочего тела; • изменения основных параметров определяется уравнением с неизменным состоянием для всякой (начальной и конечной) точки процесса; • исходя из уравнения первого закона термодинамики dq = du + dl, возможны четыре особенности энергообмена - когда есть все три составляющие этого закона, и когда любое из трех равна нулю; • удельная теплота процесса q определяется через произведение теплоемкости рабочего тела в этом процессе на разницу (изменение) температуры qi = ci ´ D T; • изменения удельной внутренней энергии и удельной энтальпии рабочего тела не зависят от характера процесса и в любом процессе определяется по формулам:
D u = cv ´ D T, D i = cp ´ D T; • изменениеудельной энтропии рабочего тела в процессе (за исключением изотермического процесса) определяется, как произведение теплоемкости в этом процессе на разницу натуральных логарифмов (логарифм отношения) конечной и начальной температуры: D s = ci ´ ln (T2 /T1).
Контрольные вопросы по тематике смыслового модуля 1. 1. Основные понятия и положения технической термодинамики. 2. Физический смысл газовой постоянной. 3. Что является газовой постоянной смеси? Уравнения состояния для газовой смеси. 4. Теплоемкость идеальных газов. Ее виды. Основные формулы. 5. Определение средней и истинной теплоемкости идеального газа. 6. Определение теплоемкости газовой смеси. 7. Первый закон термодинамики. Его формулировки и математическое выражение. 8. Энтальпия и энтропия, как функции состояния тела. 9. Работа и теплота. Аналитическое выражение и графическое изображение. 10. Общая схема исследования термодинамических процессов. 11. Исследование изотермического процесса идеального газа. Изображение процесса в р-v и T-s - координатах. 12. Исследование изобарного процесса идеального газа. Изображение процесса в р-v и T-s - координатах. 13. Исследование изохорного процесса идеального газа. Изображение процесса в р-v и T-s - координатах. 14. Исследование адиабатного процесса идеального газа. Изображение процесса в р-v и T-s - координатах. 15. Исследование политропного процесса идеального газа. Изображение процесса в р-v и T-s - координатах. Определение показателя политропы и теплоемкости политропного процесса.
РЕАЛЬНЫЕ ГАЗЫ Реальные газы (пары) Программа. Свойства реальных газов. Уравнение состояния реального газа. Фазовые равновесия и фазовые переходы. Основные понятия и определения для пара. Фазовые диаграммы состояния. Водяной пар. Таблицы термодинамических свойств воды и водяного пара на линии насыщения. p-v, T-s и i-s диаграммы водяного пара. Построение термодинамических процессов водяного пара в p-v, T-s и i-s диаграммах. Расчет параметров процессов водяного пара с помощью термодинамических таблиц и i-s диаграммы. Методические указания. Приступая к изучению этой темы, студент должен четко представлять себе, что расчетные формулы, которые применялись для идеального газа, здесь, как правило, являются недействительными. Для паров нет простого и точного уравнения состояния. Уравнение Ван-дер-Ваальса для реального газа учитывает внутреннее давление газа и силы взаимодействия между молекулами и имеет следующий вид:
Влажный воздух Программа. Определение понятия «влажный воздух». Основные характеристики влажного воздуха: абсолютная, максимальная относительная влажность воздуха, влагосодержание, температура точки росы. i-d диаграмма влажного воздуха. Построение основных процессов влажного воздуха (нагрев, охлаждение, сушка влажных материалов в воздухе, смешивание, изменение параметров воздуха в помещении) и их расчет с помощью i-d диаграммы. Методические указания. Основные трудности усвоения этой темы заключаются в умении строить в i-d диаграмме и рассчитывать процессы влажного воздуха. Если знать уравнение процесса, этот вопрос не вызывает затруднений. Так, нагрев происходит при d-const, при охлаждении влагосодержание остается постоянным до достижения точки росы, после этого дальнейшее охлаждение воздуха приводит к уменьшению влагосодержания (выпадение росы) в результате конденсации водяного пара. Сушка влажных материалов происходит при i-const с понижением температуры воздуха и увеличением влагосодержания. При смешивании воздуха с различными параметрами изменения характеристик влажного воздуха обратно пропорционально смешанным массам (D d1 / D d2 = D t1 / D t2 = = D i1/ D i2=m2/m1). График процесса – прямая, соединяющая две точки, соответствующие параметрам воздуха до смешивания. Точка, характеризующая параметры воздуха после смешивания, также находится на этой прямой и делит ее на отрезки в соответствии с массами m1 и m2. Причем любой параметр смеси может быть найден из соотношения: Ac=(m1A1+m2A2)/(m1+m2). Процесс изменения параметров воздуха в помещении происходит при постоянном тепловлажностным отношении D i/ D d= e =const. Диаграмма влажного воздуха приведена в приложении В.
|
|||||||||
|
Последнее изменение этой страницы: 2021-04-13; просмотров: 108; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.9.141 (0.006 с.) |


 Смысловой модуль 2.
Смысловой модуль 2.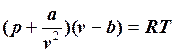 .Уравнение М.П.Вукаловича и И.И.Новикова имеет более сложный характер, так как учитывает силовые ассоциации и диссоциации молекул:
.Уравнение М.П.Вукаловича и И.И.Новикова имеет более сложный характер, так как учитывает силовые ассоциации и диссоциации молекул: 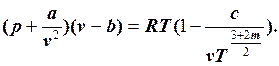 Поэтому процессы реальных газов рассчитываются с помощью диаграмм. Для водяного пара наиболее широкое применение нашла i-s диаграмма, для рабочих тел холодильных машин – T-s и lg p- h диаграммы.
Поэтому процессы реальных газов рассчитываются с помощью диаграмм. Для водяного пара наиболее широкое применение нашла i-s диаграмма, для рабочих тел холодильных машин – T-s и lg p- h диаграммы.


