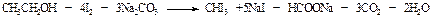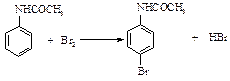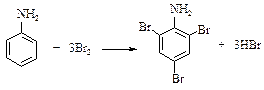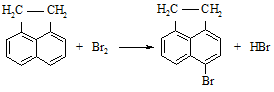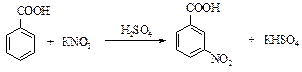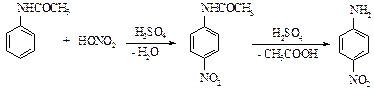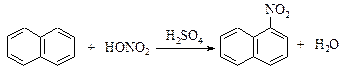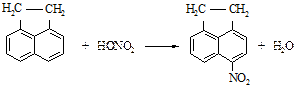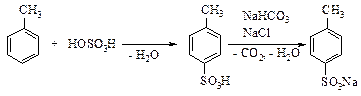Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Правила предосторожности при работах с бромом⇐ ПредыдущаяСтр 17 из 17
Работы с бромом производятся только в вытяжном шкафу. Перед наливанием брома в капельную воронку надо убедиться, что кран капельной воронки не подтекает. Можно применять воронку только с предварительно смазанным, хорошо притертым краном. При попадании паров брома в дыхательные пути рекомендуется понюхать нашатырного спирта, после чего выйти на свежий воздух. При попадании брома на кожу пострадавшее место следует немедленно обмыть большим количеством воды из-под крана и обработать раствором гипосульфита натрия. Во всех случаях работы с бромом обязательно применять защитные очки. При переливании брома необходимо надевать резиновые перчатки, беречь глаза от паров брома. Бромэтан (бромистый этил)
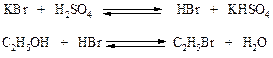
Реактивы: Спирт этиловый (95 %) 20 см3 Бромистый калий 30 г Серная кислота (конц.) 38 см3 Хлористый кальций
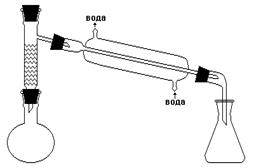
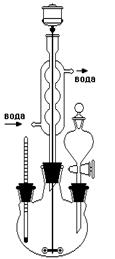
Рисунок 14 - Прибор для получения бромэтана В круглодонную колбу вливают спирт, добавляют 18 см3 воды и при охлаждении и постоянном перемешивании осторожно приливают 38 см3 концентрированной серной кислоты. (Защитные очки!). Смесь охлаждают до комнатной температуры и при перемешивании добавляют предварительно тонко измельченный бромистый калий. Колбу соединяют с дефлегматором и длинным водяным холодильником, к которому присоединен аллонж. Кончик аллонжа погружают в приемник с ледяной водой для уменьшения потерь бромистого этила вследствие испарения. Реакционную смесь нагревают на плитке до тех пор, пока в приемник не перестанут поступать маслянистые капли, опускающиеся на дно. При сильном вспенивании реакционной смеси на некоторое время прерывают нагревание. По окончании реакции при помощи делительной воронки отделяют бромистый этил от воды, помещают его в плоскодонную колбочку (50 см3) и для высушивания (удаления воды) добавляют прокаленного хлористого кальция в количестве 10-15 % от массы осушаемой смеси (колбочку закрыть пробкой и поместить в ледяную воду). Через 30-40 минут бромистый этил становится прозрачным. Его отделяют от осушителя и перегоняют на водяной бане в интервале температур 35-40 оС. Приемник помещают в ледяную воду. Полученный продукт содержит небольшие примеси этилового спирта и диэтилового эфира.
Выход около 10 г. Теоретические вопросы 1. Как сдвинуть равновесие в сторону образования бромистого этила? 2. Для чего в реакционную массу добавляют воду? 3. Для чего в работе используется дефлегматор? Вопросы по методике синтеза 1. Почему бромистый зтил собирают под слоем воды? 2. Какой холодильник (водяной, воздушный) используют в работе? 3. Меры предосторожности при работе с серной кислотой. Бромбутан (бромистый бутил)
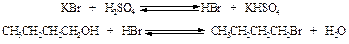
Реактивы: н -Бутиловый спирт 18 г Бромистый калий 19 г Серная кислота (конц.) 13 см3 Хлористый кальций
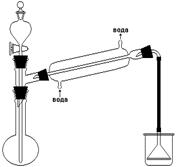
В реакции образования бромистого бутила берут избыток бромистого калия для более полного использования бутилового спирта. В колбу к реакционной смеси прибавляют воду с целью ослабить побочные реакции. В круглодонную колбу на 250 см3 всыпают тонко растертый бромистый калий, прибавляют 35 см3 воды, бутиловый спирт и бросают несколько кусочков фарфора. Присоединяют обратный холодильник, вставляют в его внутреннюю трубку воронку и через нее небольшими порциями (по 5-7 см3) приливают 25 см3 концентрированной серной кислоты, каждый раз хорошо перемешивая смесь покачиванием колбы. (Защитные очки!). Колбу нагревают до кипения и слабо кипятят до тех пор, пока верхний слой не перестанет уменьшаться. Затем, слегка охладив колбу, убирают обратный холодильник и колбу соединяют с нисходящим холодильником при помощи уголка. Усилив нагревание, быстро отгоняют бромистый бутил. Конец отгонки определяется по практически полному исчезновению верхнего слоя. Содержимое приемника переливают в делительную воронку, дают отстояться и сливают нижний слой в сухую коническую колбочку, добавляют хлористый кальций и оставляют на 15-20 минут для высушивания. Сухой продукт перегоняют, собирая фракцию, кипящую в пределах 98-103 оС. Выход около 20 г. Теоретические вопросы 1. Какие побочные продукты могут образоваться при получении бромистого бутила? 2. Каким образом удается предотвратить образование побочных продуктов?
Вопросы по методике синтеза 1. Для чего применяется обратный холодильник? 2. В каком слое находится бромистый бутил при промывании его водой? 3. Меры предосторожности при работе с серной кислотой. п -Броманизол
Реактивы: Анизол 16 г Бром 9 г Хлороформ, гидроксид натрия, хлористый кальций.
Рисунок 15 - Прибор для получения п -броманизола В круглодонную колбу емкостью 100 см3, снабженную форштоссом, капельной воронкой с возможно более длинной трубкой и обратным холодильником, помещают 6 г анизола. Колбу нагревают до слабого кипения анизола и постепенно приливают из капельной воронки 9 г брома с такой скоростью, чтобы после прибавления каждой порции бурая окраска брома, наблюдающаяся в парах, исчезала в течение нескольких минут. Выделяющийся бромистый водород поглощают водой. После добавления всего количества брома смесь нагревают еще в течение 15 мин, затем охлаждают и добавляют к ней 30 см3 хлороформа. Смесь переносят в делительную воронку, промывают разбавленным раствором гидроксида натрия, затем водой и сушат безводным хлористым кальцием (в количестве 10-15 % от массы продукта). Хлороформ отгоняют на водяной бане, а остаток перегоняют при 213-223 оС. Продукт содержит примесь о -броманизо-ла, так как оба изомера имеют близкие температуры кипения. Выход около 5 г. Теоретические вопросы 1. Механизм реакции галогенирования ароматических соединений. 2. Влияние метокси-группы на ориентацию галогена и реакционную способность. Вопросы по методике синтеза 1. Как определить окончание реакции бромирования? 2. Каким образом собирают бромистый водород, выделяющийся в реакции? 3. Правила техники безопасности при работе с бромом. Трийодметан (йодоформ)
Реактивы: Этанол 5 г Углекислый натрий (крист.) 10 г Йод 5 г
В круглодонную колбу к раствору 10 г кристаллической соды в 50 см3 воды прибавляют 5 г спирта. Колбу соединяют с обратным холодильником и нагревают на водяной бане до 70 оС. В нагретую смесь при энергичном перемешивании вносят небольшими порциями 5 г измельченного йода, растворяющегося с желто-бурой окраской, скоро исчезающей. После того как весь йод будет внесен в жидкость и она обесцветится, смеси дают остыть. Осадок, осевший на дне колбы, отфильтровывают и промывают водой. Сушат в темном месте при комнатной температуре. Йодоформ образует желтые пластинки с температурой плавления 119 оС. Выход около 1 г. Теоретические вопросы 1. Применение полигалогеналканов. 2. На какой из реагентов следует вести стехиометрический расчет и почему? Вопросы по методике синтеза 1. Как определить конец реакции? 2. Условия сушки и хранения иодоформа. П-Бромацетанилид
Реактивы: Ацетанилид 2,5 г Бром 1,3 см3 Этанол
Рисунок 16 - Прибор для получения п -бромацетанилида и триброманилина В круглодонную колбу емкостью 500 см3 насыпают тонко измельченный ацетанилид и наливают 250 см3 воды. Колбу нагревают в горячей водяной бане до полного растворения ацетанилида. Затем колбу охлаждают в бане с холодной водой, закрывают пробкой с двумя отверстиями, в которые вставлены две стеклянные изогнутые под углом трубки. Короткая трубка, кончающаяся у самой пробки, соединяется с водоструйным насосом (более длинная трубка, доходящая до дна колбы, соединяется резиновой трубкой со склянкой Дрекселя). В склянку Дрекселя наливают 1,3 см3 брома и 5 см3 воды. Когда прибор собран, включают водоструйный насос и просасывают струю воздуха с такой скоростью, чтобы вызвать энергичное перемешивание раствора. Когда смесь в колбе окрасится в желтый неисчезающий цвет, процесс бромирования заканчивается. Прибор отсоединяют от водоструйного насоса, а осадок отсасывают на воронке Бюхнера, промывают водой на фильтре, высушивают и для очистки перекристаллизовывают из этилового спирта.
Выход около 3 г. Теоретические вопросы 1. Механизм реакции галогенирования ароматических соединений. 2. Влияние амидной группы на ориентацию галогена и реакционную способность. Вопросы по методике синтеза 1. Как определить окончание реакции бромирования? 2. Правила техники безопасности при работе с бромом. Триброманилин
Реактивы: Анилин 1,9 г Бром 9,6 г Соляная кислота (2м) Собирают прибор (рис. 16). В круглодонную колбу на 100 см3 помещают анилин и добавляют такое количество соляной кислоты, чтобы весь анилин растворился. К раствору добавляют 10 см3 воды. В склянку Дрекселя наливают бром и воду. Вода должна полностью закрывать бром. Прибор присоединяют к водоструйному насосу и, просасывая воздух через колбу, насыщают анилин парами брома. Колбу время от времени встряхивают. Просасывание воздуха ведут до тех пор, пока жидкость в колбе не окрасится в желто-оранжевый цвет. Продукт реакции отфильтровывают на воронке Бюхнера. Осадок промывают на фильтре, высушивают и перекристаллизовывают из этилового спирта. Выход около 9 г. Бромаценафтен
Реактивы: Аценафтен 5 г Бром 5,7 г Этиловый спирт (75 %) 25 см3
Рисунок 17 – Прибор для получения 5-бромацетонафтена В колбу, снабженную двурогим форштоссом, загружают аценафтен и раствор этилового спирта. В наклонный конец форштосса вставляют холодильник, соединенный с водоструйным насосом, в вертикальный - трубку, доходящую до дна колбы и соединенную со склянкой Дрекселя. В склянку Дрекселя наливают бром и добавляют такое количество воды, чтобы она закрывала бром слоем в один сантиметр. Содержимое колбы нагревают до кипения, затем включают водоструйный насос и пропускают в течение одного часа пары брома через реакционную массу. Колбу охлаждают, осадок отсасывают на воронке Бюхнера, промывают водой и высушивают. Для очистки продукта перекристаллизовывают его из спирта.
Выход около 5 г. Теоретические вопросы 1. К какому классу соединений относится аценафтен? 2. Механизм реакции галогенирования ароматических соединений. Вопросы по методике синтеза 1. Для чего в работе используется склянка Дрекселя? 2. Правила техники безопасности при работе с бромом. Синтезы нитросоединений Нитрометан
Реактивы: Монохлоруксусная кислота 37,8 г Нитрит натрия 28 г Гидроксид натрия, хлористый кальций ОСТОРОЖНО! Хлоруксусная кислота сильно разъедает кожу. Нитрометан является сильным ядом для нервной системы. В стакане на 250 см3 приготавливают смесь хлоруксусной кислоты с 40 г толченого льда и нейтрализуют прибавлением по каплям при перемешивании примерно 30 см3 40 % раствора гидроксида натрия до щелочной реакции (по индикаторной бумаге). При нейтрализации температура смеси не должна подниматься выше 20 оС. Полученную смесь переливают в перегонную колбу объемом 500 см3, содержащую раствор нитрита натрия в 36 см3 воды. Колбу соединяют с нисходящим водяным холодильником и закрывают пробкой с термометром, шарик которого погружен в жидкость. Смесь медленно нагревают до начала выделения пузырьков углекислого газа. Когда выделение газа станет достаточно интенсивным, отставляют плитку и после замедления бурной реакции смесь продолжают нагревать, постепенно доводя температуру до 110 оС. При этом отгоняется смесь, содержащая не менее 10 см3 нитрометана и около 30 см3 воды. После этого отделяют в делительной воронке нитрометан от воды, сушат его 2 г безводного хлористого кальция и перегоняют, собирая фракцию в пределах 95-102 оС. Выход около 8 г. Теоретические вопросы 1. По какому механизму происходит образование нитрометана? 2. Что происходит при нагревании смеси до температуры 80 оС? Вопросы по методике синтеза 1. Почему нитрометан перегоняется вместе с водой? 2. Каковы токсические свойства хлоруксусной кислоты и нитрометана? 2,4,6-Тринитрофенол (пикриновая кислота)
Реактивы: Фенол 5 г Азотная кислота (d=1,36 г/см3) 14 см3 Серная кислота (конц.) 14 см3 Этанол Навеску фенола брать в чашке специальным шпателем, смешивать обязательно под тягой в очках! В круглодонной колбе на 500 см3 на водяной бане в течение получаса нагревают смесь фенола и серной кислоты, пока не получится прозрачный раствор. После охлаждения в колбу добавляют 40 см3 воды, раствор следует хорошо охладить. К полученному раствору при охлаждении и хорошем перемешивании постепенно прикапывают 8 см3 азотной кислоты. При этом раствор окрашивается в темно-красный цвет, температура поднимается, выделяются бурые окислы азота. После прекращения бурной реакции прибавляют по каплям остальные 6 см3 азотной кислоты и смесь постепенно нагревают на водяной бане. Нагревание надо начинать на холодной бане, затем довести ее до кипения и кипятить в течение двух часов. После охлаждения смеси пикриновая кислота кристаллизуется. Смесь разбавляют 100 см3 холодной воды и отфильтровывают кристаллы на воронке Бюхнера, промывают небольшим количеством холодной воды (около 20 см3) и кристаллизуют из 50 % раствора этанола в воде.
Выход около 5 г. Теоретические вопросы 1. Зачем фенол предварительно сульфируется? 2. Объясните влияние гидроксильной группы на реакцию. Вопросы по методике синтеза 1. Почему прибавление азотной кислоты нужно проводить постепенно? 2. Токсические свойства фенола и меры предосторожности при работе с ним. М-Нитробензойная кислота
Реактивы: Бензойная кислота 10 г Азотнокислый калий 20 г Серная кислота (конц.) 25 см3 В стакане на 200 см3 нагревают до 70 оС серную кислоту (под тягой в очках) и при перемешивании всыпают порошкообразную смесь бензойной кислоты и азотнокислого калия, следя за тем, чтобы температура реакции не поднималась выше 80 оС. Затем стакан нагревают, продолжая помешивание при температуре 90 оС, пока м -нитробензойная кислота не всплывет на поверхность в виде маслянистого слоя. После охлаждения м -нитробензойная кислота образует вверху застывший слой. Нижний слой серной кислоты аккуратно сливают. Добавляют 50 см3 воды и нагревают при перемешивании почти до кипения, затем охлаждают раствор. Осадок отфильтровывают, промывают горячей водой и сушат. Выход около 7 г. Теоретические вопросы 1. Механизм реакции нитрования бензойной кислоты, влияние карбоксильной группы на эту реакцию. 2. Каким образом в настоящей работе образуется нитрующая смесь? Вопросы по методике синтеза 1. Как можно очистить м-нитробензойную кислоту? 2. Меры предосторожности при работе с серной кислотой. П-Нитроацетанилид
Реактивы: Ацетанилид 7 г Азотная кислота (d=1,36 г/см3) 4 см3 Серная кислота (конц.) Этанол, едкий натр Тонко растертый сухой ацетанилид вносят в стакан на 200 см3, добавляют 15 см3 серной кислоты и перемешивают, пока не получится прозрачный раствор. Температура при этом не должна превышать 25 оС. Раствор охлаждают во льду или снеге до 0 оС и постепенно при хорошем перемешивании прибавляют охлажденную смесь 8 см3 азотной и 3 см3 серной кислот (кислоты смешивают под тягой в очках). Температура при этом не должна подниматься выше 2-5 оС. После того как прибавлена вся кислота, перемешивают в течение часа и оставляют до следующего занятия. Затем прибавляют 30 г льда и отфильтровывают осадок п -нитроацетанилида на воронке Бюхнера. Затем, не снимая осадок с фильтра, промывают его водой, тщательно отсасывают досуха и высушивают на воздухе. Для очистки кристаллизуют из 50 % раствора этилового спирта в воде, получая желтоватые призмы (температура плавления 207 оС). Выход около 8 г. Теоретические вопросы 1. Механизм реакции нитрования ароматических соединений. 2. Почему нельзя непосредственно нитровать анилин? Вопросы по методике синтеза 1. Каким образом следует прибавлять нитрующую смесь? 2. Меры предосторожности при работе с серной и азотной кислотами. Нитронафталин
Реактивы: Нафталин 12,8 г Азотная кислота (d=1,36 г/см3) 7,2 см3 Серная кислота (конц.) 13 см3 Этанол В фарфоровом стакане смешивают серную кислоту, 7 см3 воды и азотную кислоту и нагревают на водяной бане до 50 оС. К этой смеси постепенно прибавляют хорошо растертый в ступке нафталин. Реакцию проводят при перемешивании, поддерживая температуру 50 оС в течение часа, а затем в течение следующего часа - 60 оС. После завершения реакции фарфоровую чашку помещают в холодную водяную баню, где 1-нитронафталин затвердевает. Смесь кислот сливают, к осадку в чашке добавляют горячую воду и нагревают при перемешивании до плавления 1-нитронафталина, снова охлаждают чашку и сливают водный слой. Эту процедуру повторяют до тех пор, пока водный слой не перестанет показывать кислую реакцию. После этого 1-нитронафталин расплавляют и выливают при перемешивании в стакан на 250 см3 с холодной водой. Застывшие шарики 1-нитронафталина отфильтровывают на воронке Бюхнера, отжимают между листами фильтровальной бумаги и подсушивают на воздухе. Продукт для очистки можно перекристаллизовать из метанола или этанола. Выход до перекристаллизации около 15 г. Теоретические вопросы 1. Механизм реакции нитрования нафталина. 2. Почему замещение происходит в a–положение нафталинового кольца? Вопросы по методике синтеза 1. Как можно очистить 1-нитронафталин? 2. Меры предосторожности при работе с серной и азотной кислотами. Нитроаценафтен
Реактивы: Аценафтен 10,2 г Азотная кислота (d=1,36 г/ см3) 4,2 см3 Уксусная кислота 20 см3
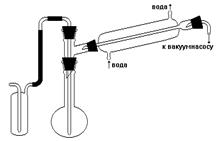
Рисунок 18 – Прибор для получения 5-нитроаценафтена Собирают прибор (рис. 18). В колбу, снабженную мешалкой, обратным холодильником, капельной воронкой и термометром, загружают аценафтен и уксусную кислоту и перемешивают содержимое в течение 20 мин. Прибор помещают в баню с ледяной водой и, после охлаждения смеси до 10-15 оС, при энергичном перемешивании из капельной воронки прикапывают азотную кислоту в течение полутора часов при температуре 10-15 оС. Выпавший осадок отсасывают на воронке Бюхнера, промывают на фильтре водой и сушат. Выход около 12 г. Теоретические вопросы 1. К какому классу соединений относится аценафтен? 2. Механизм реакции нитрования ароматических соединений. Вопросы по методике синтеза 1. Для чего в работе используется уксусная кислота? 2. Правила техники безопасности при работе с азотной и уксусной кислотами.
Синтезы сульфосоединений П-Толуолсульфокислый натрий
Реактивы: Толуол 16 см3 Серная кислота (конц.) 10 см3 Гидрокарбонат натрия 8 г Хлористый натрий 20 г В длинногорлую круглодонную колбу на 200 см3 с обратным водяным холодильником наливают толуол, серную кислоту и бросают 2-3 кусочка фарфора. Смесь нагревают до слабого кипения толуола и, перемешивая время от времени покачиванием или вращением колбы, кипятят в течение 2-3 часов. Теплую смесь переливают под тягой в стакан на 250 см3 со 100 см3 воды, колбу споласкивают 20 см3 воды и добавляют к содержимому стакана. Кислоту частично нейтрализуют, добавляя малыми порциями при перемешивании 8 г гидрокарбоната натрия. Затем добавляют 20 г хлористого натрия, 20 см3 воды и доводят смесь до кипения. Горячий раствор фильтруют через воронку с ватой, охлаждают холодной водой, а затем снегом или льдом. Выпавший осадок отфильтровывают на воронке Бюхнера, промывают там же 20 см3 холодного насыщенного раствора хлористого натрия и высушивают. Выход около 9 г (с примесью хлористого натрия). Теоретические вопросы 1. Механизм реакции сульфирования толуола. 2. На чем основано выпадение продукта в осадок из водного раствора? Вопросы по методике синтеза 1. Почему необходимо перемешивание реакционной смеси в процессе реакции? 2. Почему бикарбонат прибавляют малыми порциями? Библиографический список 1. Захаров, Л.Н. Начала техники лабораторных работ. - Л.: Химия, 1981. - 192 с. 2. Воскресенский, П.И. Техника лабораторных работ. - Л.: Химия, 1973. - 360 с. 3. Храмкина, М.Н. Практикум по органическому синтезу. - Л.: Химия, 1977. - 320 с. 4. Шарп, Дж. Практикум по органическому химии / Дж. Шарп, И. Госни, А. Роули - Л.: Мир, 1993. - 240 с. 5. Лабораторные работы по органической химии / Под ред. С.Ф. Гинзбурга, А.А. Петрова. - М.: Высшая школа, 1967. - 295 с. 6. Агрономов, А.Е. Лабораторные работы в органическом практикуме / А.Е. Агрономов, Ю.С. Шабаров. - М.: Изд-во Моск. ун-та, 1971. - 230 с. 7. Прянишников, Н.Д. Практикум по органической химии. - М.-Л.: Госхимиздат, 1950. - 245 с. 6. Методические указания к лабораторному практикуму по органической химии для студентов химико-технологического факультета. Ч. 1 / Р.М. Басаев, И.С. Колпащикова, Е.Р. Кофанов, Т.А. Обухова; Яросл. гос. техн. ун-т. - Ярославль, 1999. - 32 с. 7. Методические указания к лабораторному практикуму по органической химии Ч. 2 / Р.М. Басаев, И.С. Колпащикова, Е.Р. Кофанов, Т.А. Обухова; Яросл. гос. техн. ун-т. - Ярославль, 1997. - 23 с. 8. Диазотирование и азосочетание. Методические указания к лабораторному практикуму по органической химии для студентов III курса общетехнического факультета / Н.К. Дорогова, Н.Н. Басаева; Яросл. политехн. ин-т. - Ярославль, 1979. - 26 с. 9. Конденсация. Методические указания к лабораторному практикуму по органической химии для студентов III курса технологических специальностей. Ч. 9 / И.С. Колпащикова, к.а. Мачтина; Яросл. политехн. ин-т. - Ярославль, 1983. - 28 с. О Г Л А В Л Е Н И Е Методы работы при проведении органического синтеза
____________________________________________________ Редактор Л.С. Кокина
План 2017
Подписано в печать 2.03.2017. Формат 60х84 1/16. Бумага белая. Печать ризограф. Усл. печ. л. 5,35. Уч.-изд. л. 5,33. Тираж 75. Заказ
Ярославский государственный технический университет 150023, Ярославль, Московский пр., 88
Издательский дом ЯГТУ 150000, Ярославль, ул. Советская, 14а
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 351; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.220.212.186 (0.113 с.) |