Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Всасывание продуктов распада белков. Судьба всосавшихся амк.
Продукты гидролиза белков всасываются в пищеварительном тракте в основном в виде свободных АМК. АМКы, подобно глюкозе, всасываются свободно с ионами Na+. Для лизина, цистеина и цистина, глицина и пролина, очевидно, существует более одной системы транспорта через стенку кишечника. Некоторые АМКы обладают способностью конкурентно тормозить всасывание других АМК, что свидетельствует о вероятном существовании общей переносящей системы или одного общего механизма. Так, в присутствии лизина тормозится всасывание аргинина, но не изменяется всасывание аланина, лейцина и глутамата. Существует два представления для активного транспорта энергия образуется за счет биохимических реакций (это так называемый направляемый метаболизмом транспорт) или за счет энергии переноса другого транспортируемого вещества, в частности энергии движения ионов Na+ (или других ионов) в клетку. Данные о специфичности транспорта АМК через биомембраны клеток были получены при анализе наследственных дефектов всасывания АМК в кишечнике и почках. Классическим примером является цистинурия, при которой резко повышено содержание в моче цистина, аргинина, орнитина и лизина. Это повышение обусловлено наследственным нарушением механизма почечной реабсорбции. Цистин относительно нерастворим в воде, поэтому он легко выпадает в осадок в мочеточнике или мочевом пузыре, в результате чего образуются цистиновые камни и нежелательные последствия (закупорка мочевыводящего тракта, развитие инфекции и др.). Аналогичное нарушение всасывания АМК, в частности триптофана, наблюдается при болезни Хартнупа. Доказано всасывание небольших пептидов. Так, в опытах in vitro и in vivo свободный глицин всасывался значительно медленнее, чем дипептид глицилглицин или даже трипептид, образованный из трех остатков глицина. Тем не менее во всех этих случаях после введения олигопептидов с пищей в портальной крови обнаруживали свободные АМКы; это свидетельствует о том, что олигопептиды подвергаются гидролизу после всасывания. В отдельных случаях отмечают всасывание больших пептидов. Напр, некоторые растительные токсины, в частности абрин и рицин, а также токсины ботулизма, холеры и дифтерии всасываются непосредственно в кровь. Дифтерийный токсин (мол. масса 63000), наиболее изученный из токсинов, состоит из двух функциональных полипептидов: связывающегося со специфическим рецептором на поверхности чувствительной клетки и другого – проникающего внутрь клетки и оказывающего эффект, который чаще всего сводится к торможению внутриклеточного синтеза белка. Транспорт этих двух полипептидов или целого токсина через двойной липидный слой биомембран до настоящего времени считается уникальным и загадочным процессом. Ряд вопросов, однако, до сих пор остается нерешенным. Это, в частности, вопросы о количестве всасывающихся небольших пептидов и месте их гидролиза (на клеточной поверхности или внутриклеточно), а также основная проблема: выяснение молекулярных механизмов работы транспортных систем.
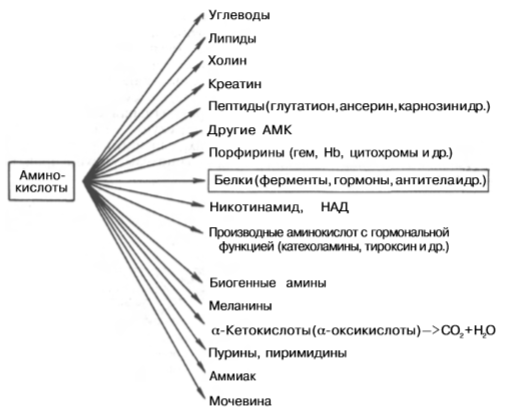
Приведенная ниже схема дает представление о многообразных путях использования АМК после всасывания в кишечнике. Поступив через воротную вену в печень, они прежде всего подвергаются ряду превращений, хотя значительная часть АМК разносится кровью по всему организму и используется для физиологических целей. В печени АМКы участвуют не только в синтезе собственных белков и белков плазмы крови, но также в синтезе специфических азотсодержащих соединений: пуриновых и пиримидиновых нуклеотидов, креатина, мочевой кислоты, НАД и др.
Печень, кроме того, обеспечивает сбалансированный пул свободных АМК организма путем синтеза заменимых АМК и перераспределения азота в результате реакций трансаминирования.
Как видно из схемы, всосавшиеся АМКы в первую очередь используются в качестве строительного материала для синтеза специфических тканевых белков, ферментов, гормонов и других биологически активных соединений. Некоторое количество АМК подвергается распаду с образованием конечных продуктов белкового обмена (СО2, Н2О и NH3) и освобождением энергии. Подсчитано, что в организме взрослого человека, находящегося на полноценной диете, образуется примерно 1200 кДж в сутки за счет окисления около 70 г АМК (помимо пищевых, также эндогенных АМК, образующихся при гидролизе тканевых белков). Это количество составляет около 10% от суточной потребности организма человека в энергии. Количество АМК, подвергающихся распаду, зависит как от характера питания, так и от физиологического состояния организма. Напр, даже при полном голодании или частичном белковом голодании с мочой постоянно выделяется небольшое количество азотистых веществ, что свидетельствует о непрерывности процессов распада белков тела. АМКы, как и белки, не накапливаются и не откладываются в тканях (наподобие жиров и гликогена), и у взрослого человека при нормальной обеспеченности пищевым белком поддерживается довольно постоянная концентрация АМК в крови (см. главу 16).
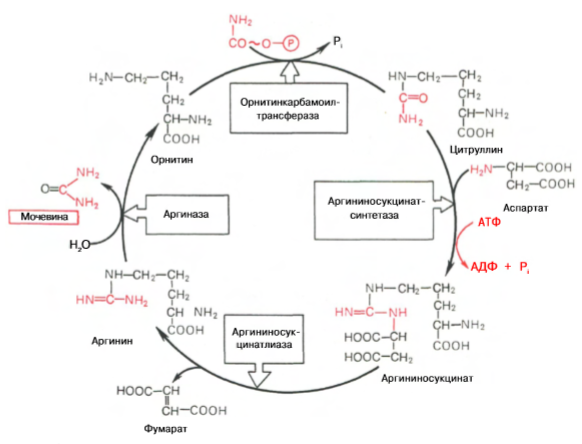
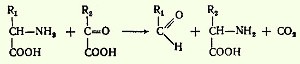
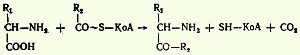
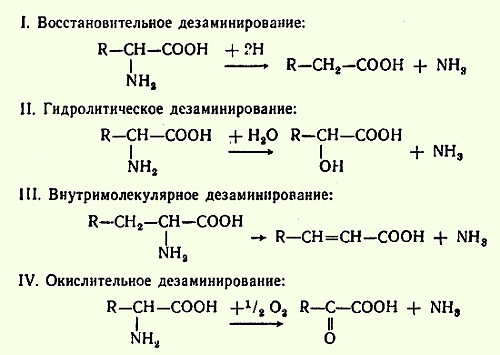
Дезаминирование. Биологическое значение. Примеры. Доказано существование четырех типов дезаминирования АМК (отщепление аминогруппы). Выделены соответствующие ферментные системы, катализирующие эти реакции, и идентифицированы продукты распада. Во всех случаях NH2-группа АМКы освобождается в виде аммиака: Помимо аммиака, продуктами дезаминирования явл жирные кислоты, оксикислоты и кетокислоты. Большая часть безазотистых остатков АМК превращается в пируват либо непосредственно (Ала, Сер), либо в результате более сложного пути, превращаясь вначале в один из метаболитов ЦТК. Затем в реакциях цитратного цикла происходит образование оксалоацетата, который превращается в фосфоенолпируват. Из фосфоенолпирувата под действием пируваткиназы образуется пируват. Пируват подвергается окислительному декарбоксилированию и превращается в ацетил-КоА, который окисляется в ЦТК до СО2 и Н2О с выделением энергии. Такой путь проходят преимущественно АМКы пищи 74.Обезвреживание аммиака в организме. Орнитиновый цикл образования мочевины. В организме человека подвергается распаду около 70 г АМК в сутки; при этом в результате дезаминирования, трансаминирования и окисления биогенных аминов освобождается большое количество аммиака, являющегося высокотоксичным соединением. Поэтому концентрация аммиака в организме должна сохраняться на низком уровне. Уровень аммиака в норме в крови не превышает 1-2 мг/л. Одним из путей связывания и обезвреживания аммиака в организме, в частности в мозге, сетчатке, почках, печени и мышцах, является биосинтез глутамина и аспарагина. Основным механизмом обезвреживания аммиака в организме является биосинтез мочевины. Последняя выводится с мочой в качестве главного конечного продукта белкового, соответственно АМКного, обмена. На долю мочевины приходится до 80-85% всего азота мочи. Кребс полагал, что каталитическую роль орнитина можно было бы объяснить, если бы существовал некий механизм для регенерации аргинина из орнитина, согласно уравнению: Орнитин + СO2 + 2NH3 --> Аргинин + 2H2O Ниже приведена, кроме того, суммарная реакция синтеза мочевины без учета промежуточных продуктов: СО2 + NH3 + 3АТФ + 2Н20 + Аспартат --> Мочевина + 2 АДФ + + АМФ + Фумарат + 2 Фн + ФФн ΔG° = - 40 кДж
Декарбоксилирование. Биогенные амины. Биологическое значение. Примеры.
Процесс отщепления карбоксильной группы АМК в виде СO2 получил название декарбоксилирования. Несмотря на ограниченный круг субстратов (АМК и их производных), подвергающихся декарбоксилированию в животных тканях, образующиеся продукты реакции (названные биогенными аминами) обладают сильным фармакологическим действием на множество физиологических функций человека и животных. Общая схема процесса декарбоксилирования АМК может быть представлена в следующем виде: R-CH(NH2)-COOH --> R-CH2-NH2 + CO2 В живых организмах открыто четыре типа декарбоксилирования АМК. 1.α-Декарбоксилирование.Продуктами реакции явл СО2 и биогенные амины:R-CH(NH2)-COOH --> R-CH2-NH2 + CO2 2.ω-Декарбоксилированне, характерное для микроорганизмов. Напр, из аспарагиновой кислоты этим путем образуется α-аланин:НООС-СН2-CH(NH2)-СООН --> СН3-CH(NH2)-СООН + СО2 3.Декарбоксилирование, связанное с реакцией трансаминирования:
4.Декарбоксилирование, связанное с реакцией конденсации двух молекул:
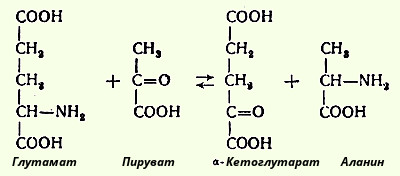
Превращения АМК, вызванные деятельностью микроорганизмов кишечника, получили общее название гниения белков в кишечнике. Так, в процессе постепенного и глубокого распада серосодержащих АМК (цистина, цистеина и метионина) в кишечнике образуются сероводород (H2S) и метилмеркаптан (CH3SH). ДиАМКы, в частности орнитин и лизин, подвергаются процессу декарбоксилирования с образованием протеиногенных аминов. Из ароматических АМК фенилаланина, тирозина и триптофана при аналогичном бактериальном декарбоксилировании образуются соответствующие биогенные амины: фенилэтиламин, парагидроксифенилэтиламин (или триптамин) и индолилэтиламин (триптамин). После всасывания эти продукты через воротную вену попадают в печень, где они подвергаются обезвреживанию В печени АМКы используются не только для синтеза собственных белков и белков плазмы крови, но также для синтеза ряда специфических азотсодержащих соединений Накопление биогенных аминов может отрицательно сказаться на физиологическом статусе и вызывать ряд серьезных нарушений в организме. Однако органы и ткани как и целостный организм располагают специальными механизмами обезвреживания биогенных аминов. Трансаминирование. Биологическое значение. Примеры. Диагностическое значение определения активности трансаминаз в организме. Под трансаминированием подразумевают реакции межмолекулярного переноса аминогруппы (NH2) от АМКы на α-кетокислоту без промежуточного образования аммиака. При добавлении к гомогенату мышц глутаминовой и пировиноградной кислот образуются α-кетоглутаровая к-та и аланин без промежуточного образования аммиака; добавление аланина и α-кетоглутаровой кислоты соответственно приводило к образованию пировиноградной и глутаминовой кислот:
Для клинических целей наибольшее значение имеют две трансаминазы - аспартатаминотрансфераза и аланинаминотрансфераза, катализирующие соответственно следующие обратимые реакции: Аспартат + α-Кетоглутарат <--> ЩУК + Глутамат В сыворотке крови здоровых людей активность этих трансаминаз в среднем составляет 15 и 20 единиц по сравнению с десятками и сотнями тысяч единиц в других органах и тканях. Поэтому органические поражения при острых и хронических заболеваниях, сопровождающихся деструкцией клеток, приводят к выходу трансаминаз из очага поражения в кровь. При инфаркте миокарда уровень аспартатаминотрансферазы сыворотки крови уже через 3-5 ч после наступления инфаркта резко повышается, достигая 300-500 единиц
|
||||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 239; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.143.239 (0.015 с.) |
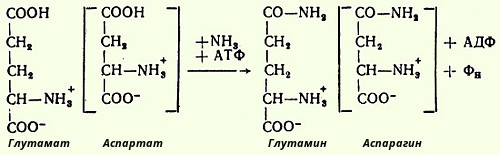 Основным механизмом обезвреживания аммиака в организме является биосинтез мочевины. Последняя выводится с мочой в качестве главного конечного продукта белкового, соответственно АМКного, обмена. На долю мочевины приходится до 80-85% всего азота мочи.
Основным механизмом обезвреживания аммиака в организме является биосинтез мочевины. Последняя выводится с мочой в качестве главного конечного продукта белкового, соответственно АМКного, обмена. На долю мочевины приходится до 80-85% всего азота мочи.