Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Типы гибридизации атома углерода
В возбужденном состоянии атом углерода четырехвалентен и мо- жет присоединить четыре одновалентных атома, таких, например, как атомы водорода. Действительно, простейшим органическим соединени- ем является метан CH4. Логично предположить, что в молекуле метана три связи С–Н об- разованы перекрыванием p -орбиталей атома углерода и s -орбиталей трех атомов водорода, а четвертая связь – перекрыванием s -орбиталей атомов углерода и водорода. В таком случае одна из связей должна отличаться от остальных по длине и энергии. Эксперименталь- ные данные говорят о том, что в метане все четыре связи С–Н одинако- вы. Для объяснения этого факта американский химик Лаймус Полинг предложил теорию гибридизации атомных орбиталей. Согласно этой теории атом углерода не имеет «чистых» s - и p -орбиталей. При образо- вании химических связей эти орбитали атома углерода усредняются по форме и энергии, превращаясь в четыре новые равноценные орбитали. Гибридизация – это взаимодействие атомных орбиталей с близкими значениями энергии, сопровождающееся образованием новых «гибридных» орбиталей, одинаковых по форме и энергии. Гибридизация – процесс, требующий затрат энергии, но эти затра- ты с избытком компенсируются за счет энергии, выделяющейся при об- разовании большего числа ковалентных связей. Образующиеся «гиб- ридные» орбитали имеют форму ассимметричной гантели и отличаются от исходных орбиталей атома углерода. Для атома углерода возможно три типа гибридизации: · sр 3-гибридизация; · sр 2-гибридизация; · sр -гибридизация.
Гибридизация sр 3-типа sр 3-Гибридизация – это комбинация одной s- и трёх p- орбиталей внеш- него энергетического уровня и образование четырех новых sр 3 - орбиталей, имеющих форму объёмной восьмёрки с неравноценными сферами:
исходные орбитали sр 3-гибридные орбитали

2 s Каждая sр 3 - орбиталь имеет точку с нулевой электронной плотно- стью – узел. У всех четырех орбиталей узлы совпадают – в этом месте находится ядро атома. Электронные орбитали испытывают взаимное отталкивание и отклоняются друг от друга в пространстве на макси- мально возможное расстояние. Их оси направлены к вершинам тетраэд- ра, в центре которого находится атом углерода, а угол между осями ра- вен 109°28'.
Гибридизация sр 2-типа sр2 -Гибридизация – это комбинация одной s- и двух p- орбиталей внешнего энергетического уровня и образование трех новых sр 2 - орбиталей, имеющих форму объёмной восьмёрки с неравноценными сферами:
исходные орбитали sр 2-орбитали p -орбиталь
 
2 s 2 p Гибридные орбитали лежат в одной плоскости, угол между их ося- ми орбиталей равен 120°. Одна p- орбиталь остается негибридизованной, и её ось перпендикулярна плоскости, в которой расположены оси трех гибридных орбиталей.
Гибридизация sр -типа sр -Гибридизация – при этом взаимодействуют, выравниваясь по форме и энергии только две орбитали атома углерода: одна s - и одна p-. Образуются две новых sр- орбитали:
Гибридные орбитали лежат на одной прямой, угол между их осями равен 180°, оси двух негибридизованных р -орбиталей взаимно перпен- дикулярны и перпендикулярны осям sp -орбиталей. Гибридные орбитали атома углерода способны участвовать в обра- зовании только s-связей, незатронутые гибридизацией р -орбитали обра- зуют только p-связи. Именно этой особенностью определяется про- странственное строение молекул органических веществ.
Ковалентные s- и p-связи s- и p-Связи различают по симметрии перекрывания орбиталей. Если линия, соединяющая ядра связанных атомов, проходит через область перекрывания орбиталей, связь называется s - связью; если об- ласть перекрывания лежит в стороне от этой линии – p-связью.
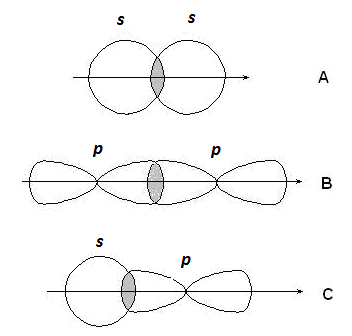
s-Связи образуются при перекрывании s-s орбиталей атомов (А), р-p орбиталей (В), s-p орбиталей (С) и гибридных орбиталей (рис. 2.2).
Рис. 2.2. Образование s-связей
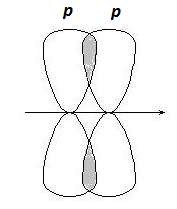
p-Связи образуются при боковом перекрывании р-р орбиталей, оси которых параллельны друг другу (рис. 2.3).
Рис. 2.3. Образование p-связей
В результате такого перекрывания образуются две области повы- шенной электронной плотности. Ни одна из этих областей не лежит на линии, соединяющей центры ядер двух атомов. p-Связь менее прочная, чем s-связь, ее электроны легче подверже- ны внешнему воздействию. В соединениях с кратными связями только одна из связей является s-cвязью, образованная перекрыванием s-, р- или гибридных орбиталей, а остальные – p-связями, образованными пе- рекрыванием негибридизованных р- орбиталей атомов, например, двой- ная связь, образованная гибридными орбиталями (s-связь) и не участ- вующими в гибридизации р -орбиталями (p-связь).
Рис. 2.4. Образование двойной связи
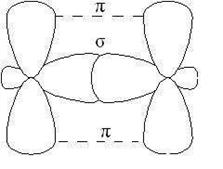
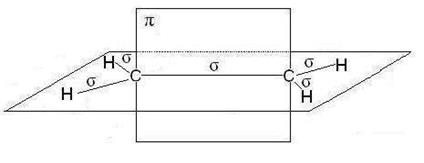
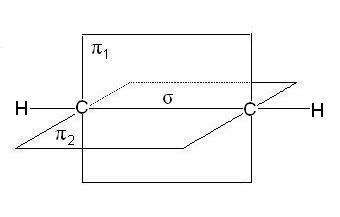
В молекулах алкенов, в частности этилена, орбитали атомов угле- рода при двойной связи находятся в состоянии sp 2-гибридизации, все С–Н и С–С связи лежат в одной плоскости, перекрывание негибридных р -орбиталей атомов углерода происходит в плоскости, перпендикуляр- ной плоскости s-связей (рис. 2.4). Иногда эту плоскость называют плос- костью p- связи.
Рис. 2.4. Расположение s- и p-связей в молекуле этилена
В случае тройной связи, например в молекулах алкинов, орбитали атомов углерода при тройной связи имеют sp -гибридизацию. Две p-связи, образованные перекрыванием негибридных р -орбиталей ато- мов углерода (по две от каждого из атомов), лежат в двух взаимно пер- пендикулярных плоскостях (рис. 2.5).
Рис. 2.5. Расположение s- и двух p-связей в молекуле ацетилена
В табл. 2.1 приведены основные характеристики связей между ато- мами углерода.
Таблица 2.1 Основные характеристики связей между атомами углерода
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 717; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.214.215 (0.014 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
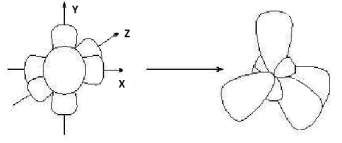

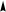
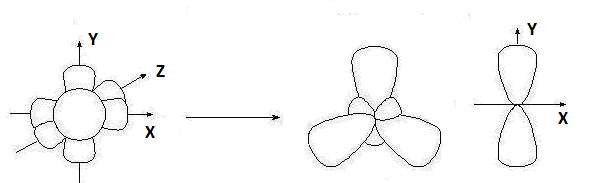

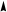
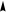
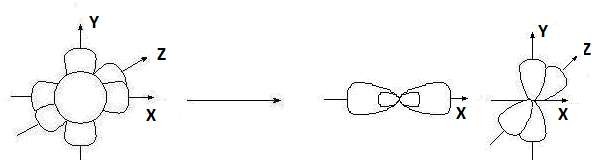
 исходные орбитали sр- орбитали p -орбитали sp
исходные орбитали sр- орбитали p -орбитали sp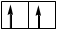

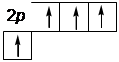 2 s 2 p
2 s 2 p