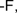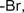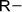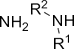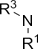Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Теоретические основы органической химииСодержание книги Поиск на нашем сайте
Теоретические основы органической химии Классификация органических соединений Органические соединения классифицируют по двум основным при- знакам: строению углеродного скелета и функциональным группам. По строению углеродного скелета различают ациклические, карбо- циклические и гетероциклические соединения. Ациклические соединения содержат открытую цепь атомов угле- рода. Карбоциклические соединения содержат замкнутую цепь угле- родных атомов и подразделяются на алициклические и ароматические. К алициклическим относятся все карбоциклические соединения, кроме ароматических. Ароматические соединения содержат циклогексатрие- новый фрагмент (бензольное ядро). Гетероциклические соединения содержат циклы, включающие, наряду с атомами углерода, один или несколько гетероатомов. По природе функциональных групп органические соединения де- лят на классы (табл. 1.1). Таблица 1.1 Основные классы органических соединений
Функциональная группа | Класс соединений | Общая формула | |||||
| Отсутствует | Углеводороды |

| ||||||
| Галоген-
| Галогенпроизводные | R-Hal Ar-Hal | ||||||
| Гидроксильная
| Спирты и фенолы |


| ||||||
| Алкоксильная
| Простые эфиры |

| ||||||
| Амино- | Амины |
| ||||||
| Нитро- | Нитросоединения |
  
| ||||||
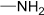
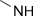



 Окончание табл. 1.1
Окончание табл. 1.1
| Функциональная группа | Класс соединений | Общая формула |
Карбонильная
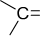 
| Альдегиды и кетоны |
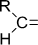 
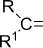 
|
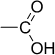
| Карбоксильная | Карбоновые кислоты |
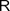 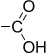
|
Алкоксикарбонильная
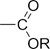
| Сложные эфиры |
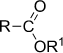
|
| Карбоксамидная | Амиды карбоновых кислот |
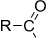

|
Тиольная

| Тиолы |
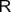  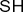
|
Сульфо-

| Сульфокислоты |
  
|
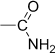 Номенклатура органических соединений (Самостоятельно)
Номенклатура органических соединений (Самостоятельно)
С 5 H 10
циклоалканы
| С2H6O | С3H6O | ||
| спирт | простой эфир | альдегид | кетон |
| CH3-CH2-OH | CH3-O-CH3 | CH3-CH2-C O H | CH3-C-CH 3
 O
O
|
| этанол | диметиловый эфир | пропаналь | пропанон |
| С6Н6 | С3H6O2 | ||
| арен | непредельный углеводород | кислота | сложный эфир |

|
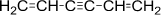
| СН3СН2СООН | СН3СООСН3 |
| бензол | 1,5-гексадиен-3-ин | пропионовая кислота | метилацетат |
|
|
Изомеры, которые отличаются друг от друга пространственным расположением атомов в молекуле, называют пространственными изомерами.
Пространственная изомерия (или стереоизомерия) включает типы:
· оптическая (зеркальная) изомерия. Оптическая изомерия – один из видов пространственной изомерии. Оптическая изомерия ха- рактерна для органических соединений, в молекулах которых атом уг- лерода соединен с четырьмя различными заместителями. Такой атом углерода называется асимметрическим, или хиральным. Примером со- единения с одним асимметрическим атомом углерода является молоч- ная, или 2-гидроксипропановая, кислота:
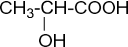 |
Такую молекулу никакими вращениями в пространстве невозмож- но совместить с ее зеркальным отображением:
 |  | ||
 | |||
 | |||

Для изображения таких молекул на плоскости используют проек- ции Фишера:
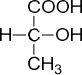 |  |


 |  |
Две молекулы, являющиеся зеркальными отображениями друг дру- га, называются энантиомерами, или оптическими изомерами. Энан- тиомеры отличаются друг от друга только по оптической активности, все остальные физические свойства их одинаковы. Оптическая актив- ность – это способность асимметрических молекул вращать плоскопо- ляризованный свет. Один из пары энантиомеров вращает плоскость по- ляризации света вправо на определенный угол, второй – влево на такой же угол. Химические свойства энантиомеров также одинаковы, за ис- ключением реакций с другими оптически активными соединениями;
· геометрическая (цис-, транс-изомерия). Геометрическая изо- мерия характерна прежде всего для алкенов. Свободное вращение во- круг двойной связи невозможно. Изомер, у которого два больших за- местителя находятся по одну сторону от плоскости двойной связи, на- зывается цис -изомером, если по разные стороны – транс -изомером:
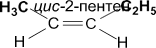 | 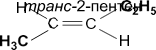 | ||
· конформационная изомерия. Конформационные изомеры отно- сятся к динамическим изомерам, т.е. в обычных условиях они легко превращаются друг в друга и выделить их в индивидуальном виде невозможно. Молекулу циклогексана можно представить в виде кон- формаций:
|
|
 |  | ||
Типы химических связей
Химическая связь – это силы взаимодействия между атомами или группами атомов, приводящие к образованию молекул, ионов и т.д. По своей природе химическая связь – это электростатические силы. Главную роль при образовании химической связи между атомами игра- ют их валентные электроны, т.е. электроны внешнего уровня, наименее прочно связанные с ядром. При переходе от атомного состояния к моле- кулярному происходит выделение энергии, связанное с заполнением электронами свободных орбиталей внешнего электронного уровня до определенного устойчивого состояния. Существуют следующие виды химических связей:
Ионная связь
Химическая связь, основанная на электростатическом притяжении ионов, называется ионной связью.
Такая связь возникает при большой разнице в электроотрицатель- ностях связываемых атомов, когда менее электроотрицательный атом почти полностью отдает свои валентные электроны и превращается в катион, а другой, более электроотрицательный атом, эти электроны присоединяет и становится анионом.
Например: хлорид натрия NaCl
 |  |







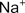





 |
Атом натрия имеет 1 электрон на внешнем уровне, а атом хлора – 7 внешних электронов. Они превращаются в ионы Na+ и Cl– с завершен- ными внешними электронными оболочками (по 8 электронов), между которыми возникает электростатическое притяжение, т.е. ионная связь.
Иoннaя связь не имеет пространственной направленности, т.к. каж- дый ион связан с некоторым числом противоионов, сила действия кото- рых зависит от расстояния (закон Кулона). Поэтому соединения с ион- ной связью не имеют молекулярного строения и представляют собой твердые вещества, образующие ионные кристаллические решетки с вы- сокими температурами плавления и кипения; они высокополярны, часто
солеобразны, в водных растворах электропроводны. Соединений с чис- то ионными связями практически не существует.
В органических соединениях ионные связи встречаются доволь- но редко, т.к. атом углерода не склонен терять или приобретать электроны с образованием ионов.
Ковалентная связь
Ковалентная связь – это химическая связь, осуществляемая за счет обобществления электронных пар. Теорию ковалентной связи предложил в 1916 г. американский ученый Гилберт Льюис. За счет ко- валентной связи образуется большинство молекул, молекулярных ио- нов, свободных радикалов и атомных кристаллических решеток. Обяза- тельным условием образования ковалентной связи является перекрыва- ние атомных орбиталей (АО), на которых расположены валентные элек- троны. В простейшем случае перекрывание двух АО приводит к образо- ванию двух молекулярных орбиталей (МО): связывающей МО и анти- связывающей (разрыхляющей) МО. Обобществленные электроны рас- полагаются на более низкой по энергии связывающей МО (рис. 2.1).
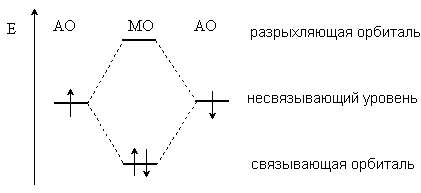 |
Рис. 2.1. Образование двух МО при перекрывании двух АО
Характерные свойства ковалентной связи – направленность, насы- щаемость, полярность, поляризуемость – определяют химические и фи- зические свойства органических соединений.
Направленность связи обусловливает молекулярное строение ор- ганических веществ и геометрическую форму их молекул. Углы между двумя связями называют валентными.
|
|
Насыщаемость – способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ог- раничено числом его внешних атомных орбиталей.
Полярность связи обусловлена неравномерным распределением электронной плотности вследствие различий в электроотрицательностях атомов. По этому признаку ковалентные связи подразделяются на непо- лярные и полярные.
Поляризуемость связи выражается в смещении электронов связи под влиянием внешнего электрического поля, в том числе и другой реа- гирующей частицы. Поляризуемость определяется подвижностью элек- тронов. Электроны тем подвижнее, чем дальше они находятся от ядер.
Полярность и поляризуемость ковалентных связей определяет ре- акционную способность молекул по отношению к полярным реагентам.
Водородная связь
Водородные связи могут образовываться между атомом водорода, связанным с атомом электроотрицательного элемента, и электроотрица- тельным элементом, имеющим свободную пару электронов (О, F, N). Водородная связь обусловлена электростатическим притяжением, кото- рому способствуют малые размеры атома водорода, и отчасти донорно- акцепторным взаимодействием. Обозначается водородная связь несколькими точками:
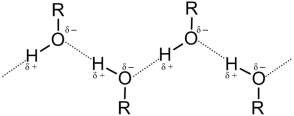
Водородная связь может быть межмолекулярной и внутримолеку- лярной.
Водородная связь гораздо более слабая, чем ионная или ковалент- ная, но более сильная, чем межмолекулярное взаимодействие. Водород- ные связи обусловливают некоторые физические свойства веществ (на- пример, высокие температуры кипения). Особенно распространены во- дородные связи в молекулах белков, нуклеиновых кислот и других био- логически важных соединений, обеспечивая им определенную про- странственную структуру (организацию).
Ковалентные s- и p-связи
s- и p-Связи различают по симметрии перекрывания орбиталей.
Если линия, соединяющая ядра связанных атомов, проходит через область перекрывания орбиталей, связь называется s - связью; если об- ласть перекрывания лежит в стороне от этой линии – p-связью.
s-Связи образуются при перекрывании s-s орбиталей атомов (А),
р-p орбиталей (В), s-p орбиталей (С) и гибридных орбиталей (рис. 2.2).
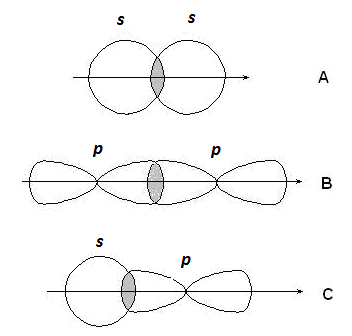 |
Рис. 2.2. Образование s-связей
p-Связи образуются при боковом перекрывании р-р орбиталей, оси которых параллельны друг другу (рис. 2.3).
|
|
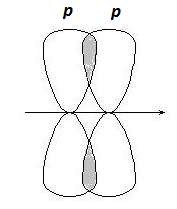
Рис. 2.3. Образование p-связей
В результате такого перекрывания образуются две области повы- шенной электронной плотности. Ни одна из этих областей не лежит на линии, соединяющей центры ядер двух атомов.
p-Связь менее прочная, чем s-связь, ее электроны легче подверже- ны внешнему воздействию. В соединениях с кратными связями только одна из связей является s-cвязью, образованная перекрыванием s-, р- или гибридных орбиталей, а остальные – p-связями, образованными пе- рекрыванием негибридизованных р- орбиталей атомов, например, двой- ная связь, образованная гибридными орбиталями (s-связь) и не участ- вующими в гибридизации р -орбиталями (p-связь).
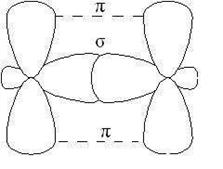 |
Рис. 2.4. Образование двойной связи
В молекулах алкенов, в частности этилена, орбитали атомов угле- рода при двойной связи находятся в состоянии sp 2-гибридизации, все С–Н и С–С связи лежат в одной плоскости, перекрывание негибридных р -орбиталей атомов углерода происходит в плоскости, перпендикуляр- ной плоскости s-связей (рис. 2.4). Иногда эту плоскость называют плос- костью p- связи.
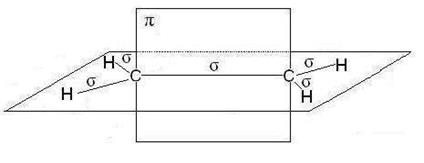
Рис. 2.4. Расположение s- и p-связей в молекуле этилена
В случае тройной связи, например в молекулах алкинов, орбитали атомов углерода при тройной связи имеют sp -гибридизацию. Две
p-связи, образованные перекрыванием негибридных р -орбиталей ато- мов углерода (по две от каждого из атомов), лежат в двух взаимно пер- пендикулярных плоскостях (рис. 2.5).
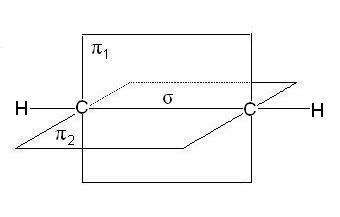 |
Рис. 2.5. Расположение s- и двух p-связей в молекуле ацетилена
В табл. 2.1 приведены основные характеристики связей между ато- мами углерода.
Таблица 2.1 Основные характеристики связей между атомами углерода
| Связь | Тип гибридизации | Длина (нм) | Энергия (кДж/моль) |
| C–C | sp 3 | 0,154 | 347 |
| C=C | sp 2 | 0,134 | 606 |
| C≡C | sp | 0,120 | 828 |
Теоретические основы органической химии
|
| Поделиться: |