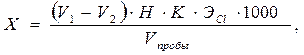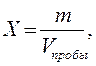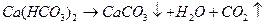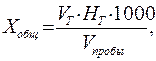Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
О пределение активного хлора в питьевой и сточной водахСодержание книги
Поиск на нашем сайте
Сущность метода. Активный хлор как более сильный окислитель вытесняет йод из раствора иодида калия. Выделенный йод титруют раствором тиосульфата натрия. В кислой среде реакции протекают количественно. Мешающие влияния. Определению хлора в питьевых и поверхностных водах с небольшим содержанием органических веществ не препятствуют нитриты, марганец и железо, если титруют с добавлением раствора разбавленной уксусной кислоты. В присутствии большого количества органических веществ метод не дает правильных результатов. Реактивы и оборудование Уксусная кислота ч.д.а., ледяная. Иодид калия, ч.д.а. Тиосульфат натрия, раствор с концентрацией 0,01 моль-экв/дм3. Крахмал, 0,5%-ный раствор. Бюретки, мерные пробирки Конические колбы Ход определения. При предполагаемом содержании «активного хлора» менее 1 мг/дм3 берут 1 дм3 пробы, при содержании его от 1 до 10 мг/дм3 – 500 см3 и т.д. (расход тиосульфата натрия на титрование не должен превышать 20 см3). Прибавляют к пробе 5 см3 уксусной кислоты и около 1 г твердого иодида калия. Титрование проводят на белом фоне 0,01 н. раствором тиосульфата натрия до получения светло-желтой окраски. Затем добавляют 1 см3 раствора крахмала и продолжают титрование до исчезновения синего окрашивания. Нельзя титровать при прямом солнечном свете, так как прямые солнечные лучи катализируют окисление тиосульфата кислородом воздуха. Таким же способом находят расход реактива на холостое определение с дистиллированной водой. Расчет. Содержание активного хлора (Х) в мг/дм3 вычисляют по формуле:
где V 1 – объем раствора тиосульфата натрия, израсходованного на титрование см3; V 2 – объем раствора тиосульфата натрия, израсходованного на титрование в холостом определении, см3; Н – концентрация раствора тиосульфата в моль-экв/дм3; K - поправочный коэффициент к концентрации титранта; V пробы – объем анализируемой пробы, см3; ЭС l – эквивалент хлора, г/моль-экв; 1000 – коэффициент для перехода от граммов к миллиграммам.
Определение железа в поверхностных и подземных водах
Железо постоянно присутствует в поверхностных и подземных водах; концентрация его в этих водах зависит от геологического строения и гидрологических условий бассейна. Высокое содержание железа в поверхностных водах указывает на загрязнение их шахтными или промышленными сточными водами, особенно водами предприятий металлургической, металлообрабатывающей, текстильной, лакокрасочной промышленности, с сельскохозяйственными стоками. При водоснабжении для питьевых и хозяйственных нужд высокое содержание железа в воде вызывает технические затруднения. Соединения железа не обладают выраженными токсичными свойствами, но ухудшают качество воды, придавая ей при концентрации более 0,3 мг/дм3 неприятный железистый привкус. После стирки в такой воде на тканях появляются ржавые пятна. Такие же пятна появляются на посуде, в раковине и в ваннах. Допустимая концентрация железа в питьевой воде составляет 0,3 мг/дм3. Содержание общего железа в воде определяют фотоколориметрически на основании реакции ионов Fe3+ с роданид-ионом, сульфосалициловой кислотой или о-фенантролином. Колориметрический анализ железа с сульфосалициловой кислотой основан на реакции сульфосалициловой кислоты с солями железа в щелочной среде с образованием желтого комплекса железа. Этим способом можно установить 0,1 – 10 мг/дм3 железа с точностью ± 0,1 мг/дм3. При реакции о-фенантролина с ионами железа (III) в области рН от 3 до 9 образуется красно-фиолетовое комплексное соединение. Прямое определение возможно при содержании железа 0,05 – 2.0 мг в 1 дм3 воды, при этом не требуется предварительного консервирования пробы.
Лабораторная работа № 11 Фотометрическое определение железа (III) с сульфосалициловой кислотой
Сущность метода. Железо (III) с сульфосалициловой (2-гидрокси-5-сульфобензойной) кислотой образует различные по составу комплексы в зависимости от кислотности раствора. В кислой среде в интервале рН 1,8-2,5 образуется комплексный катион моносульфосалицилата железа красно-фиолетового цвета (λмакс = 510 нм), при рН 4,0-8,0 доминирует комплексный анион дисульфосалицилата железа, а в интервале рН 8,0-11,5 образуется трисульфосалицилат железа желтого цвета ((λмакс = 416 нм). Сульфосалицилатные комплексы железа используют для дифференцированного определения железа (III) и железа (II) при их совместном присутствии. Железо (III) определяют в кислой среде в виде моносульфосалицилатного комплекса, а в щелочной среде в виде трисульфосалицилата определяют суммарное содержание железа (III) и железа (II). Реактивы и оборудование Фотоколориметр Раствор соли железа, содержащий 0,06 мг Fе3+ в 1 см3: навеску 0,5164 г х.ч. невыветренных квасцов NН4Fе(SO4)2*12Н2О растворяют в воде, подкисляют 10 см3 серной кислоты (1: 1) и доводят объем дистиллированной водой до 1 дм3. Сульфосалициловая кислота, 10% раствор. Аммиак, 10% раствор. Пипетки на 5 и 10 см3 Мерные колбы на 50 и 100 см3.
Ход определения. Построение градуировочного графика. Для приготовления стандартных растворов в мерные колбы вместимостью 100 см3 вносят 1, 2, 3, 4 и 5 см3 стандартного раствора соли железа с концентрацией 0,06 мг/см3, что соответствует 0,6; 1.2; 1,8; 2.4; 3,0 мкг железа, добавляют по 10 см3 раствора сульфосалициловой кислоты, по 10 см3 раствора аммиака, доводят дистиллированной водой до метки и перемешивают. Через 5 минут измеряют на фотоколориметре или спектрофотометре оптическую плотность приготовленных стандартных растворов при 416 нм (фиолетовый или синий светофильтр) относительно раствора холостой пробы, содержащей все добавляемые реактивы, кроме железа; кювета 2-3-5 см. Строят линейный градуировочный график в координатах оптическая плотность – масса железа, мкг. Анализ пробы. В мерную колбу на 100 см3 наливают 50 см3 исследуемой воды, добавляют 10 см3 10% раствора сульфосалициловой кислоты, перемешивают и затем добавляют 10 см3 10% раствора аммиака. Реакция среды должна быть слабощелочной, что необходимо проверить с помощью индикаторной бумаги. Доводят объем дистиллированной водой до метки, перемешивают и через 5 минут фотометрируют при 416 нм относительно раствора холостой пробы.
Расчет. Содержание общего железа (Х) в пробе в мг/дм3 вычисляют по формуле: где m – масса железа, найденная по градуировочному графику, мкг; V пробы – объем пробы воды, взятой для определения, см3.
Жесткость воды Жесткость воды – свойство воды, которое зависит от содержания в ней главным образом растворенных солей кальция и магния. Эти элементы в природных условиях попадают в воду вследствие воздействия диоксида углерода на карбонатные минералы или в результате биохимических процессов, происходящих в увлажненных слоях почвы. Суммарное содержание в воде растворенных солей кальция и магния называют общей жесткостью. Общая жесткость подразделяется на карбонатную, обусловленную концентрацией гидрокарбонатов кальция и магния, и некарбонатную, обусловленную присутствием кальциевых и магниевых солей сильных кислот. Поскольку при кипячении воды гидрокарбонаты переходят в карбонаты, которые выпадают в осадок, карбонатную
жесткость называют временной, или устранимой. Жесткость, остающаяся после кипячения, называется постоянной. Она обусловлена присутствием в воде солей кальция и магния других минеральных кислот (обычно сульфатов, хлоридов, нитратов). Жесткость выражают числом миллимоль-эквивалентов растворимых солей кальция и магния в 1 дм3 воды (ммоль-экв/дм3).По жесткости вода подразделяется следующим образом: очень мягкая (от 0 до 1,5 ммоль-экв/дм3), мягкая (от 1,5 до 4 ммоль-экв/дм3), средней жесткости (от 4 до 8 ммоль-экв/дм3), жесткая (от 8 до 12 ммоль-экв/дм3), очень жесткая (свыше 12 ммоль-экв/дм3). Карбонатная жесткость составляет до 70-80 % от общей жесткости. Жесткость воды подразделяют на кальциевую и магниевую. Обычно преобладает жесткость, обусловленная ионами кальция (до 70%), однако в отдельных случаях может преобладать и магниевая жесткость. Жесткость поверхностных вод подвержена заметным сезонным колебаниям, достигая обычно наибольшего значения в конце зимы и наименьшего – в период половодья. Умеренно жесткая вода не опасна в гигиеническом отношении, так как с водой в организм поступает 20 – 30 % кальция, необходимого для поддержания в норме обмена веществ в организме. Высокая жесткость ухудшает органолептические свойства воды, придавая ей горьковатый вкус и оказывая действие на органы пищеварения. Постоянное потребление очень жесткой воды способствует возникновению мочекаменной болезни. Большие количества солей в воде делают воду непригодной для хозяйственных нужд. В жесткой воде плохо развариваются овощи, перерасходуется мыло при стирке белья, выпадает осадок в водопроводных трубах и т.д. Вода, содержащая такие соли, совершенно непригодна для питания паровых котлов и для охлаждения технологического оборудования из-за образования плотных слоев накипи на внутренних стенках. Допустимая общая жесткость воды для хозяйственно-питьевого водоснабжения составляет не более 7 ммоль-экв/дм3. В некоторых случаях для конкретной системы водоснабжения допустимо увеличение общей жесткости воды до 10 ммоль-экв/дм3. Для рыбохозяйственных водоемов общая жесткость воды не должна превышать 4 ммоль-экв/дм3. Раздельное значение карбонатной и некарбонатной жесткости получают, используя значения общей жесткости и щелочности воды. Если щелочность воды обусловлена только присутствием в воде гидрокарбонат-ионов (щелочность по фенолфталеину равна нулю), карбонатная жесткость будет равна общей щелочности (см. лаб. работу № 8). Тогда некарбонатную жесткость определяют как разницу между общей жесткостью и карбонатной Ж некарб. = Ж общ. – Ж карб. Если же щелочность воды по фенолфталеину не равна нулю, то определяют только общую жесткость.
Лабораторная работа № 12 Определение общей жесткости воды Сущность метода. Общую жесткость определяют комплексонометрическим методом. В качестве комплексона используют натриевую соль этилендиаминтетрауксусной кислоты (трилон Б). Метод основан на том, что трилон Б образует при рН 10 прочные комплексные соединения сначала с ионами кальция, затем с ионами магния. Когда в анализируемую воду вводят индикатор – эриохром черный Т или хромоген, они образуют с ионами магния вишнево-красное комплексное соединение. При титровании трилон Б, соединяясь с ионами кальция, а затем с ионами магния, вытесняет индикаторы, которые в свободной форме имеют синюю окраску. Реактивы и оборудование Аммонийный буферный раствор: 20г хлорида аммония, 100 мл 25% раствора аммиака смешивают и доводят дистиллированной водой до 1 дм3. Трилон Б, раствор с концентрацией 0,05 моль-экв/дм3 (9,31 г трилона Б на 1 дм 3 ) Индикаторная смесь (эриохром черный Т или хромоген) Мерная колба или пипетка на 50 см3 Конические колбы для титрования, бюретка Ход определения. В колбу для титрования вносят пипеткой 100 см3 исследуемой воды, прибавляют 5 см3 аммонийного буферного раствора, 0,1-0,2 г сухой индикаторной смеси. Полученный раствор титруют при энергичном перемешивании раствором трилона Б (0,05 моль-экв/дм3) до перехода окраски от винно-красной через лиловую к чисто-голубой в точке эквивалентности. При добавлении избытка трилона Б окраска не меняется, поэтому в качестве эталона может служить оттитрованная ранее проба. Расчет. Общую жесткость (Хобщ) в ммоль-экв/дм3 находят по формуле:
где VТ – объем раствора титранта трилона Б, см3; HТ – концентрация раствора трилона Б, моль-экв/дм3; V пробы – объем пробы воды, см3; 1000 – коэффициент для перехода от моль-экв. к ммоль-экв.
Лабораторная работа № 13
|
|||||||||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 187; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.179.96 (0.008 с.) |