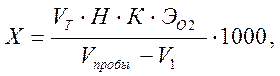Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение растворенного кислорода по ВинклеруСодержание книги
Поиск на нашем сайте Сущность метода. Метод основан на использовании растворенного кислорода, содержащегося в определенном объеме воды, для окисления гидроксида марганца (II) в оксид марганца (IV). К исследуемой воде добавляют хлорид или сульфат марганца и гидроксид натрия для того, чтобы получить легко окисляющийся осадок гидроксида марганца (II): MnSO4 + 2 NaOH = Mn(OH)2 + Na2SO4 Гидроксид марганца (II) окисляется кислородом в оксид марганца (IV): 2Mn(OH)2 + O2 = 2 MnO2↓ + 2Н2О Оксид марганца (IV) окисляет в кислой среде KJ с образованием свободного иода в количестве, эквивалентном кислороду. MnO2 + 2H2SO4 + 2 KI = MnSO4 + K2SO4 + I2 + 2 H2O Выделяющийся йод титруют раствором тиосульфата натрия в присутствии крахмала. I2 + 2 Na2S2O3 = 2 NaI + Na2S4O6 Предел обнаружения растворенного кислорода составляет 0,05 мг/дм3. Мешающие вещества. Определению мешают взвешенные органические вещества, нитриты, железо, а также другие окислители и восстановители. Их влияние устраняется в ходе анализа. Реактивы и оборудование Раствор сульфата или хлорида марганца (II):210 г хлорида марганца тетрагидрата MnCl2 × 4Н2O или 260 г сульфата марганца пентагидрата MnSO4 ×5H2О или 290 г сульфата марганца гептагидрата (MnSO4 × 7Н2О) растворяют в 300 - 350 см3 дистиллированной воды, фильтруют в мерную колбу вместимостью 500 см3, доливают дистиллированной водой до метки. Хранят в плотно закрытой склянке. Щелочной раствор иодида калия (или натрия):15 г иодида калия (KI) (или 18 г иодида натрия NaI×2Н2O) растворяют в 20 см3, 50 г гидроксида натрия (или 70 г гидроксида калия) - в 50 см3 дистиллированной воды. Полученные растворы смешивают в мерной колбе вместимостью 100 см3 и доводят объем дистиллированной водой до метки. При наличии мути раствор фильтруют. Хранят в склянке из темного стекла с плотной резиновой пробкой. Серная кислота, раствор 1:4 Тиосульфат натрия, раствор с концентрацией 0,01 моль-экв./дм3 Крахмал, 1 % раствор. Прокалиброванная стеклянная колба с притертой пробкой Пипетки Бюретки Конические колбы Ход определения Пробы воды отбирают в прокалиброванные стеклянные емкости с притертой пробкой вместимостью 250 см3. Для калибровки сначала взвешивают сухую емкость с пробкой, затем наполняют ее доверху водой, закрывают пробкой и снова взвешивают. По разнице масс определяют массу воды в колбе и ее объем (для пресной воды плотность близка к 1 кг/дм3 ). Склянки опускают на глубину 0,5 м, вынимают и закрывают пробкой так, чтобы под пробкой не образовались пузырьки. Сразу же фиксируют кислород, для чего в склянки при помощи пипетки на 2 см3, погружая ее до дна, вносят 2 см3 раствора MnSO4 или MnCl2 . Другой пипеткой в верхнюю часть склянки вносят 2 см3 щелочного раствора KI. Склянку осторожно закрывают пробкой так, чтобы под пробкой не осталось пузырьков воздуха. При этом из склянки выливается 4 см3 исследуемой воды, т.е. столько, сколько наливают реактивов. Затем жидкость перемешивают перевертыванием. Перед титрованием (осадок должен хорошо осесть) приливают 4 см3 Н2SO4 (1:4), часть жидкости переливается через край. При этом раствор H2SO4 вносят пипеткой в нижнюю часть склянки. Закрывают склянку пробкой и перемешивают до растворения осадка MnO2. После этого всю пробу переливают в коническую колбу для титрования вместимостью 500 см3 и быстро титруют 0,01н. раствором тиосульфата натрия при непрерывном помешивании до соломенно-желтого цвета, после чего добавляют 1 см3 крахмала и продолжают титровать до исчезновения синей окраски.
Расчет. Содержание растворенного кислорода (Х) в мг/дм3 производится по формуле: где V Т – объем тиосульфата натрия, пошедшего на титрование, см3; Н – концентрация тиосульфата натрия, моль-экв/дм3; V пробы – объем пробы в склянке, см3; V 1 – объем реактивов, добавленный до образования Mn(OH)2, см3; 1000 – коэффициент для перевода от граммов к миллиграммам; ЭО2 – эквивалент кислорода, г/моль-экв; К – коэффициент поправки к концентрации титранта;
Определение активного хлора
Активный хлор – это свободный растворенный молекулярный хлор и некоторые соединения хлора, которые являются сильными окислителями, в которых хлор имеет положительную степень окисления, например, хлорамины, гипохлориты и хлориты («связанный активный хлор»). Содержание так называемого «активного хлора» определяется в дезинфицированной хлором или его соединениями питьевой воде и в некоторых сточных водах. В поверхностных водах содержание хлора определяется в местах ниже сброса упомянутых сточных вод. Остаточный свободный хлор в воде централизованного водоснабжения должен быть в пределах 0,3–0,5 мг/дм3, остаточный связанный – в пределах 0,8-1,2 мг/дм3; при одновременном присутствии в воде свободного и связанного хлора их общая концентрация не должна превышать 1,2 мг/дм3. Для определения «активного хлора» можно использовать йодометрический метод и колориметрический метод с применением о-толуидина. Йодометрический метод рекомендуется для анализа вод, содержащих выше 0,05 мг/дм3 активного хлора. Колориметрическим методом можно пользоваться при концентрации активного хлора в пробе от 0,01 до 7 мг/дм3. Лабораторная работа № 10
|
|||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 291; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.41 (0.007 с.) |