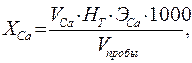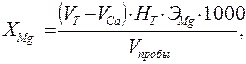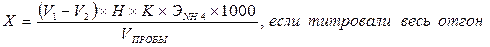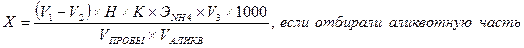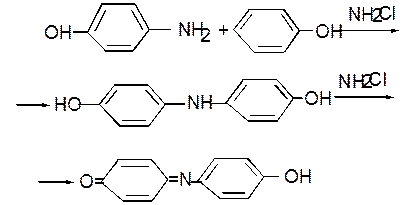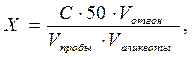Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение содержания кальция и магния в водеСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Сущность метода. Метод основан на том, что трилон Б образует при рН 10 прочные комплексные соединения с ионами кальция и магния. Индикаторы при добавлении в воду при анализе также при определенной реакции среды образуют с ионами магния и кальция окрашенные комплексные соединения. Трилон Б при титровании, соединяясь с ионами кальция, а затем с ионами магния, вытесняет индикаторы в свободной форме, причем каждый индикатор высвобождается при определенной реакции среды. Мешающее влияние некоторых тяжелых металлов устраняют добавлением в ходе анализа гидроксиламина солянокислого и натрия N,N-диэтилдитиокарбамата. Реактивы и оборудование Аммонийный буферный раствор: 20г хлорида аммония, 100 мл 25% раствора аммиака смешивают и доводят дистиллированной водой до 1 дм3. Трилон Б, раствор с концентрацией 0,05 моль-экв/дм3 (9,31 г на 1 дм3) Гидроксид натрия, 10 % раствор Соляная кислота, 1 Н раствор Индикатор мурексид, смесь с хлоридом натрия, 1: 99 Индикатор эриохром черный, смесь с хлоридом натрия, 1: 99 Натрия N,N-диэтилдитиокарбамат. Гидроксиламин солянокислый, 1 % раствор Мерная колба или пипетка на 50 см3 Конические колбы для титрования Бюретка Ход определения. В коническую колбу помещают 100 см3 исследуемой воды, прибавляют 1-2 см3 10% раствора гидроксида натрия. Для устранения влияния Mn, Cu, Zn вносят после подщелачивания 5 капель раствора солянокислого гидроксиламина и несколько кристалликов диэтилдитиокарбамата натрия. Затем добавляют приблизительно 100 мг сухого мурексида и сразу титруют раствором трилона Б до появления интенсивного устойчивого фиолетового окрашивания. Отмечают объем титранта, пошедшего на титрование ионов кальция. После этого оттитрованный раствор подкисляют 1 Н раствором соляной кислоты до рН 6 (по универсальной индикаторной бумаге) и оставляют стоять несколько минут, при этом окраска мурексида разрушается (для ускорения процесса можно нагреть раствор, предварительно добавив 1 каплю бромной воды). Затем добавляют 5 см3 хлоридно-аммиачного буфера, приблизительно 100 мг сухого эриохрома черного и титруют трилоном Б до получения синего или синего с зеленоватым оттенком окрашивания. Отмечают общий объема израсходованного титранта. Расчет. Концентрацию кальция (ХСа) в мг/дм3 находят по формуле:
где V са – объем раствора трилона Б для оттитровывания кальция, см3; H Т – концентрация раствора трилона Б, моль-экв/дм3; V пробы – объем пробы воды, см3; ЭСа – эквивалент кальция, г/моль-экв.; 1000 – коэффициент для перехода от граммов к миллиграммам. Концентрацию магния (ХMg) в мг/дм3 находят по формуле:
где V Т – общий объем раствора трилона Б для оттитровывания кальция и магния, см3; V са – объем раствора трилона Б для оттитровывания кальция, см3; H Т – концентрация раствора трилона Б, моль-экв/дм3; V пробы – объем пробы воды, см3; Э Mg – эквивалент магния, г/моль-экв.; 1000 – коэффициент для перехода от граммов к миллиграммам. . Соединения азота Общее содержание азота в природных водах - это сумма минерального и органического азота. Средняя концентрация общего азота в природных водах колеблется в значительных пределах и зависит от трофности водного объекта: для олиготрофных водоемов изменяется в пределах 0,3-0,7, для мезотрофных –0,7-1,3; для эвтрофных 0,8-2,0 мг/дм3. Минеральный азот в природных водах содержится в форме аммиака, солей аммония, нитритов и нитратов. Соотношение данных форм позволяет судить о протекающих в водоемах процессах самоочищения, о характере и времени загрязнения воды. Повышение концентрации ионов аммония и нитритов обычно указывает на протекание процессов аммонификации и начале нитрификации, т.е. на недавнее органическое загрязнение, в то время как высокое содержания нитратов обычно характерно для старого загрязнения. При относительно высоком содержании аммонийных ионов или аммиака, превышающем 10 мг/дм3, рекомендуется титриметрический метод определения с предварительной отгонкой аммиака в раствор борной кислоты. Фотометрический метод с реактивом Несслера тоже возможен только с предварительной отгонкой аммиака. Фотоколориметрический фенольно-гипохлоритный метод возможен без предварительной отгонки. Для санитарного контроля за качеством воды обязательно указывают форму выражения результатов (N–NН4+ или NН4+).Для выражения результатов в форме аммонийного азота N–NН4+,мг /дм3 полученную величину NН4+, мг/дм3 умножают на коэффициент 0,77.
Лабораторная работа № 14 Титриметрический метод определения аммиака
Сущность метода. Метод основан на титрованииаммиака, обладающего слабыми основными свойствами, раствором кислоты в присутствии индикатора. Реактивы и оборудование Бромфеноловый синий Метиловый красный Серная кислота, 0,02 н. раствор Бюретки Конические колбы Предварительная отгонка аммиака. При низком содержании NH4+ и NH3 , когда отсутствуют мешающие вещества, отгонку можно не проводить, но она все же обязательна при наличии мути, при присутствии сильно окрашенных веществ, при кислотности, превышающей 100 мг/дм3, и щелочности, превышающей 500 мг/дм3. Если отгонку проводить из сильнощелочного раствора, то при этом возможен гидролиз некоторых азотсодержащих органических веществ с образованием аммиака, поэтому отгонку надо вести при соответствующем рН исходного раствора. Отгонку аммиака рекомендуется проводить при рН 9,5 (если предполагается присутствие цианатов, а также большинства азотсодержащих органических соединений), при рН 7,4 (когда предполагается присутствие карбамида) и из сильнощелочной среды (если анализируют сточные воды, содержащие большие количества фенолов – сточные воды коксохимических заводов, газогенераторных предприятий и др.). Если наряду с фенолами присутствуют вещества, гидролизующиеся в щелочной среде, то отгонку надо провести дважды: сначала при рН = 7,4, собирая отгон в разбавленный раствор сильной кислоты, потом подщелочив этот отгон до сильнощелочной реакции. Поглотителем аммиака служит раствор борной кислоты, когда определение заканчивают титрованием или фотометрическим методом с реактивом Несслера. При применении фенол – гипохлоритного метода отогнанный аммиак поглощают раствором серной кислоты. Отгонку проводят из круглодонной колбы вместимостью от 800 до 2000 см3 с вертикальным холодильником, конец которого (или форштос) надо погрузить в раствор кислоты, находящийся в приемнике. Реактивы и оборудование для отгонки Безаммиачная вода: бидистиллят пропускают через колонку с катионитом КУ-2 Боратный буферный раствор, рН 9,54: к 500 см3 0,025 М раствора тетрабората натрия, содержащего 9,5 г/дм3 Na2B4O7 ×10H2O, приливают 88 см3 0,1 Н раствора NaOH и разбавляют безаммиачной водой до 1 дм3 Фосфатный буферный раствор, рН 7,4. Дехлорирующий раствор: 3,5 г Na2S2O3 5H2O растворяют в безаммиачной воде и разбавляют до 1 дм3 Поглощающие растворы: 0,2 Н Н2SO4 или 0,2 Н HCl, или раствор борной кислоты: растворяют 40 г Н3ВО3 в безаммиачной воде и разбавляют такой же водой до 1 дм3 Колбы для отгонки, холодильник Мерные цилиндры, мерная колба Ход отгонки. Отгонку следует проводить в комнате, воздух которой не содержит аммиака. В колбу для отгонки вместимостью 800 – 1000 см3 помещают 400 см3 анализируемой сточной воды (или меньший объем, разбавленный до 400 см3 безаммиачной водой). Если проба содержит «активный хлор», ее предварительно дехлорируют добавлением эквивалентного количества дехлорирующего реагента. Пробу нейтрализуют, если надо, до рН = 7 разбавленной кислотой или щелочью, определив необходимое количество титрованием отдельной порции. Затем приливают 25 см3 буферного раствора (рН = 9,5 или 7,4 в зависимости от предполагаемых загрязнений) или 20 см3 раствора едкого натра при анализе фенольных вод. В приемник наливают указанное количество поглощающего раствора: при титриметрическом методе или фотоколориметрическом методе с реактивом Несслера – 50 см3 раствора борной кислоты, при фотометрическом фенол-гипохлоритном методе 40 см3 0,2 Н Н2SO4 или HCl. Отгоняют 300 см3 жидкости, количественно переносят отгон в мерную колбу вместимостью 500 см3, разбавляют до метки безаммиачной дистиллированной водой и перемешивают. Определение аммиака. К аликвотной части полученного после перегонки раствора (или ко всему раствору, не разбавляя его в мерной колбе) прибавляют несколько капель индикатора бромфенолового синего или метилового красного и титруют 0,02 н. раствором серной кислоты до изменения окраски индикатора. Проводят холостой опыт со всеми примененными в анализе реактивами: используют те же количества раствора борной кислоты, индикатора, вместо отгона используют дистиллированную воду, освобожденную от СО2 кипячением Расчет. Содержание аммонийных ионов (Х) в мг/дм3 находят по формуле: где V 1 – объем 0,02 н. серной кислоты, израсходованной на титрование пробы, см3; V 2 – объем 0,02 н. серной кислоты, израсходованной в холостом опыте, см3; Н – концентрация титранта - серной кислоты, моль-экв/дм3; К – поправочный коэффициент к концентрации титранта; V пробы – объем воды, взятой для анализа, см3; V аликв – объем отобранной аликвотной части, см3; V 3 –объем мерной колбы, до которого был разбавлен отгон, см3; Э NH 4 – моль-эквивалент катиона аммония, г/моль-эквивалент; 1000 – коэффициент для перехода от граммов к миллиграммам. Лабораторная работа № 15 Фотометрический фенол - гипохлоритный метод определения аммиака
Сущность метода. При взаимодействии аммиака с гипохлорит – ионами образуется монохлорамин, который с фенолом в щелочной среде образует n – аминофенол: NH3 + OCl– ® NH2Cl + OH– C6H5O– + NH2Cl ® n - HOC6H4NH2 + Cl–
Последний, реагируя со второй молекулой фенола, образует сначала 4,4¢- дигидроксидифениламин, окисляющийся хлорамином с образованием синего красителя индофенола: В качестве катализатора и стабилизирующего агента вводят соль марганца (II). Предел обнаружения 0,01 мг/дм3 NH4+. Диапазон измеряемых концентраций без разбавления пробы – 0,01 –1 мг/дм3 NH4+. Мешающие вещества. Определению NH4+ фенол-гипохлоритным методом мешают немногие вещества; их значительно меньше, чем при определении с реактивом Несслера. Сильно мешают сероводород и сульфиды. Их можно удалить, подкислив пробу до рН = 3 и пропустив воздух до исчезновения запаха сероводорода. Мешают восстановители, реагирующие с гипохлоритом (например, цианиды, роданиды), большая щелочность пробы (выше 500 мг/дм3), слишком большая кислотность (больше 100 мг-экв/дм3) и вещества, вызывающие окраску воды или мутность. В таких случаях проводят предварительную отгонку аммиака. Во всех остальных случаях возможно определение NH4+ без предварительной отгонки аммиака. Реактивы и оборудование Бидистиллят, не содержащий аммиака. Дважды перегнанную воду пропускают через колонку с катионом КУ-2. Эту воду используют для приготовления реактивов и разбавления проб. Фенолят натрия: В 100 мл безаммиачной дистиллированной воды растворяют 5 г свежеперегнанного фенола, 25 мл нитропруссида натрия и 0,1 г салициловой кислоты. Гипохлорит натрия, 3%-ный раствор. Сульфат марганца (II), 0,003 М раствор. Стандартный раствор с содержанием ионов аммония 0,05 мг/см3 (свежеприготовленный). Пипетка на 5 см3 Мерные пробирки Мерные колбы на 50 см3 Ход определения. Построение калибровочного графика. В мерные колбы на 50 см3 вносят 0,1; 0,5; 1,0; 1,5; 2,0; 3,0 см3 рабочего стандартного раствора хлорида аммония с концентрацией ионов аммония 0,05 мг/см3 и доводят каждый раствор до метки безаммиачной водой. Концентрации NH4+ в полученных растворах равны соответственно 0,1; 0,5; 1,0; 1,5; 2,0; 3,0 мг/дм3. Добавляют 20-30 см3 безаммиачной воды, 1 каплю раствора сульфата марганца, затем при непрерывном помешивании приливают 0,5 см3 раствора гипохлорита натрия и сразу же 0,6 см3 фенолята натрия, затем доводят объем водой до метки. Энергично взбалтывают 2 мин. Дают постоять 10 мин для развития окраски и измеряют оптическую плотность в кювете 2 см при l = 625 нм (красно-оранжевый светофильтр). Раствор-фон готовят в колбе на 50 см3, используя безаммиачную воду и те же количества реактивов. Калибровочный график строят в координатах оптическая плотность –концентрация ионов NH4+, мг/дм3. Определение концентрации ионов аммония. В мерную колбу вместимостью 50 см3 отбирают10 см3 первоначальной пробы воды или раствора, полученного после отгонки аммиака (см. лаб. раб. №14). Этот раствор обрабатывают, как описано выше, и определяют его оптическую плотность. Расчет. Содержание аммонийных ионов (Х) в мг/дм3 находят по формуле:
где С – концентрация ионов аммония, найденная по графику, мг/дм3; 50– объем раствора, приготовленного для фотометрирования, см3; V пробы – объем пробы воды, взятой для анализа или для отгона, см3; V отгон – объем, до которого был разбавлен отгон, см3; V аликвоты –объем аликвоты отгона, взятой для анализа, см3.
Лабораторная работа № 16 Фотометрический метод определения аммиака с реактивом Несслера Сущность метода. В щелочном растворе аммиак реагирует с тетраиодомеркуратом (II) калия, образуя различные желто-коричневые соединения, выпадающие в осадок или (при малых концентрациях) переходящие в коллоидные растворы. В условиях фотометрического определения реакция в основном проходит по уравнению 2 HgI42- + NH3 + OH- ® NH2HgI3 + 5 I- + H2O Содержание азота, ртути и иодида в осадке выражается отношением 1:2:3, однако возможно присутствие в осадке и других соединений (OHg2NH2I и др.). Некоторая неопределенность состава образующегося соединения требует точного соблюдения условий проведения определения как при анализе пробы, так и при построении калибровочного графика. Предел обнаружения 0,05 мг/дм3 NН4+. Диапазон измеряемых количеств аммонийных ионов в пробе 0,005 – 0,15 мг. Мешающие вещества. Непосредственному применению метода без предварительной отгонки аммиака мешает такое большое число веществ, что рекомендовать этот метод без отгонки можно лишь для очень немногих сточных вод. Реактивы и оборудование Все реактивы и оборудование, используемые при отгонке аммиака Безаммиачная вода Реактив Несслера. Хлорид аммония, раствор с содержанием ионов аммония 0,05 мг/см3 (свежеприготовленный) Мерные колбы на 50 см3 Мерные пробирки Пипетка на 5 см3 Ход определения. Построение градуировочного графика. В мерные колбы на 50 см3 вносят 0,1; 0,5; 1,0; 1,5; 2,0; 3,0 см3 рабочего стандартного раствора хлорида аммония и доводят каждый раствор до метки безаммиачной водой. Концентрации NH4+ в полученных растворах равны соответственно 0,1; 0, см35; 1,0; 1,5; 2,0; 3,0 мг/дм3. Добавляют 20-30 см3 безаммиачной воды, 1 мл реактива Несслера, доводят объем водой до метки, перемешивают. Дают постоять 10 мин для развития окраски и измеряют оптическую плотность в кювете с толщиной слоя 2 см при l = 425 нм (фиолетовый светофильтр). Раствор-фон готовят в колбе на 50 см3, используя безаммиачную воду и то же количество реактива Несслера. Калибровочный график строят в координатах оптическая плотность –концентрация ионов NH4+, мг/дм3. Определение концентрации ионов аммония. Если необходим отгон аммиака, проводят его по методике, указанной в лабораторной работе №14. Из мерной колбы, содержащей отогнанный из пробы аммиак в растворе борной кислоты, отбирают аликвотную часть. Оптимальное содержание для колориметрирования около 0,15 мг NH4+ в определяемом объеме. Например, берут аликвоту 10 см3. Разбавляют отобранную порцию безаммиачной водой, приливают 1 см3 реактива Несслера и доводят объем до 50 см3, дают постоять не меньше 10 мин. Оптическую плотность полученного окрашенного раствора измеряют, как описано выше. Расчет. Содержание аммонийных ионов (Х) в мг/дм3 находят по формуле:
где С – концентрация ионов аммония, найденная по графику, мг/дм3; 50– объем раствора, приготовленного для фотоколориметрирования, см3; V пробы – объем пробы воды, взятой для анализа или для отгона, см3; V отгон – объем, до которого был разбавлен отгон, см3; V аликвоты –объем аликвоты отгона, взятой для анализа, см3.
|
|||||||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 2209; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.41 (0.013 с.) |