Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лабораторная работа № 17 Фотометрическое определение нитратов с салицилатом натрияСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Сущность метода. В среде концентрированной серной кислоты нитрат-ионы реагируют с салицилатом натрия, образуя смесь 3- нитросалициловой и 5-нитросалициловой кислот, соли которых в щелочной среде имеют желтую окраску. Без разбавления или концентрирования нитрат-ионы можно определить в концентрациях от 0,1 до 20 мг/дм3. Мешающие вещества. Мешают определению окрашенные органические вещества, тяжелые металлы, железо в концентрации больше 5 мг/дм3. Их можно предварительно удалить обработкой пробы суспензией гидроксида алюминия. Реактивы и оборудование Салицилат натрия, 0,5 %-ный раствор, всегда свежеприготовленный Серная кислота концентрированная, плотность 1,84 г/см3, х.ч. Раствор гидроксида натрия и сегнетовой соли: растворяют 400 г гидроксида натрия и 60 г сегнетовой соли в дистиллированной воде, охлаждают, разбавляют до 1 дм3 Гидроксид алюминия, суспензия Нитрат калия, раствор с концентрацией нитрат-иона 0,1 мг/ см3 (раствор А) Нитрат калия, раствор с концентрацией нитрат-иона 0,01 мг/ см3 (раствор Б), готовится в день анализа разбавлением раствора А в 10 раз) Бюретка Мерные колбы на 50 см3 Фарфоровые чашки Водяная баня Мерные пробирки Стеклянные палочки Мерный цилиндр Мерные пробирки Коническая колба Воронка для фильтрования Фильтровальная бумага Ход определения. Построение градуировочного графика. В фарфоровые чашки вносят 0; 1; 5; 10; 15; 20 см3 рабочего стандартного раствора Б с концентрацией нитратов 0,01 мг/см3, что соответствует содержанию нитратов 0 –0,01 – 0,05 – 0,1 –0,15 –0,2 мг, добавляют по 1 см3 раствора салицилата натрия и выпаривают на водяной бане досуха (не перегревать!). После охлаждения сухой остаток смачивают 1 см3 концентрированной серной кислоты, тщательно растирают его стеклянной палочкой и оставляют на 10 мин. Затем содержимое чашки разбавляют 15 см3 дистиллированной воды, переносят количественно в мерную колбу вместимостью 50 см3, обмывая стенки чашки дистиллированной водой. Приливают 7 см3 раствора гидроксида натрия и сегнетовой соли, доводят дистиллированной водой до метки и полученный окрашенный раствор фотометрируют при l = 410 нм (фиолетовый светофильтр), пользуясь кюветами с толщиной слоя 2 см. Окраска устойчива в течение 10 мин после прибавления раствора гидроксида натрия, в дальнейшем окраска изменяется. В качестве раствора – фона используют холостой (нулевой) раствор, полученный из дистиллированной воды, проведенной через весь анализ. Строят калибровочный график в координатах оптическая плотность – содержание нитратов (мг). Определение концентрации нитратов в воде. Если анализируемая вода содержит окрашенные органические вещества, отбирают 75 см3пробы, прибавляют 2 см3 суспензии гидроксида алюминия, тщательно перемешивают, оставляют на несколько минут и фильтруют, отбрасывая первые порции фильтрата. В фарфоровую чашку помещают 10 см3 фильтрата (или первоначальной пробы, если обработку гидроксидом алюминия не проводили), прибавляют 2 см3 раствора салицилата натрия и выпаривают на водяной бане досуха. Сухой остаток обрабатывают так же, как и при построении градуировочного графика.
Расчет. Содержание нитратов Х (мг/дм3) рассчитывают по формуле: где С – содержание нитратов, найденное по калибровочному графику, мг; V пробы – объем пробы воды, взятой для анализа, см3; 1000 – пересчет на 1 дм3, коэффициент для перехода от см3 к дм3.
Лабораторная работа № 18 Фотоколориметрическое определение нитритов по Гриссу Сущность метода. Нитриты находят колориметрическим методом с помощью реактива Грисса, который представляет собой смесь сульфаниловой кислоты и a - нафтиламина. Эти вещества между собой без нитритов не взаимодействуют. В кислой среде нитриты образуют азотистую кислоту, которая реагирует с сульфаниловой кислотой с образованием диазосоединения,
которое вступает в реакцию с a - нафтиламином с образованием красителя красного цвета.
Количество образующегося красителя определяется содержанием нитритов в воде. Без разбавления пробы этим методом можно установить от 0,001 до 0,6 мг нитритов в 1 дм3 воды с точностью 0,002 мг/дм3. При большем содержании нитритов исследуемую воду необходимо разбавлять. Мешающие вещества. Определению мешают взвешенные вещества, мутность, окраска воды, а также сильные окислители и восстановители. Обычно мутность и цветность удаляют фильтрованием и коагулированием. К 300 см3 пробы прибавляют 0,5 г активированного угля или гидроксида алюминия (0,5 г сухого препарата или 2-4 см3 суспензии), перемешивают, отстаивают 15 – 20 мин и фильтруют. Влияние окислителей и восстановителей в сильнозагрязненных водах устраняют соответствующим разбавлением пробы дистиллированной водой. Высокая чувствительность метода требует, чтобы дистиллированная вода и все реактивы не были загрязнены нитритами. Реактивы и оборудование Все реактивы готовятся на дистиллированной воде, не содержащей нитритов. Реактивы для подготовки дистиллированной воды без содержания нитритов: Серная кислота конц. Сульфат марганца, 50% раствор Перманганат калия, 0,04% раствор Оксалат аммония 0,09% раствор Дистиллированная вода, не содержащая нитритов. К 1дм3 дистиллированной воды приливают 1 см3 концентрированной серной кислоты, затем добавляют 0,2 см3 50%-ного раствора MnSO4 и 3 см3 0,04%-ного раствора KMnO4. Жидкость должна стать розовой. Через 15 мин ее обесцвечивают, прибавляя по каплям 0,09%-ный раствор оксалата аммония. Нитрит натрия с концентрацией нитрит-иона 0,1 мг/см3 (раствор А): навеску 0,1497 г NaNO2 ч.д.а., высушенного при 1050C, растворяют в дистиллированной воде в колбе на 1 дм3, затем объем колбы доводят водой до метки. Раствор консервируют добавлением 1см3 хлороформа и сохраняют в холодном месте; он устойчив в течение месяца. Нитрит натрия с концентрацией нитрит-иона 0,01мг/см3 (раствор Б): 10см3 раствора А помещают в колбу мерную на 100 см3 и доводят объем колбы до метки дистиллированной водой. Раствор должен быть всегда свежеприготовленным Уксусная кислота, 12 % раствор: в мерную колбу на 1 дм3 налить 2/3 дистиллированной воды, затем прилить 128 см3 концентрированной уксусной кислоты довести объем колбы водой до метки Реактив Грисса, 10 % раствор: 10г реактива Грисса растворить в 90см3 12% раствора уксусной кислоты (или a - нафтиламин, 10% раствор, сульфаниловая кислота, 10% раствор, раствор ацетата натрия для получения реактива Грисса в ходе анализа) Пипетки мерные на 10 см3, 2 см3 Мерные колбы на 50 см 3 Ход определения Построение градуировочного графика. В мерные колбы на 50 см3 вносят 1; 3; 5; 10; 15; 20; 25 см3 рабочего раствора с концентрацией 0,01мг/см3 NO2– и доливают дистиллированную воду примерно до 40-45см3. Прибавляют по 2 см3 реактива Грисса и доводят объем до метки дистиллированной водой, перемешивают. Концентрации полученных растворов равны 0,0002; 0,0006; 0,001; 0,002; 0,003; 0,004; 0,005 мг/см3, соответственно. Через 40 минут на фотоколориметре определяют оптическую плотность при длине волны λ=510нм по отношению к раствору-фону. Оптическую плотность растворов измеряют в кюветах с толщиной слоя 10мм и строят калибровочный график в координатах оптическая плотность – содержание нитритов, мг/см3. Определение нитритов в пробе. 100 см3 исследуемой воды фильтруют и при необходимости осветляют. В мерную колбу на 50 см3 отбирают аликвоту 25см3 анализируемой воды, прибавляют 2 см3 реактива Грисса и доводят до метки дистиллированной водой. Окраска раствора появляется через 40 минут и сохраняется неизменной в течение 3 часов. Через 40 минут растворы фотометрируют при длине волны λ= 510 нм по отношению к раствору-фону. Расчет. Содержание нитритов (Х) в мг/дм3 рассчитывают по формуле:
где С – концентрация нитритов, найденная по графику, мг/см3; А – объем раствора, приготовленного для фотометрирования, см3; Vпробы – объем воды, взятой для анализа, см3; 1000 – пересчет на 1 дм3, коэффициент для перехода от см3 к дм3. . Фосфаты Под общим фосфором понимают сумму минерального и органического фосфора. Основным фактором, определяющим концентрацию фосфора в воде, так же, как и в случае азота, является обмен между его минеральными и органическими формами, с одной стороны, и живыми организмами – с другой. Соединения минерального фосфора поступают в природные воды в результате выветривания и растворения пород, содержащих ортофосфаты (апатиты и фосфориты), с поверхности водосбора в виде минеральных удобрений с поверхностным стоком с полей, со стоками с ферм (0,01- 0,05 кг/сутки на одно животное), с недоочищенными или неочищенными бытовыми сточными водами (0,003-0,006 кг/сутки на одного жителя), с некоторыми производственными отходами, а также образуются при биологическом разложении остатков животных и растительных организмов. Фосфор – важнейший биогенный элемент, чаще всего лимитирующий продуктивность водоемов. Поэтому поступление избытка соединений фосфора, особенно в непроточные и малопроточные водоемы, приводит к эфтрофикации (см. раздел 1.5). Поэтому определение содержания общего фосфора (растворенного и взвешенного в виде органических и минеральных соединений) включено в программы обязательных наблюдений за составом природных вод. Фосфор является важнейшим показателем трофического статуса природных водоемов. Основной формой неорганического фосфора при значениях рН водоема больше 6,5 является ион НРО42– (около 90 %). В кислых водах неорганический фосфор присутствует преимущественно в виде Н2РО4–. Концентрация общего растворенного фосфора в незагрязненных природных водах изменяется от 5 до 200 мкг/дм 3. Концентрация фосфатов в природных водах очень мала - сотые, редко десятые доли миллиграммов фосфора в 1 дм3, в загрязненных водах она может достигать нескольких миллиграммов в 1 дм3. Содержание соединений фосфора подвержено значительным сезонным колебаниям. Минимальные концентрации фосфора в поверхностных водах наблюдаются обычно весной и летом, максимальные – осенью и зимой.
Лабораторная работа № 19 Фотоколориметрическое определение фосфатов
Сущность метода. Метод основан на взаимодействии фосфат-ионов в кислой среде с молибдатом аммония и образованием фосфорно-молибденовой гетерополикислоты, которая восстанавливается аскорбиновой кислотой в присутствии сурьмяно-виннокислого калия до фосфорно-молибденового комплекса, окрашенного в голубой цвет. Максимум светопоглощения соответствует длине волны λ = 690 нм. При проведении определения в кюветах с толщиной слоя 5 см методика позволяет определять фосфат-ионы в воде при массовой концентрации от 0,05 до 1 мг/дм3 РО43–. Если массовая концентрация фосфат-ионов в анализируемой пробе превышает верхнюю границу, то допускается разбавление пробы таким образом, чтобы концентрация фосфат-ионов соответствовала данному диапазону. Точность определения фосфатов в этом диапазоне концентраций составляет ± 0,01– 0,02 мг /дм3; чувствительность 0,01 мг/дм3. Реактивы и оборудование Фотоэлектроколориметр Колбы мерные объемом 50, 100, 500, 1000см3 Фильтры беззольные «синяя лента» Воронки лабораторные стеклянные Бюретки объемом 25 см3 Стаканы объемом 100 или 200 см3 Пипетки мерные 1 см3, 5 см3 Стандартный раствор с концентрацией фосфат-иона 0,1 мг/см3 (раствор А): 0,1432 г КН2РО4 помещают в стакан, растворяют в небольшом количестве дистиллированной воды, переносят в мерную колбу на 1000 см3 и доводят до метки дистиллированной водой. Стандартный раствор с содержанием фосфат- ионов 1 мкг/см3 (раствор Б): 1 см3 раствора А с концентрацией фосфат-иона 0,1 мг/см3 помещают в мерную колбу на 100 см3 и доводят до метки дистиллированной водой. Рабочий стандартный раствор готовят в день употребления. Раствор молибдата аммония. 3 г молибдата аммония помещают в стакан, растворяют в небольшом количестве дистиллированной воды, переносят в мерную колбу на 100 см3 и доводят до метки дистиллированной водой. В случае появления мути раствор следует отфильтровать. Раствор хранят в полиэтиленовой бутыли. Раствор аскорбиновой кислоты. 16 г аскорбиновой кислоты помещают в стакан, растворяют в небольшом количестве дистиллированной воды, переносят в мерную колбу на 100 см3 и доводят до метки дистиллированной водой. Раствор хранят в холодильнике в течение 3-х недель. Раствор антимонилтартрата калия. 0,34 г антимонилтартрата калия помещают в стакан, растворяют в небольшом количестве дистиллированной воды, переносят в мерную колбу на 500 см3 и доводят до метки дистиллированной водой. Раствор серной кислоты. В мерную колбу на 500 см3 наливают 240 см3 дистиллированной воды и осторожно приливают 70 см3 концентрированной серной кислоты. После охлаждения раствор доводят до метки дистиллированной водой. Смешанный реактив. Смешанный реактив готовят непосредственно перед использованием, предварительно определив необходимый объем данного реактива на день работы. В колбе с притертой пробкой смешивают 50 см3 раствора серной кислоты, 20 см3 раствора молибдата аммония, 20см3 раствора аскорбиновой кислоты и 10 см3 раствора антимонилтартрата калия. Мешающие вещества. Мешающее влияние сульфидов, сероводорода, хроматов, арсенатов, нитритов и железа при их высоком присутствии в пробе сточных вод, устраняют специальной подготовкой к анализу. Ход определения. Построение градуировочного графика. В мерные колбы на 100 см3 из бюретки наливают 0 (нулевой раствор), 2, 5, 10, 15, 20 см3 раствора Б с содержанием фосфат-ионов 1 мкг/см3 . Концентрация фосфат-иона в приготовленных растворах будет 0; 0,04; 0,1; 0,2; 0,3;. 0,4 мг/дм3, соответственно. Добавляют из другой бюретки определенный объем дистиллированной воды, чтобы суммарный объем жидкости составил 50 см3. Прибавляют 5,0 см3 смешанного реактива и через 30 секунд – 0,5 см3 раствора аскорбиновой кислоты. Смесь перемешивают (до метки дистиллированную воду не добавляют!). Через 15 мин измеряют оптическую плотность полученного раствора по отношению к нулевому раствору при длине волны 690 нм, кювета 5 см. Строят градуировочный график в координатах оптическая плотность – концентрация фосфат-иона, мг/дм3. Определение содержания фосфатов в пробе. В мерную колбу на 100 см3 наливают 50 см3 пробы, отфильтрованной через плотный бумажный фильтр (синяя лента), прибавляют 5,0 см3 смешанного реактива и через 30 секунд – 0,5 см3 раствора аскорбиновой кислоты. Смесь перемешивают (до метки дистиллированную воду не добавляют!). Через 15 мин измеряют оптическую плотность полученного раствора по отношению к нулевому раствору при длине волны 690 нм, кювета 5 см. Если содержание фосфат – ионов велико, то пробу воды уменьшают, добавляют к ней определенный объем дистиллированной воды так, чтобы суммарный объем жидкости составил 50 см3, и далее проводят анализ, как описано выше. Расчет. Содержание фосфат-ионов Х (мг/дм3) рассчитывают по формуле:
где С – концентрация фосфат-ионов, найденная по графику, мг/дм3; 50 – объем, до которого была разбавлена проба, см3; Vпробы – объем воды, взятый для анализа, см3.
Хлориды Хлориды являются составной частью большинства природных вод. Хлориды – преобладающие анионы в высокоминерализованных водах, большое содержание хлоридов геологического происхождения в поверхностных водах – явление редкое. Первичными источниками хлоридов в воде являются магматические породы, соленосные отложения, в основном галит. Хлориды поступают в воду в результате обмена с океаном через атмосферу, посредством взаимодействия атмосферных осадков с почвами, особенно засоленными, а также при вулканических выбросах. Поэтому обнаружение большого количества хлоридов является показателем загрязнения воды бытовыми и некоторыми промышленными сточными водами. Повышенное содержание хлоридов ухудшают вкусовые качества воды, делают ее малопригодной для питьевого водоснабжения и ограничивают применение в ряде технических и хозяйственных целей, а также для орошения сельскохозяйственных угодий. Если в питьевой воде есть ионы натрия, то при концентрации хлоридов более 250 мг/дм3 у воды появляется соленый вкус. Данные о том, что высокие концентрации хлоридов оказывают вредное воздействие на здоровье человека, отсутствуют. Анализ хлоридов в питьевых, поверхностных и сточных водах проводится аргентометрическим титрованием по методу Мора или потенциометрическим методом.
Лабораторная работа № 20 Аргентометрическое определение хлоридов по методу Мора Сущность метода. МетодМора основан на осаждении хлоридов азотнокислым серебром в присутствии хромата калия K2CrO4. Нитрат серебра при наличии в растворе хлоридов первоначально реагирует с ними, а лишь затем после связывания всех хлоридов образуется хромат серебра оранжево-красного цвета. NaCI + AqNO3® AqCI¯ + NaNO3 2AqNO3 + K2CrO4 ®Aq2CrO4 ↓+ 2KNO3 Реактивы и оборудование Нитрат серебра, раствор 0,01 моль-экв/дм3 Хлорид натрия, раствор 0,01 моль-экв/дм3 Хромат калия, 5 % раствор Бюретки Конические колбы для титрования Ход определения При содержании хлоридов менее 250 мг/дм3 берут 100 см3 фильтрованной испытуемой воды. При большем содержании хлоридов берут 10 – 50 см3 исследуемой воды и разбавляют до 100 см3 дистиллированной водой. В две конические колбы для титрования вносят по 100 см3 анализируемой воды, прибавляют по 5 капель раствора K2CrO4. Раствор в одной колбе титруют 0,01 Н AgNO3 до изменения окраски раствора по сравнению с окраской во второй колбе (цветной свидетель). Стандартизация титранта. Для стандартизации титранта в коническую колбу вносят 10 см3 0,01 Н раствора NaCд и 90 см3 дистиллированной воды, прибавляют 5 капель K2CrO4. Содержимое колбы титруют 0,01 Н раствором AgNO3 до перехода лимонно-желтой окраски мутного раствора в оранжево-красную, не исчезающую в течение 15 – 20 сек.
Поправочный коэффициент к титру AgNO3 рассчитывают по результатам трех титрований где V1, V2, V3 – объемы AgNO3, пошедшие на каждое из трех титрований, см3.
Расчет. Содержание хлорид-иона Х (мг/дм3) рассчитывают по формуле: где V титр . – количество раствора AgNO3, пошедшее на титрование, см3; Н – концентрация титранта – нитрата серебра, моль-экв/дм3; К – поправочный коэффициент к концентрации титранта; Э Cl – эквивалент хлорид-иона, г/моль-экв; V пробы – объем воды, взятой для анализа, см3; 1000 – коэффициент для перехода от граммов к миллиграммам.
Лабораторная работа № 21 Определение хлоридов с помощью ионоселективного электрода Сущность метода. Потенциометрический метод определения хлоридов основан на определении ЭДС электродной системы, состоящей из хлоридного ионоселективного электрода и вспомогательного хлоридсеребряного электрода. Он позволяет определить суммарную концентрацию хлоридов (всех его форм: иона хлора, его комплексных соединений). Метод используется для растворов с концентрацией хлоридов 0,1 – 10,0 мг/дм3. Мешающие вещества. Мешают большие количества сульфидов, хлоридов, бромидов, роданидов, образующих на поверхности электрода нерастворимые соли, а также сильные восстановители и вещества, образующие комплексные соединения с серебром (например, ЭДТА). Реактивы и оборудование Иономер с иононоселективным хлоридным и хлоридсеребрянным электродами Хлорид натрия, 0,1 М раствор. Ацетатный буферный раствор Стаканы на 50 см3 Мерные колбы на 100 см3 Пипетки на 5 и10 см3 Ход определения. Построение градуировочного графика. И з основного стандартного раствора хлорида натрия с концентрацией 0,1 М методом последовательного десятикратного разбавления готовят растворы 10-2 М, 10-3 М,10-4 М, 10-5М, для чего 10 см3 раствора с более высокой концентрацией наливают в колбу на 100 см3 и доводят водой до метки. Полученные растворы имеют значения рCl = 1, 2, 3, 4, 5. В стакан вместимостью 50 см3 вливают 20,0 см3 рабочего стандартного раствора с рCl = 5, приливают 5 см3 ацетатного буферного раствора, перемешивают на магнитной мешалке. Измеряют ЭДС при перемешивании раствора магнитной мешалкой. Аналогично измеряют ЭДС для других стандартных растворов. При выполнении измерений необходимо следить за тем, чтобы на поверхности мембраны хлоридного электрода не налипали пузырьки воздуха. По результатам измерений строят градуировочный график зависимости значение ЭДС, милливольты – значение рCl. Определение хлоридов в анализируемой воде. В стакан вместимостью 50 см3 помещают 20 см3 анализируемой воды (температура воды не должна отличаться от температуры стандартных растворов, по которым калибруют электрод, более чем на ± 2 0 С, в противном случае воду следует подогреть или охладить). Затем помещают в раствор магнит от магнитной мешалки, приливают 5 см3 буферного раствора и погружают в раствор тщательно промытые дистиллированной и анализируемой водой ионоселективный хлоридный и вспомогательный электроды. Измеряют ЭДС. По градуировочному графику находят значение рCl анализируемой воды. Расчет. Концентрация хлоридов в воде (Х) в мг/дм3 рассчитывается по формуле:
где рСl– показатель концентрации хлорид-иона; найденный по графику; 35,5– молярная масса иона хлора, г/моль; 1000 – коэффициент для перехода от граммов к миллиграммам.
Фториды
В речные воды фтор поступает из пород и почв при разрушении фторсодержащих минералов. Источником фтора могут быть атмосферные осадки. Повышенное содержание фтора может быть в сточных водах предприятий стекольной и химической промышленности (производство фосфорных удобрений, стали, алюминия), в некоторых видах шахтных вод и в сточных водах рудообогатительных фабрик. Миграционная способность фтора в природных водах в значительной степени зависит от содержания в них ионов кальция, дающих с ионами фтора малорастворимое соединение. Содержание фтора в речных водах колеблется от 0,05 до 1,9 мг/дм3 , в атмосферных осадках – от 0,05 до 0,54 мг/дм3. Повышенное содержание фтора в воде (более 1,5 мг/дм3) оказывает вредное воздействие на человека и животных, вызывая костное заболевание (флюороз). Очень низкое содержание фтора в питьевой воде (менее 0,01 мг/дм3) также вредно сказывается на здоровье, вызывая опасность возникновения зубного кариеса. ПДК фтора для холодного и умеренного природно-климатического района 1,5 мг/дм3. При недостатке проводят фторирование воды, в противном случае обесфторивание.
Лабораторная работа № 22 Определение фторидов с помощью ионоселективного электрода Сущность метода. Потенциометрический метод определения фторидов основан на определении ЭДС электродной системы, состоящей из фторселективного электрода и вспомогательного хлоридсеребряного электрода. Метод позволяет определить суммарную концентрацию фторидов (всех его форм: иона фтора, его комплексных соединений). Диапазон измеряемых концентраций без разбавления пробы 0,10-190 мг/дм3. Погрешность не превышает 25–30% с Р = 0,95 при массовой концентрации фторидов 0,1...0,15 мг/дм3; 15% при концентрации 0,2...0,5 г/дм3 и 7%при концентрации фторидов более 0,5 мг/дм3. Мешающие вещества. Мешают большие количества сульфидов, хлоридов, бромидов, роданидов, образующих на поверхности электрода нерастворимые соли, а также сильные восстановители и вещества, образующие комплексные соединения с серебром (например, ЭДТА). Для устранение мешающего влияния солей алюминия и железа к пробе цитратно-этанольный (если массовая концентрация алюминия и железа не более 40 мг/дм3 ) или ацетатно-цитратный буферный раствор. Реактивы и оборудование Иономер с иононоселективным фторидным и хлоридсеребрянным электродами Фторид натрия, 0,1 М раствор. Раствор хранят в полиэтиленовой посуде с плотно закрытой пробкой не более 6 мес. Ацетатно-цитратный буферный раствор с рН = 5 ± 0,2: в мерную колбу вместимостью 500 см3 помещают 52,0 г уксуснокислого натрия, 29,2 г хлористого натрия, 3,0 г лимоннокислого натрия, 0,3 г трилона Б и 8 см3 ледяной уксусной кислоты. Приливают 200 – 300 см3 дистиллированной воды, растворяют соли и доводят объем раствора до метки дистиллированной водой. рН раствора проверяют потенциометрически и при необходимости доводят до требуемого значения 10 % раствором гидроксида натрия или 10% раствором уксусной кислоты. Раствор хранят в холодильнике. Срок хранения 3 мес. Полиэтиленовые стаканы Магнитная мешалка, магнит в пластиковой оболочке. Стаканы на 50 см3 Мерные колбы на 100 см3 Пипетки на 10 см3 Ход определения. Подготовка к работе и проверка работоспособности фторселективного электрода. Фторидный электрод выдерживают в растворе фтористого натрия концентрацией 0,001 М в течение суток, а затем тщательно промывают дистиллированной водой. При ежедневной работе электрод хранят, погрузив в раствор фтористого натрия концентрацией 0,0001 М, при длительных перерывах в работе – хранят в сухом состоянии. Правильность работы фторидного электрода контролируют при построении графика. Потенциал рабочих градуировочных растворов должен изменяться на 56 ± 3 мВ. Если такая зависимость значения потенциала от pF не соблюдается, то фторидный электрод следует регенерировать вымачиванием в 0,001 М растворе фтористого натрия в течение суток, а затем тщательно отмыть дистиллированной водой. Построение градуировочного графика. И з основного стандартного раствора фторида натрия с концентрацией 0,1 М методом последовательного десятикратного разбавления готовят растворы 10-2 М, 10-3 М,10-4 М, 10-5М, для чего 10 см3 раствора с более высокой концентрацией наливают в колбу на 100 см3 и доводят водой до метки. Полученные растворы имеют значения рF = 1, 2, 3, 4, 5. Все разбавленные растворы готовят в день анализа и хранят в полиэтиленовой посуде. Измерения начинают с самого разбавленного раствора с pF=5. В полиэтиленовый стакан вместимостью 50 см3 вливают 20,0 см3 рабочего градуировочного раствора, помещают в раствор магнит от магнитной мешалки, приливают 10 см3 ацетатно-цитратного буферного раствора, при перемешивании раствора магнитной мешалкой измеряют установившееся значение равновесного потенциала. После каждого измерения электроды тщательно несколько раз отмывают в дистиллированной воде. При выполнении измерений необходимо следить за тем, чтобы на поверхности мембраны фторидного электрода не налипали пузырьки воздуха. Время установления равновесного потенциала в диапазоне pF = 5 и выше составляет 10 мин, при более высоких концентрациях фторида, т.е. при pF менее 5, – 3 мин. Строят градуировочный график в координатах ЭДС, мВ– значение pF. Определение фторидов в анализируемой воде. В полиэтиленовый стакан вместимостью 50 см3 помещают 20 см3 анализируемой воды (температура воды не должна отличаться от температуры стандартных растворов, по которым калибруют электрод, более чем на ± 2 0 С, в противном случае воду следует подогреть или охладить). Затем помещают в раствор магнит, приливают 5 см3 буферного раствора и погружают в раствор тщательно промытые дистиллированной и анализируемой водой ионоселективный хлоридный и вспомогательный электроды. При перемешивании помощью магнитной мешалки измеряют ЭДС. По градуировочному графику находят значение рF анализируемой воды. Расчет. Концентрацию фторидов в воде (Х) в мг/дм3 рассчитывают по формуле:
где рF– показатель концентрации фторид-иона; найденный по графику; 35,5– молярная масса иона фтора, г/моль; 1000 – коэффициент перехода от граммов к миллиграммам.
Сульфаты Естественное содержание сульфатов в поверхностных и грунтовых водах обусловлено выветриванием и растворением серосодержащих минералов, в основном гипса, окислением сульфидов и серы, биохимическими процессами в водоносных слоях. В северных водоемах сульфатов обычно немного; в южных районах, где воды более минерализованы, содержание сульфатов увеличивается. Содержание сульфатов в водоемах может быть повышенным вследствие сброса в них серосодержащих сточных вод.В больших количествах сульфаты содержатся в шахтных водах и в промышленных стоках производств, в которых используется серная кислота. Концентрация сульфатов в природной воде изменяется в широких пределах. В речных водах и в водах пресных озер содержание сульфатов колеблется от 5 –10 до 60 мг/дм3, в дождевых водах– от 1 до 10 мг/дм3, в подземных водах содержание сульфатов часто значительно выше. Повышенное содержание сульфатов ухудшают органолептические свойства воды и оказывают слабительное действие на организм человека.
Лабораторная работа № 23 Турбидиметрическое определение сульфатов
Сущность метода. Используется реакция осаждения сульфат-иона хлоридом бария с образованием грубодисперсной формы сульфата бария; образующуюся суспензию стабилизируют путем добавления желатина.
BaCl2 + H2SO4 = BaSO4 ↓ + 2HCl Реактивы и оборудование Фотоколориметр Хлорид бария, насыщенный раствор Серная кислота, раствор с концентрацией сульфат – аниона 0,2 мг/см3 Желатин, 0,5 % раствор Мерные колбы на 100 см3 Мерная колба или пипетка Мора на 50 см 3 Бюретка на 25 см3 Пипетки на 2 и 5 см3 Всю посуду перед работой необходимо промыть дистиллированной водой! Ход определения. Построение градуировочного графика. Проверяют дистиллированную воду на наличие сульфатов пробой с BaCl2. Мерные колбы на 100 см3 ополаскивают дистиллированной водой, наливают по 2 см3 насыщенного раствора BaCI2, разбавляют водой и прибавляют по 3 см3 0,5% раствора желатина, перемешивают, добавляют 2 – 5 –10 –15 –20 см3 рабочего раствора серной кислоты с концентрацией сульфат – аниона 0,2 мг/см3, перемешивают, доводят дистиллированной водой до метки, перемешивают. Концентрация сульфат-иона в растворах будет 4;. 10; 20; 30; 40 мг/дм3, соответственно. Растворы фотометрируют через 5 минут при l = 364 (фиолетовый светофильтр) по отношению к раствору – фону, толщина кюветы 2 см. Строят градуировочный график в координатах оптическая плотность раствора – концентрация сульфат-иона SO4–2, мг/дм3 . Определение сульфатов в анализируемой воде. В мернуюколбу на 100 см3 наливают 50 см3 анализируемой воды, 3 см3 раствора желатина, перемешивают. Добавляют 2 см3 раствора BaCl2, доводят объем до метки дистиллированной водой, не содержащей сульфаты, перемешивают. Фотометрируют через 5 минут при l = 364 (фиолетовый светофильтр) по отношению к раствору – фону, толщина кюветы 2 см. При необходимости пробу воды уменьшают.
Расчет. Содержаниесульфатов в воде Х (мг/дм3) вычисляют по формуле: где С – концентрация анализируемого раствора, найденная по графику, мг/дм3; V пробы – объем воды, взятый для анализа, см3; V 1 – объем раствора, приготовленного для фотометрирования, см3.
Окисляемость Окисляемостью называется общее содержание в воде веществ минерального и органического характера, реагирующих с сильными окислителями. Количество кислорода, эквивалентное количеству расходуемого окислителя, есть величина окисляемости, которая выражается числом миллиграммов кислорода, идущего на окисление примесей, содержащихся в 1 дм3 воды (мг О2 /дм3). Образующиеся в водоеме и поступающие в него извне органические вещества весьма разнообразны по своей природе и химическим свойствам, в том числе по устойчивости к действию разных окислителей. Величина окисляемости природных вод зависит от общей биологической продуктивности водоема, от поступления в него органических веществ естественного происхождения из болот, торфяников и т.п., от степени загрязнения органическими элементами и биогенными элементами, поступающими со сточными водами. Она изменяется в пределах от долей миллиграммов до десятков миллиграммов в 1 дм3. Окисляемость незагрязненных поверхностных вод проявляет довольно отчетливую физико-географическую зональность: окисляемость воды в высокогорье и в горных районах очень мала, в тундре и степях средняя, в таежной зоне повышенная. Окисляемость подвержена закономерным сезонным колебаниям. В водоемах и водотоках, подверженных сильному антропогенному воздействию, изменение окисляемости выступает как характеристика, отражающая режим поступления сточных вод. В зависимости от применяемого окислителя различают перманганатную и дихроматную окисляемость. При определении перманганатной окисляемости окислителем является перманганат калия в кислой среде. Степень окисления перманганатом калия зависит от химической природы окисляемых веществ и может колебаться в широких пределах. Перманганатная окисляемость является очень хорошей характеристикой питьевых вод, а также вод рек, защищенных от попадания каких-либо промышленных отходов. В чистых родниковых и артезианских водах окисляемость обычно составляет от 1,0 до 2,0 мг О2/дм3. Оки
|
||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 832; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.41 (0.019 с.) |

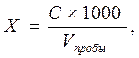
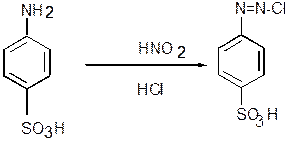
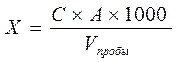 ,
,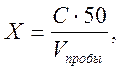
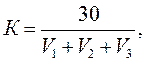
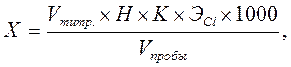
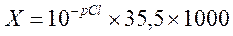 ,
, ,
,