
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
В дальнейшем будем пользоваться современной квантовой теорией строения атома,для чего рассмотрим основные понятия.Содержание книги
Поиск на нашем сайте
Атом – наименьшая частица химического элемента, сохраняющая все его химическиесвойства. Химический элемент – совокупность атомов с одинаковыми зарядамиядер. Атомы существуют в свободном состоянии, в соединенияхс атомами того же элемента или других элементов, образуя молекулы. Способность атомов вступать в химическое взаимодействие с другими атомами с образовыванием химических соединений определяется их строением. Атом состоит из ядра и электронной оболочки, образуя электронейтральную систему. Ядро атома содержитZпротонов и N нейтронов. Масса каждого из них равна ~1 атомной единице массы(а.е.м.), которая равняется 1/12 массы изотопа углерода12С – основного изотопа природного углерода. Нейтроны – частицы, не имеющие заряда; протоны имеют заряд +1 (1,602 · 10–19 Кл). Масса ядра складывается из масс протонов и нейтронов. Общее число протонов и нейтронов в атоме A = Z + N называется массовым числом. Практически вся масса атома сосредоточенав ядре. Заряд атомного ядра Z определяется суммарным зарядом протонов, число которыхв ядреравно номеру элемента в периодической системе Д.И.Менделеева. Число элекэлектронейтральном атоме равно числу протонов, т.е. соответствует номеру элемента в периодической системе. Движущийся электрон обладает свойствами как волны, так и частицы. Двойственная природа микрочастиц (электронов) в отличии от макротел основанана принципе неопределенности Гейзенберга: движущаяся микрочастица, как и волна, не имеет одновременно точных значений координат и импульса. Чем вышеточность определения скорости и импульса микрочастицы, тем больше одновременно полоса неопределенности ее пространственных координат: ∆ x ∆ p ≥ h /2 где ∆ x, ∆ p, ∆ v ─ cоответственно неопределенности в координате, импульсе и скорости микрочастицы. Двойственность (дуализм) свойств движущегося электрона проявляется в том, что он, с одной стороны, обладает свойствами частицы (имеет определенные массу,скорость и импульс), а с другой - его движение в отличие от макротел напоминает волну и может быть описано определенной амплитудой, длиной волны, частотой колебаний и т.д. Поэтому нельзя говорить о какой-то определенной траектории движения электрона, можно лишь судить о некоторой вероятности нахождения электрона в области пространства, представленной в виде электронного облака. Для характеристики энергии электрона в атоме и геометрической формы электронного облака введено понятие электронная, или атомная орбиталь (АО ) - область электронного облака, в которой наиболее вероятно пребывание электрона. Атомной орбитали соответствует конкретный вид одноэлектронной волновой функции, найденной решением уравнения Шрёдингера. Электроны, которые движутся в орбиталях близкого размера, образуют энергетические уровни (электронные или квантовые слои) и подуровни (электронные подслои).
2. Квантовые числа Состояние электрона в атоме описывается с помощью четырехквантовых чисел: главное квантовое число(n), орбитальное квантовое число (l), магнитное квантовое число (m), спиновое квантовое число (s).
Главное квантовое число Главное квантовое число (п) - характеризует энергетический уровень электрона,удаленность квантового электронного слоя от ядра и размер электронного облака, принимает ряд целочисленных значений 1,2, 3, 4,...
E = − hcRZ 2 / n 2, где R – постоянная Ридберга(3,29 ∙ 1015 с−1), hcR=13,6 эВ. С ростом n уровни энергии сближаются и при n → В периодической системе элементов число слоев(уровней),заселяемых электронами,соответствует номеру периода. При п= 1 электрон обладает самым низким уровнем энергии, самым малым размером электронного облака. Для каждого атома по номеру периода его расположения в периодической системе элементов можно узнать: - сколько энергетических уровней имеет атом, - какой энергетический уровень будет внешним.
Пример1. Для атомов 6С и 20Саопределить число энергетических уровней и внешний энергетический уровень.
Решение. Элемент6С находится во втором периоде, значит п= 2. То есть, атом углерода имеет два энергетических уровня распределения электронов Элемент20Са расположен в четвертом периоде, значит п = 4.Следовательно, его электроны распределены по четырем энергетическим уровням(слоям) и внешним энергетическим уровнем будет четвертый (п =4). Детальное исследование атомных спектров показало,что многие линии состоят в действительности из нескольких линий, так как L -уровень разделяется на два подуровня, М -уровень −на три подуровня и т.д. Значит, для характеристики состояния электрона в атоме недостаточно одного квантового числа.
Орбитальное квантовое число Второе квантовое число показывает, сколько дополнительныхподуровней имеет энергетический уровень с определенным значением главного квантового числа. Орбитальное квантовое число (l) определяет геометрическую форму электронного облака (атомной орбитали) и принимает целочисленные значения от 0 до (п - 1): l = 0, 1,2, 3,... (п - 1). Каждому значению орбитального квантового числа (независимо от номера энергетического уровня) соответствует энергетический подуровень и атомная орбиталь особой формы.
Пример 2. Укажите форму, название орбиталей и название подуровня для различных значений орбитального квантового числа. Решение. Для l = 0 s -подуровень, s -орбиталь, граничная поверхность в виде сферы; l = 1 р -подуровень, p -орбиталь, орбиталь-гантель; l = 2 d -подуровень, d -орбиталь, орбиталь сложной формы; l = 3 f -подуровень, f -орбиталь, орбиталь более сложной формы. Связь между значением l, обозначением подуровня и формой орбитали выглядит следующим образом:
0 s сферическая
1 p гантель
2 d розетка
Пример 3. Определите количество подуровней и форму орбиталей на 1, 2, 3-м энергетических уровнях. Решение. а) Первый энергетический уровень п = 1. Так как орбитальное квантовое число зависит от главного квантового числа и может меняться от 0 до п - 1, то для первого энергетического уровня оно будет иметь одно единственное значение б) Второй энергетический уровень п = 2. Для второго энергетического уровня орбитальное число может принимать два значения: l = 0, 2 s -орбиталь - сфера большего размера, чем на первом энергетическом уровне; l = 1, 2 p -орбиталь - гантель. Следовательно, на втором энергетическом уровне два подуровня: в) Третий энергетический уровень п = 3. Для третьего энергетического уровня орбитальное квантовое число может принимать три значения: 1 = 0, 3 s -орбиталь - сфера большего размера, чем на втором уровне; / l = 1, 3p-орбиталь - гантель большего размера, чем на втором уровне; Орбитальное число квантует орбитальный момент импульса электрона (квадрат его величины)согласно формуле Ml 2 = h 2 l (l +1) /4 π 2. Дополнительное расщепление некоторых спектральных линий происходит при нахождении излучающих атомов в магнитном поле, ука-зывая на необходимость введения третьего квантового числа.
Магнитное квантовое число
Магнитное квантовое число (т) - характеризует пространственную ориентацию электронной атомной орбитали и принимает целочислен-ные значения, но не произвольным образом, а в зависимости от квантового числа l (т.е. от формы орбитали), изменяясь от - l до + l включая 0: т= − l,...−1,0, +1,...+ l.
Для сферической s -орбитали (l = 0) такое положение одно и соответствует т = 0. Сфера не может иметь разные ориентации в пространстве. Для p-орбитали (l = 1) - три равноценные ориентации в пространствесоответственно при m = –1, 0 и +1 (если l = 1, то 2 l + 1 = 3). Три значения указывают на то, что р - орбитали этого подуровня ортогонально ориентированы по осям x, y, z, причем узел орбиталей совпадает с положеним ядра в атоме(см.рисунок).
Для d -орбитали (1 = 2) имемпять равноценных ориентаций в пространстве соответственно значениям т: −2, − 1,0, +1, + 2. Таким образом, на s -подуровне одна орбиталь, на р- подуровне три орбитали, на d -подуровне пять орбиталей, на f -подуровне семь орбиталей с одинаковой энергией. Такие орбитали называются вырожденными. Упрощая, орбиталь изображают в виде квадрата, называемого квантовой ячейкой. Тогда подуровни, с учетом значений m, выглядят так:
l Подуровень Квантовые ячейки
1 p 2 d 3 f
Магнитное число квантует проекцию орбитального механического момента Мl на вектор напряженности внешнего магнитного поля Н согласно формуле МН = hm /2 π. Когда три квантовые числа n, l, m заданы, волновая функция ψ( x, y, z), являющаяся решением уравнения Шрёдингера, описывает конкретный электрон атома и представляет собой математический аналог атомной орбитали. На кривых радиального распределения электронной плотности атомных орбиталей в координатах 4π r 2 ψ 2 - r наблюдаются максимумы, число которых равно разности n − l. Следует отметить, что максимум на такой кривой для 1 s − орбитали атома водорода соответствует сфере с радиусом первой «боровской орбиты» 0,053 нм, определяемым правилом квантования по Бору. ∙ Спиновое квантовое число
Экспериментально установлено, что атомные спектры щелочных металлов имеют дублетную структуру линий. Первоначально(Д.Уленбек и С.Гоудсмит, 1925 г.) это объяснялось тем, что в дополнение к орбитальному движению электрон вращается вокруг собственной оси подобно волчку и имеет с пин- собственный механичепский и магнитный момент. Квадрат спинового механического момента электрона
Ms 2 = h 2 S (S +1) / 4 π 2 определяется квантовым числом S = ½, а проекция этого моментана ось z Msz = msh /2 π − спиновым квантовым числом s,принимающим значения + 1/2 и −1/2. Как следует из теории Дирака(1928 г.), такие же результаты получаются без использования упрощенной модели волчка для электрона в атоме. Спиновое число s – квантовомеханическое свойство, связанное с магнитным полем электрона.Схематически спин электрона изображается стрелкой,направленной вверх ↑ или вниз ↓.
|
||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 104; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.83.96 (0.007 с.) |

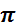 или ∆ x ∆ v ≥ h /2
или ∆ x ∆ v ≥ h /2 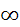 . Энергетические уровни (электронные слои) обозначают соответственно буквами К, L, M, N,…В соответствии со скачкообразным изменением числа n полная энергия электрона может принимать не любые, а «разрешённые» дискретные значения. Для одноэлектронных атомов водорода и водородоподобных катионов
. Энергетические уровни (электронные слои) обозначают соответственно буквами К, L, M, N,…В соответствии со скачкообразным изменением числа n полная энергия электрона может принимать не любые, а «разрешённые» дискретные значения. Для одноэлектронных атомов водорода и водородоподобных катионов l Подуровень Форма орбитали
l Подуровень Форма орбитали


