Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основные теории строения атомаСодержание книги Поиск на нашем сайте
Основы атомно-молекулярного учения впервые применительно к химии были разработаны в трудах М.В.Ломоносова (1741 г., Россия) и Джона Дальтона (1808 г., Англия). Дальтон предположил, что каждый химический элемент состоит из атомов, одинаковых по размерам и массе. Эти частицы предполагались неделимыми и неизменными в ходе химической реакции. Однако в конце XIX века был сделан ряд открытий, показывающих, что атом вовсе не является неделимой частицей. Эти открытия свидетельствовали о сложном составе атомов и о возможности их взаимопревращений. Сюда относится, прежде всего, открытие электрона английским физиком Дж.Томсоном в 1897 г. Еще в 1894 г. Дж. Стоней предположил, что электрический ток представляет собой поток отрицательно заряженных частиц, названных им электронами. Однако приоритет в этой области признается за Томсоном, который определил удельный заряд и относительную массу электрона. Электр о н – это частица, обладающая наименьшим существующим в природе отрицательным электрическим зарядом (1,602∙10-19 Кл). Масса электрона равна 9,110∙10-28 г, т.е. почти в 2000 раз меньше массы атома водорода. Было установлено, что электроны могут быть выделены из любого вещества: онислужатпереносчиками тока в металлах, обнаруживаются при нагревании, освещении или рентгеновском облучении многих веществ. Отсюда следует, что электроны содержатся в атомах всех элементов. Но электроны заряжены отрицательно, а атомы электронейтральны. Следовательно, в атомах, кроме электронов, должны содержаться какие-то другие частицы, заряженные положительно. Большую роль в установлении сложной природы атома и его структуры сыграло открытие и изучение радиоактивности. Радиоактивностью было названо явление испускания некоторыми элементами излучения, способного проникать через вещества, ионизировать воздух, вызывать почернение фотографических пластинок. Исследованиями супругов Кюри и Резерфорда было установлено, что радиоактивное излучение неоднородно: под действием магнитного поля оно разделяется на три пучка, один из которых не меняет своего первоначального направления, а два других отклоняются в противоположные стороны. Лучи, не отклоняющиеся в магнитном поле, и следовательно, не несущие электрического заряда, получили название g -лучей. Они имеют сходство с рентгеновскими лучами и обладают очень большой проникающей способностью. Два других луча отклонялись в магнитном поле; это указывает на то, что они состоят из электрически заряженных частиц. В состав одного пучка входят отрицательно заряженные частицы (b -лучи), а в состав другого – положительно заряженные (a -лучи). b -лучи оказались потоком быстро движущихся электронов. Это еще раз подтвердило, что электроны входят в состав атомов. Что касается положительно заряженных a -лучей, то как выяснилось, они состоят из частиц, масса которых равна массе атома гелия, а абсолютная величина заряда – удвоенному заряду электрона. В 1909г. английский физикЭрнест Резерфорд показал, что обнаруженное им ранее a -излучение обусловлено положительно заряженными атомами гелия. Однако, установление истинной природы этих положительных частиц произошло лишь в 1914 г. после знаменитого эксперимента Гейгера и Марсдена. В 1910 г. они проводили опыты, в которых бомбардировали тонкие листы золотой фольги пучком a -частиц. Одни a -лучи проходили через фольгу без отклонения, другие отклонялись от первоначального направления, а приблизительно 1 из 20000 частиц отклонялась назад. Из этого эксперимента следовало, что в центре атома находится очень малое положительно заряженное ядро, окруженное относительно удаленными от него отрицательно заряженными лёгкими э лектронами. ВпоследствииРезерфорд предсказал существование протона и показал, что его масса более,чем в 1800 раз должна превышать массу электрона. Существование нейтрона Резерфорд предсказал в 1920 г., объяснив различие между атомной массой и атомным номером элемента. Экспериментально нейтрон был обнаружен в 1932 г. Дж. Чедвиком при изучении бомбардировки бериллия a -частицами. Бериллий испускал при этом частицы с большой проникающей способностью, которые не отклонялись в электрическом и магнитном полях. Поскольку эти частицы были нейтральными, они получили название нейтронов. Итак, изучение радиоактивности подтвердило сложность состава атомов. Встал вопрос о строении атома и его внутренней структуре. В дальнейшем был выдвинут целый ряд моделей строения атома В 1903 г. Дж. Томсон предложил модель строения атома – модель «сливового пудинга». Она уподобила атом сферическому «пудингу» с положительным электрическим зарядом, в который вкраплены отрицательно заряженные шарики – электроны.
После эксперимента Гейгера и Марсдена в 1910 г. Резерфорд предложил другую модель, согласно которой атом состоит из очень плотного положительно заряженного ядра, окруженного облаком легких отрицательно заряженных электронов. Это ядерная планетарная модель атома:
Положительный заряд ядра нейтрализуется суммарным отрицательным зарядом электронов так, что атом в целом электронейтрален. Размеры ядра очень малы по сравнению с размерами атома в целом: диаметр атома – величина порядка 10-8 см, а диаметр ядра – 10-13-10-12 см. Уже из опытов Резерфорда следовало, что заряд ядра (выраженный в единицах заряда электрона) численно равен порядковому номеру элемента в периодической системе. Это было подтверждено Ридбергом и Мозли, установившими в 1913 г. простую связь между длинами волн определенных линий рентгеновского спектра элемента и его порядковым номером, и Д. Чедвиком, с большой точностью определившим в 1920 г. заряд атомных ядер ряда элементов по рассеянию a -частиц. Был установлен физический смысл порядкового номера элемента в периодической системе: порядковый номер оказался важнейшей константой элемента, равной положительному заряду ядра его атома. Из электронейтральности атома следует, что и число вращающихся вокруг ядра электронов равно порядковому номеру элемента. Развитая Резерфордом ядерная модель атома была крупным шагом в познании строения атома. Основные черты этой модели выдержали испытание временем и подтверждены большим числом экспериментов. Однако в некоторых отношениях модель Резерфорда противоречила твердо установленным фактам. Теория Резерфорда не могла объяснить устойчивость атома.Электрон, вращающийся вокруг положительно заряженного ядра, должен непрерывно излучать электромагнитную энергию,согласно классической электродинамике. Излучая, электрон теряет часть своей энергии, что приводит к нарушению равновесия между центробежной силой, связанной с вращением электрона, и силой электростатического притяженияэлектрона к ядру. Для восстановления равновесия электрон должен переместиться к ядру. Таким образом, электрон постоянно приближается к ядру и должен в конце концов упасть на него. Однако это не происходит. Модель Резерфорда приводила к неправильным выводам о характере атомных спектров. Согласно вышеизложенному, спектр излучения атома должен быть непрерывным, сплошным, а это не соответствует действительности. Таким образом, теория Резерфорда не смогла объяснить существование устойчивых атомов и наличие у них линейчатых эмиссионных спектров. В 1913 г. датский физик Нильс Бор развил планетарную модель атома, объяснившую его устойчивость и эмиссионный спектр водорода.
Строение атома по Бору
В своей теории Бор исходил из ядерной модели атома по Резерфорду и квантовой гипотезы М.Планка (1900 г.).На этой основе Бор предложил модель атома водорода. Постулаты Бора: 1. Электрон может вращаться вокруг ядра только по определенным круговым орбитам, называемым стационарными, для которых момент импульса электрона принимает только дискретные значения, кратные величине h/2π mvr = nh /2π, где m – масса электрона, v – его скорость, r – радиус стационарной орбиты, n – целое число, h – постоянная Планка(6,63 ∙10 −34 Дж∙с) Двигаясь по стационарной орбите, электрон не излучает электромагнитной энергии. 2. Поглощение и излучение атомом энергии происходит при скачкообразном переходе электрона с одной стационарной орбиты на другую. При этом испускается или поглощается квант электромагнитного излучения, энергия которого равна разности энергии атома в конечном и исходном состоянии. Принимая во внимание уравнение Планка E = h u ( гд е υ – частота излучения) имеем h u = EH-EK,или u =(EH-EK)/h.
Это уравнение позволяет вычислить возможные частоты (или длины волн) излучения, способного испускаться или поглощаться атомом, т.е. рассчитать спектр атома.Расчет спектра атома водорода был блестящим успехом теории Бора.И все же теория Бора страдала противоречивостью. 1) Непонятно, где находится электрон между начальной и конечной орбитой. 2) Несмотря на усовершенствования, внесенные Зоммерфельдом (возможность движения электрона в атоме не только по круговым, но и по эллиптическим орбитам), эта теория не смоглаобъяснить некоторыхважных спектральныххарактеристик многоэлектрон-ных атомов. Теория Бора показала, что нельзя автоматически распространять законы природы, справедливые для больших тел (объектов макромира) на ничтожно малые объекты микромира – атомы, электроны, фотоны.
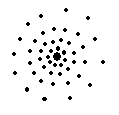
Волновой характер движения микрочастиц Начиная с середины 20-х годов ХХ века в развитии учения о строении атома наметился перелом, обусловленный влиянием волновой гипотезы, выдвинутой в 1924 г. французским физиком Луи де Бройлем. Если было известно, что каждая электромагнитная волна одновременно обладает свойствами частицы, то по де Бройлю имеет место и обратное: каждая движущаяся частица одновременно обладает свойствами волны. Корпускулярные свойства фотона выражаются уравнением Планка E = h u, согласно которому фотон неделим и существует в виде дискретного образования. Волновые же свойства фотона находят выражение в уравнении l u =c, где l – длина волны электромагнитного колебания; u – частота колебаний; c – скорость распространения света. Из этих соотношений получаем уравнение Е= hc / λ, связывающее корпускулярную характеристику фотона с его волновой характеристикой. Но фотон с энергией E обладает и некоторой массой m в соответствии с уравнением А.Эйнштейна(1905 г.) E =mc2. Из двух последних уравнений следует mc2= h c/ l, откуда l = h /mc, где mc – это импульс p. Тогда l = h /p. Согласно де Бройлю (1924 г.), корпускулярно-волновая двойственность присуща не только фотонам, но и электронам. Для них и других движущихся микрочастиц должно выполняться уравнение де Бройля l v = h /m v, где m –масса м икрочастицы, v – линейнаяскорость движения микрочастицы.Согласно уравнению де Бройля, с движением электрона со скоростью порядка 106 м/c ассоциируется волна длиной порядка 10−8 см, т.е. её длина соизмерима с размерами атомов. Открытие позднее дифракции электронов,протонов и нейтронов(рассеяния их кристаллами) подтвердило волновую гипотезу де Бройля. С движением макротел,напротив, ассоциируется волна настолько малой длины (10−27 см и меньше), что экспериментально волновой процесс обнаружить неудаётся. Исходя из представления о наличии у движущегося электрона волновых свойств, австрийский физик Э. Шрёдингер в 1925 г. предположил, что состояние электрона в атоме должно описываться уравнением стоячей электронной волны. Подставив в это уравнение вместо длины волны ее значение из уравнения де Бройля, он получил диф-ференциальное уравнение трехмерной волны,связывающеее энергиюэлектрона Е с пространственственными координатами и такназываемой волновой функцией y. Конкретный вид волновой функции ψ(x, y, z) находят обычно приближенным решением уравнения Шрёдингера. Волновая функция y подобно амплитуде любого волнового процесса может принимать как положительные, так и отрицательные значения. Но величина y 2 всегда положительна. Чем больше y 2, тем выше плотность вероятности нахождения электрона в данной точке внутри атома. Вероятность обнаружения электрона в некотором малом объеме D V выражается произведением y 2 D V. Чем больше величина y 2, тем гуще расположены точки.
Рис.1. Модель состояния электрона в атоме (электронное облако).
Это схематическое изображение электрона, «размазанного» по всему объему атома в виде так называемого электронного облака различной плотности пропорционально квадрату волновой функции. Электронное облако не имеет определенных, резко очерченных границ. Поэтому, подэлектронным облаком условно понимается область пространства вблизи ядра атома, в которой сосредоточена преобладающая часть заряда движущегося электрона. Чем прочнее связь электрона с ядром атома, тем электронное облако меньше по размерам и плотнее по распределению заряда.Обычно изображают граничную поверхность, охватывающую ~90% электронного облака.
Современные представления о строении атома В настоящее время для описания строения атома пользуются квантовой теорией. Реальный атом существенно сложнее квантовой модели,однако она имеет очевидные преимущества перед предшествующими моделями.
|
||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 88; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.119.34 (0.009 с.) |