Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Алканы. Гомологический ряд, изомерия, номенклатура, химические свойства.Содержание книги
Поиск на нашем сайте Алканы. Гомологический ряд, изомерия, номенклатура, химические свойства. Алканы – это углеводороды, в которых атомы углерода соединяются между собой простыми одинарными ϭ-связями. Оставшиеся валентности углеродного атома полностью насыщены атомами водорода. • Общая формула гомологического ряда: CnH2n+2 Гомологический ряд Метан СН4 – (Радикал) -СН3 Метил Этан С2Н6 – (R) С2Н5 Этил Пропан С3Н8 – (R) С3Н7 Пропил Бутан С4Н10 – R - С4Н9 Бутил Пентан С5Н12 Гексан С6Н14 Гептан С7Н16 Октан С8Н18 Нонан С9Н20 Декан С10Н22 Изомеры – это молекулы, имеющее одинаковый атомарный состав, но разное строение. Для алканов характерна только изомерия углеродного скелета. Н-р, n-пентан, 2-метилбутан, 2,2-диметилпропан Номенклатура В названиях всех представителей окончание –ан. Начиная с пентана названия углеводородов производятся от греческих или латинских числительных. При наименовании разветвлённых алканов необходимо пользоваться следующим алгоритмом: • Сначала находят главную цепь. Главная цепь – эта самая длинная неразветвлённая цепь. • Нумеруют атомы углерода в главной цепи, начиная с того конца, к которому ближе расположен боковой радикал. • После этого называют боковые радикалы. Если имеется только один боковой радикал. В этом случае вначале называют цифру, показывающую местоположение радикала, затем называют сам радикал (если название пишется, то между арабской цифрой и названием радикала ставится дефис), и в последнюю очередь называется алкан по главной цепи. Если есть несколько одинаковых радикалов, то вначале в порядке возрастания перечисляют цифры, показывающие положение радикалов, затем называют греческую приставкучислительное, соответствующую количеству радикалов, затем называют радикал. После этого называют алкан по главной цепи. Химические свойства Алканы являются устойчивыми неполярными молекулами с прочными ковалентными связями. Поэтому соединения этого класса самые инертные из всех углеводородов. Характерными реакциями являются реакции замещения, расщепления и окисления. Алканы неохотно вступают и в эти реакции, поэтому для их инициации необходимо нагревание, облучение или присутствие катализатора. 1. Реакции замещения • Галогенирование. Реакция идёт по радикальному механизму. Для инициации требуется ультрафиолетовое облучение. Под влиянием кванта света молекула галогена распадается на два радикала, каждый из которых в свою очередь атакует молекулу алкана. hν CH4 + Сl2 → CH3Cl(хлорметан)+ HCl hν CH3Cl + Сl2 → CH2Cl2(дихролметан) + HCl hν CH2Cl2 + Сl2 → CHCl3(хлороформ) + HCl hν CHCl3 + Сl2 → СCl4(тетрахлорметан) + HCl • Реакции нитрования (реакция Коновалова) Нитрование происходит с участием азотной кислоты (HNO3) при нагревании (порядка 140⁰С). В такой реакции атом водорода замещается на нитрогруппу (–NO2). H3C- CH2 -CH3 + HO - NO2-> H3C -CH -CH3 + H2O Замещение в первую \ NO2 2-нитропропан очередь идёт при третичном или вторичном атоме углерода 2. Реакции расщепления • Эти реакции проходят с разрывом углерод-углеродных или углеродводородных связей. В связи с этим различают реакции дегидрирования, термического разложения и изомеризации. • Дегидрирование При воздействии температуры и катализатора происходит отщепление молекулы водорода от алкана. При этом в молекуле алкана образуется двойная связь и он, таким образом, становится алкеном. (t⁰, Cr2O3) СН3 – СН3 (этан)->СН2 = СН2(этилен) + Н2 Этан Этилен • Термическое разложение (крекинг) При термическом разложении в молекуле алкана разрывается углерод-углеродная связь и из реакции выходят два продукта, один из которых – алкан, а второй – алкен. 500⁰С СН3 – СН2 – СН3 ->СН2 = СН2 + CH4 • Изомеризация Для того, чтобы это строение изменить, необходимо разорвать углерод-углеродные связи. Реакция идёт в присутствии катализатора – хлорида алюминия. AlCl3 H3C -CH2- CH2 -CH3 -> H3C -CH -CH3 | H3C 3. Реакции окисления В обычных условиях алканы практически не окисляются. В присутствии сильных окислителей в жёстких условиях способны окисляться только высшие алканы с образованием различных продуктов окисления – спиртов, альдегидов, карбоновых кислот. Однако алканы прекрасно вступают в реакции горения. Горение в присутствии большого количества кислорода 2СН4 + 3О2 ->2СО2 + 2Н2О 2С2Н6 + 7О2 ->4СО2 + 6Н2О При недостатке кислорода образуется окись углерода (угарный газ) 2СН4 + О2-> 2СО+ 2Н2
2 Алканы. Способы получения. Первые четыре представителя гомологического ряда – газообразные вещества. Их получают из природного газа и попутных нефтяных газов. С5 – С15 – жидкости. Они входят в состав нефти. Высшие алканы – твёрдые вещества, парафины. Они также встречаются в нефти в растворённом состоянии. 1. Гидрирование, или «сжижение» угля: (500⁰, оксиды железа) nС + 2nН2 ->СnН2n+2 2. Гидрирование алкенов. (Pt, 200⁰С) СН2=СН2 + Н2 ->СН3 –СН3 3. Синтез Ш.А. Вюрца СН3 –Cl + 2Na + Cl–CH3 ->СН3 – CH3 + 2NaCl 4. Сплавление солей карбоновых кислот со щелочами (Pt, t⁰)СН3 –COONa(ацетат натрия) + NaOH ->CH4 + Na2CO3 5. Крекинг (500⁰С) СН3 – СН2 – СН2 – СН3(бутан) -> СН3 – СН3(этан) + СН2 = СН2(этилен) 3. Алкены. Гомологический ряд, изомерия, номенклатура. Алкены – это углеводороды, в состав которых входит одна двойная связь, а все остальные – простые одинарные. В формировании этой двойной связи участвуют два соседних атома углерода, находящихся в состоянии sp2 - гибридизации. Двойная связь состоит из σ-связи и π-связи. Общая формула гомологического ряда алкенов: CnH2n где n ≥ 2 Гомологический ряд алкенов формируется аналогичным с алканами образом.(этен-бутен-пентен и тд) Номенклатура В названии линейных формул алкенов используются названия алканов с аналогичным количеством атомов углерода, но окончание - ан заменяется на -ен. Для низших алкенов приемлемы и устаревшие названия – этилен, пропилен, бутилен. Для наименования разветвлённых структур используется систематическая номенклатура: Главная цепь должна содержать двойную связь. Она не обязательно самая длинная в молекуле. • Нумерацию атомов углерода в главной цепи начинается с того конца, к которому ближе двойная связь. • В конце полного названия алкена цифрой через дефис указывают положение двойной связи. • Все остальные правила – как у алканов. Изомерия алкенов 1. Изомерия углеродного скелета. Гексен-1 - 3-метилпентен-1 2. Изомерия положения двойной связи (пентен-1 – пентен-2) 3. Геометрическая изомерия Этот вид изомерии возникает из-за того, что двойная связь является жёсткой структурой и ротация (вращение) вокруг двойной связи невозможна. Геометрическая изомерия возможна, если двойная связь не в крайнем положении.
4. Межклассовая изомерия Алкены изомерны циклоалканам, имеющим такую же эмпирическую формулу. (пентен-1 и циклопентан) Алкены. Способы получения 1. Дегидрирование алканов. (tº, Cr2O3) СН3 – СН3(этан) → СН2 = СН2(этилен) + Н2 ↑ 2. Термическое разложение (крекинг) алканов (t⁰) СН3 – СН2 – СН3(пропан) → СН2 = СН2(этилен) + CH4(метан) 3. Из однозамещённых галогеналкилов В реакции используется спиртовой раствор щёлочи. В результате получается три продукта реакции – алкен, соль (хлорид натрия) и вода. (у нас пример с калием, но это одно и тоже)
4. Из двузамещённых галогеналкилов Атомы галогенов отнимаются двухвалентным металлом, как правило, магнием или цинком.
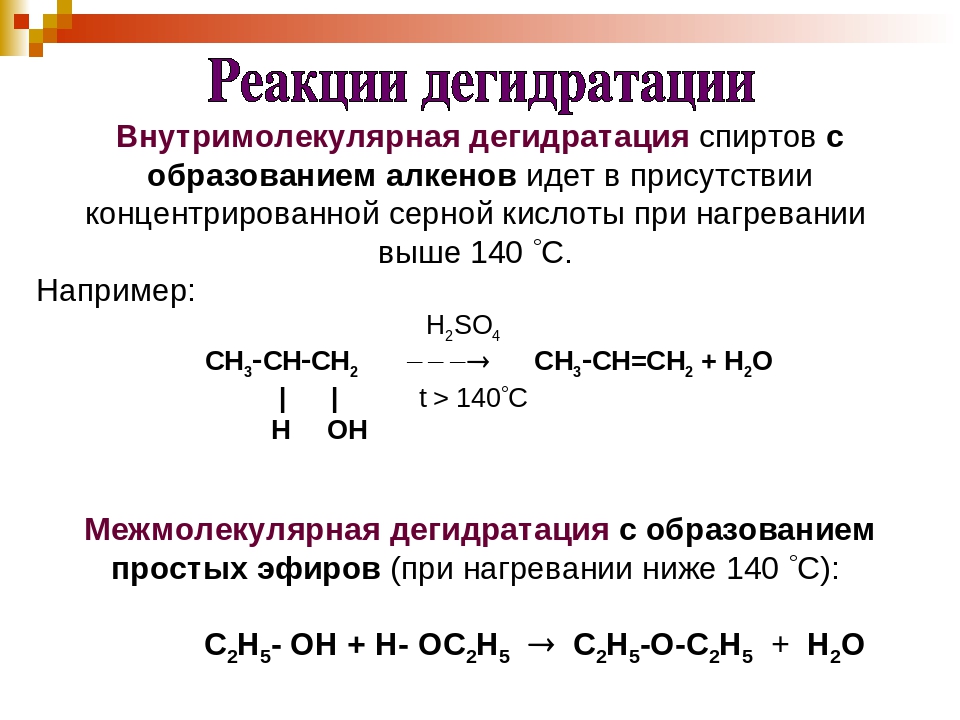
5. Дегидратация одноатомных спиртов • Сначала образуется сложный эфир с серной кислотой, затем выделяется серная кислота: H3C -CH2 -CH2 -OH + HO-SO3H + HO-SO3H-> H3C -CH2 -CH2 -O- SO3H + H2O t H3C CH2 CH2 O SO3H-> H3C- CH= CH2 + H2SO4
5. Алкены. Химические свойства Алкены, как соединения, имеющие ненасыщенную связь, легко вступают в реакции присоединения. Реакции замещения для этих молекул не свойственны. Кроме того, алкены вступают в реакции окисления и полимеризации. Реакции присоединения 1. Гидрирование. В этих реакциях происходит присоединение водорода к атомам углерода при двойной связи в присутствии катализаторов – платины или палладия. H3C -CH=CH2 (пропен)+ H2-> H3C--CH2 -CH3(пропан) 2. Галогенирование. Механизм галогенирования такой же, как и гидрирования, но присоединяются атомы галогенов. Реакция идёт без катализаторов. H3C -CH= CH2 + Br2 ->H3C -CH BR -CH2 Br (1,2-дибромпропан) 3. Гидрогалогенирование. Галогеноводороды присоединяются по правилу Марковникова. Водород присоединяется к более гидрированному атому углерода, а галоген – к менее гидрированному. H3C- CH= CH2 + HBr-> H3C -CH Br - CH3(2-бромпропан) 4. Гидратация. Это присоединение воды по месту двойной связи. Требуется катализатор – серная кислота. Присоединение идёт по правилу Марковникова. H3C -CH =CH2 + H-OH-> H3C- CH OH -CH3 (пропанол-2) Реакции окисления • Алкены в отличие от алканов способны окисляться в обычных условиях при воздействии сильных окислителей, таких, например, как перманганат калия. В результате такой реакции алкен окисляется до двухатомного спирта. Также алкены хорошо горят
Рисунок 1 Окисление в нормальных условиях. Реакция Вагнера
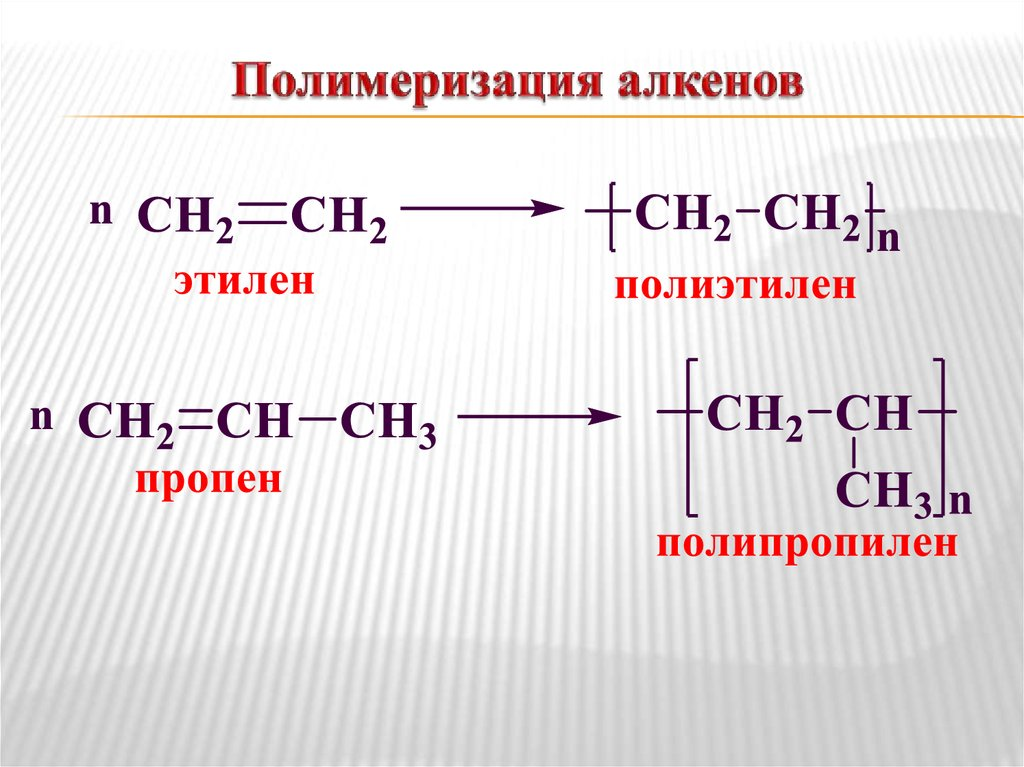
Реакция горения H2C =CH2 + 3O2-> 2CO2 + 2H2O Реакции полимеризации • Алкены легко полимеризуются. Для инициации полимеризации могут быть использованы свободные радикалы, анионы и катионы, а также смесь триэтилалюминия и солей титана. Самая простая реакция этого типа – полимеризация этилена. При этом разрывается двойная связь и присоединяется следующий мономер.
Изомерия Изомерия структорного скелета(пентин-1 и 3-метилбутин-1) Изомерия положения тройной связи (пентин-1 и пентин-2) Межклассовая с циклоалкенами, алкадиенами
Алкины. Способы получения. 1. Термическое разложение метана: 1500⁰ 2CH4 → СН ≡ СН(ацетилен) + 3Н2↑ 2. Из карбида кальция:
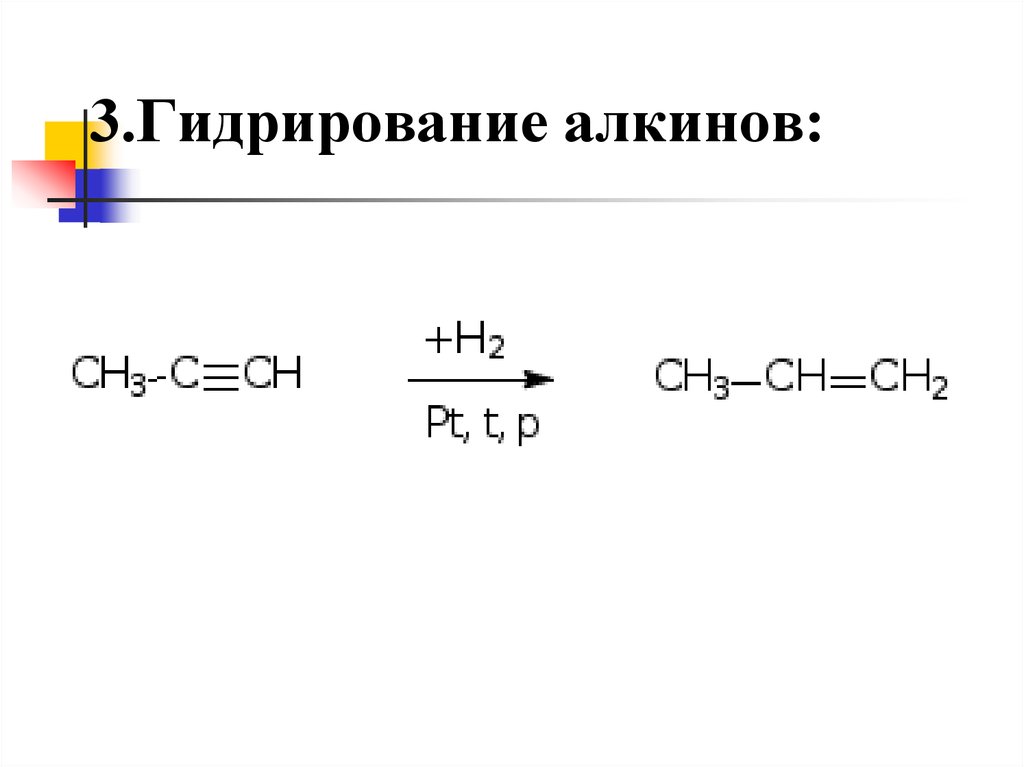
3. Из дигалогеналкилов H2C Br - CH Br - CH3 + 2NaOH(спиртовой раствор) ->HC=(тройная связь)-C -CH3 + 2H2 O+ 2NaBr Реакции присоединения 1 Гидрирование. Гидрирование алкинов приводит к образованию алкенов. В данном случае насыщение тройной связи происходит за счёт разрыва одной из π связей.
Галогенирование
3. Гидрогалогенирование идет по правилу Морковникова
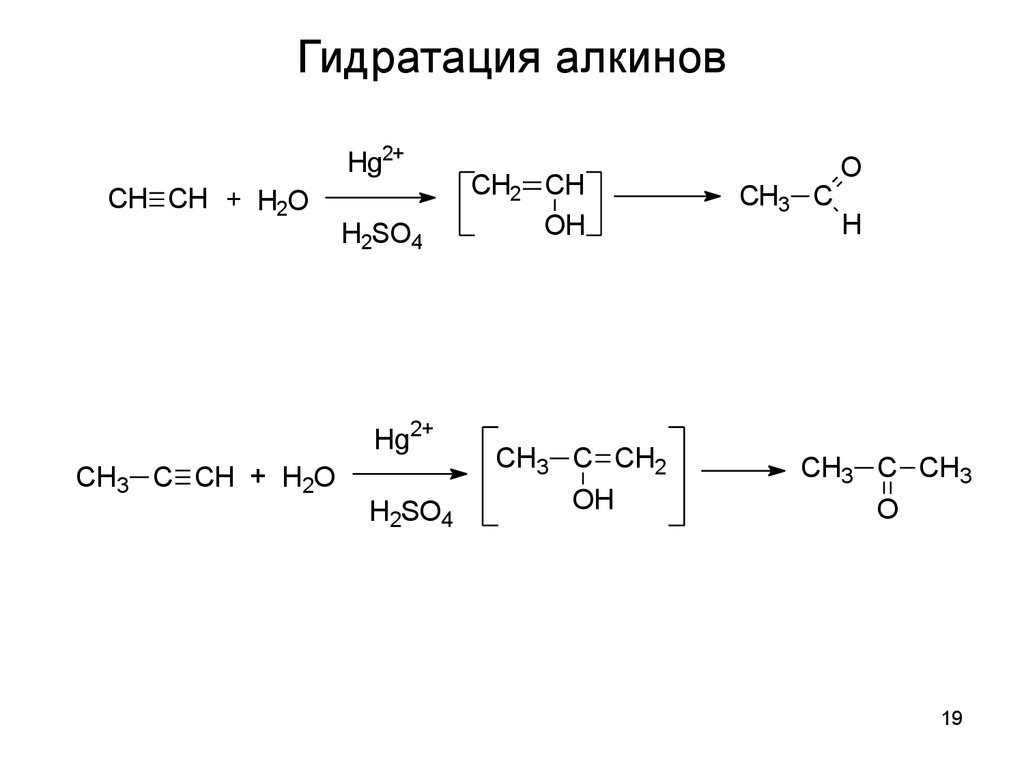
5. Гидратация алкинов Алкины способны присоединять воду, в реакциях этого типа действует правило Марковникова. Рассмотрим гидратацию ацетилена(первая реакция) . При присоединении воды образуется непредельный спирт, в данном случае – виниловый. Однако, если при одном и том же атоме углерода находится и двойная связь и гидроксигруппа, то такой спирт быстро перестраивается в более энергетически выгодный изомер – альдегид или кетон. В первой реакции уксусный альдегид. Если воду присоединяют гомологи ацетилена, то продуктом реакции является кетон. Например, при гидратации пропина образуется ацетон(вторая реакция)
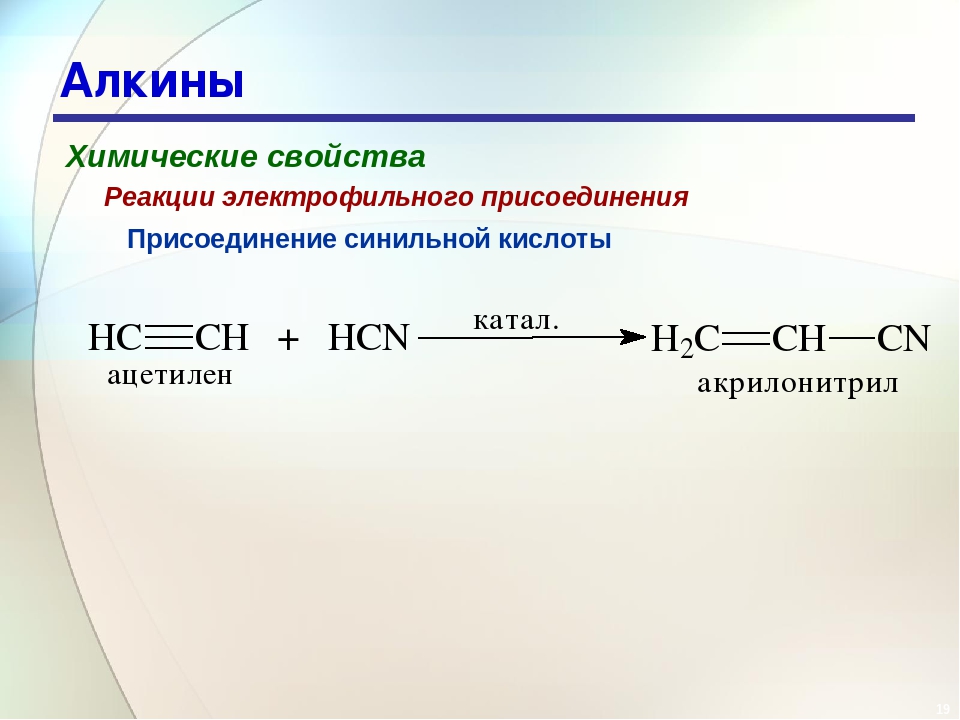
6. Присоединение синилной кислоты
Реакции замещения Так как тройная связь предполагает сильное смещение электронной плотности на себя, следовательно, каждый из атомов водорода в молекуле ацетилена приобретает некоторую подвижность. Более того, в отличие от одинарной, тройная связь оказывается поляризованной, поэтому становится возможным образовать связь с одновалентными металлами по типу ионной (реакцию см в презентации) Реакции окисления Алкины способны окисляться в обычных условиях. Подобно алкенам, алкины окисляются при воздействии перманганата калия: 3C2H2+ 10KMnO4 + 2H2O = 6CO2 + 10KOH + 10MnO2 Алкины горят, полностью окисляясь до углекислого газа и воды: 2 С2H2 + 5O2 =4СО2 + 2H2 O Реакции изомеризации Алкины вступают в реакции изомеризации, в результате которых происходит перемещение тройной связи. В качестве катализатора используется металлический натрий (спиртовой раствор).
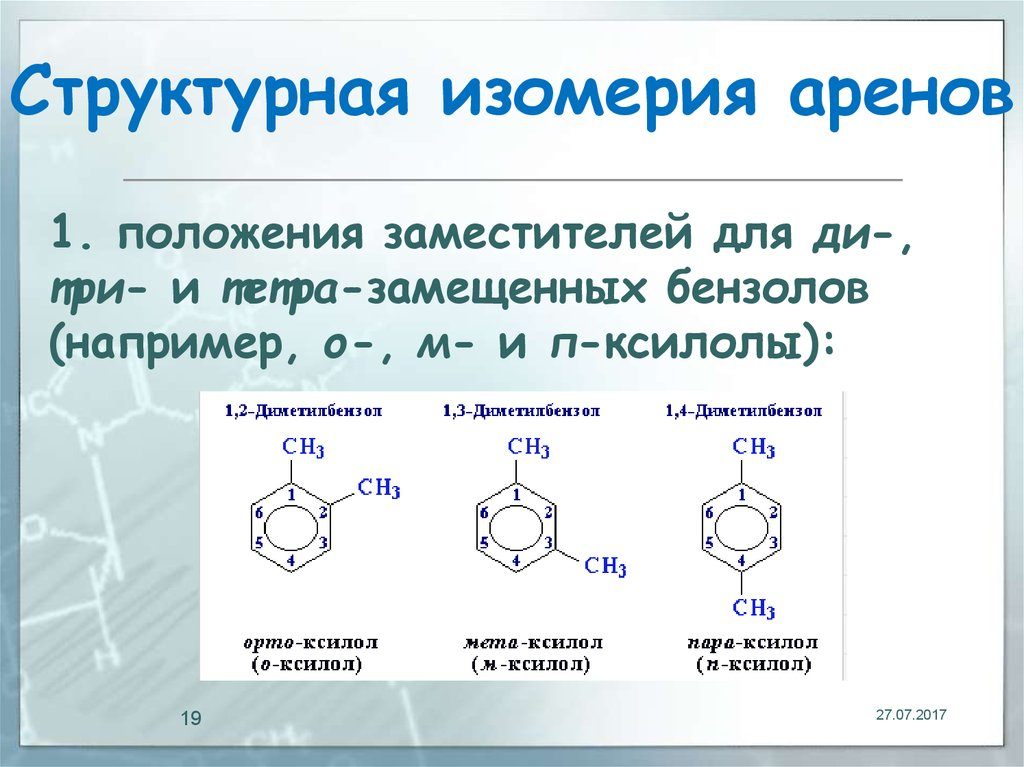
Вроде тоже самое что и 11 11.Терпены. Основные представители, их значение. Арены. Изомерия. Арены – это ароматические углеводороды, в которых циклическая структура образована системой сопряжённых двойных связей.
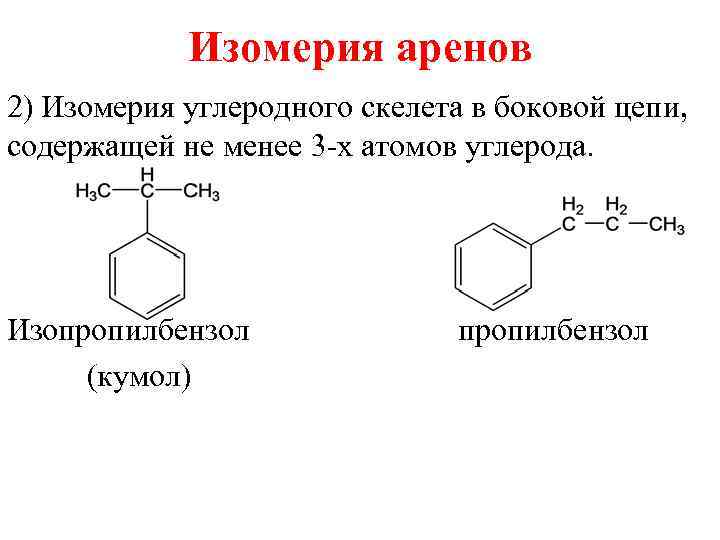
3.Количество боковых радикалов (пробилбензол и 1-метил-2-этилбензол)
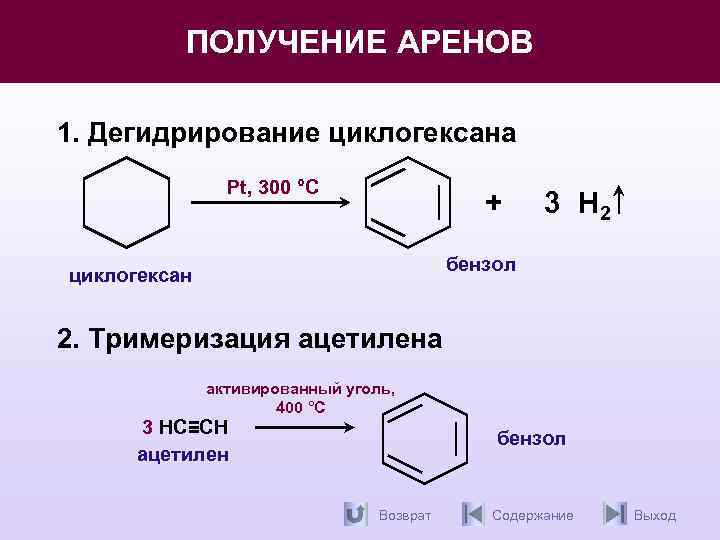
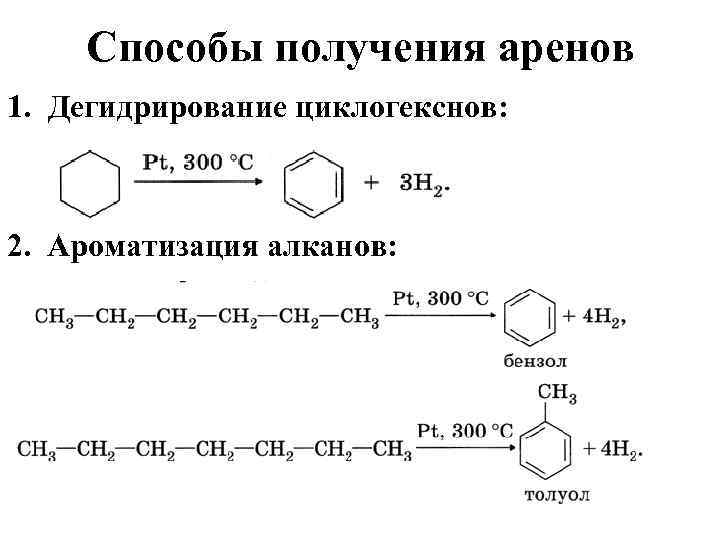
Арены. Методы получения.
Получение гомологов бензола Реакция Вюрца-Фиттинга
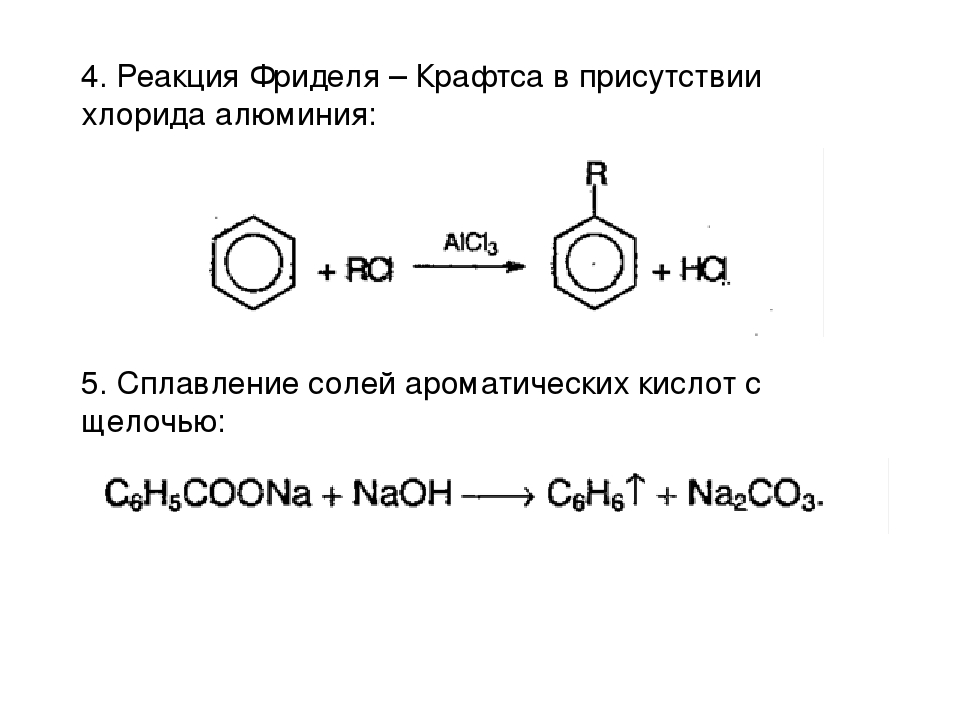
Реакция Фриделя-Крафтца
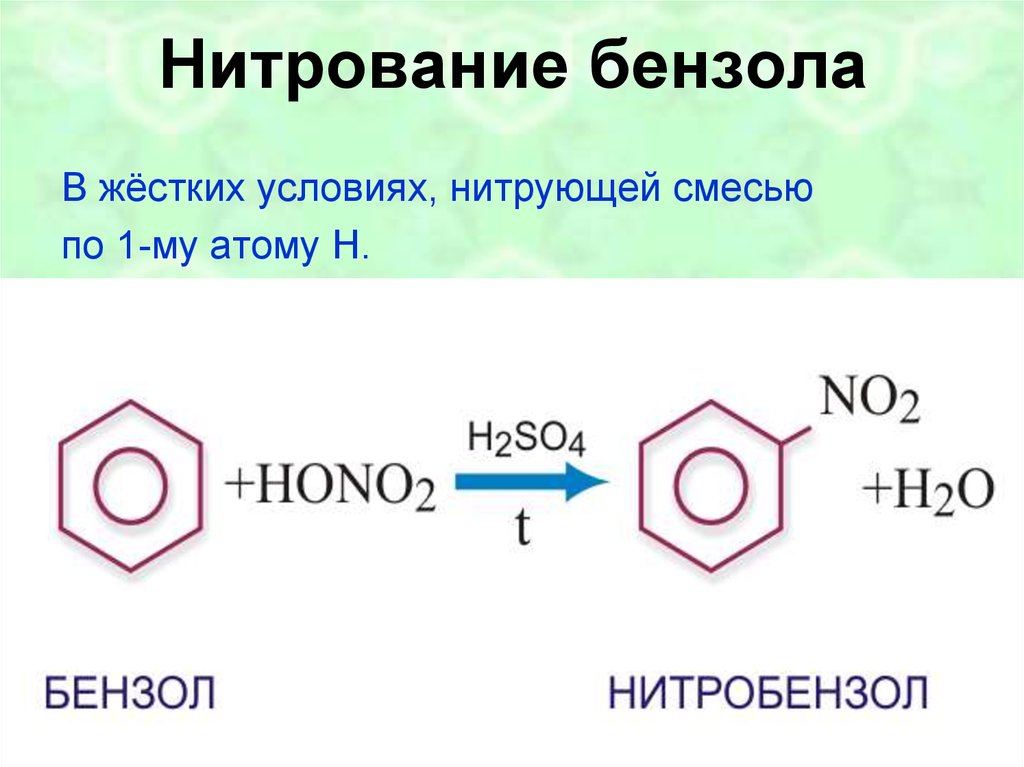
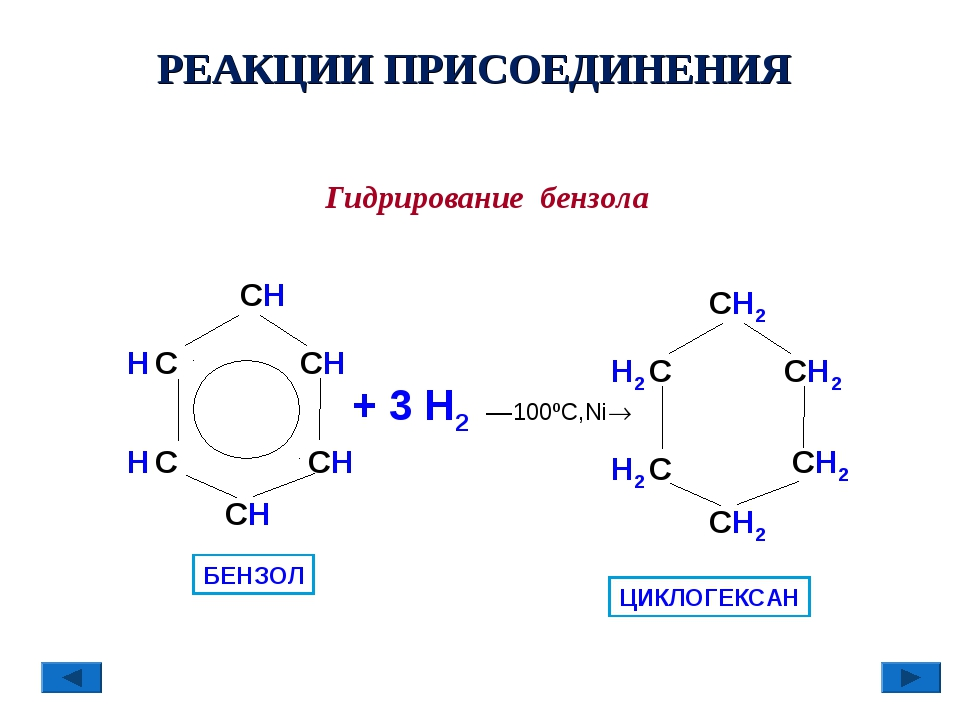
14.Арены. Химические свойства. Бензол в ХР проявляет инертность. По бензольному кольцу легче идут реакции замещения, чем присоединения
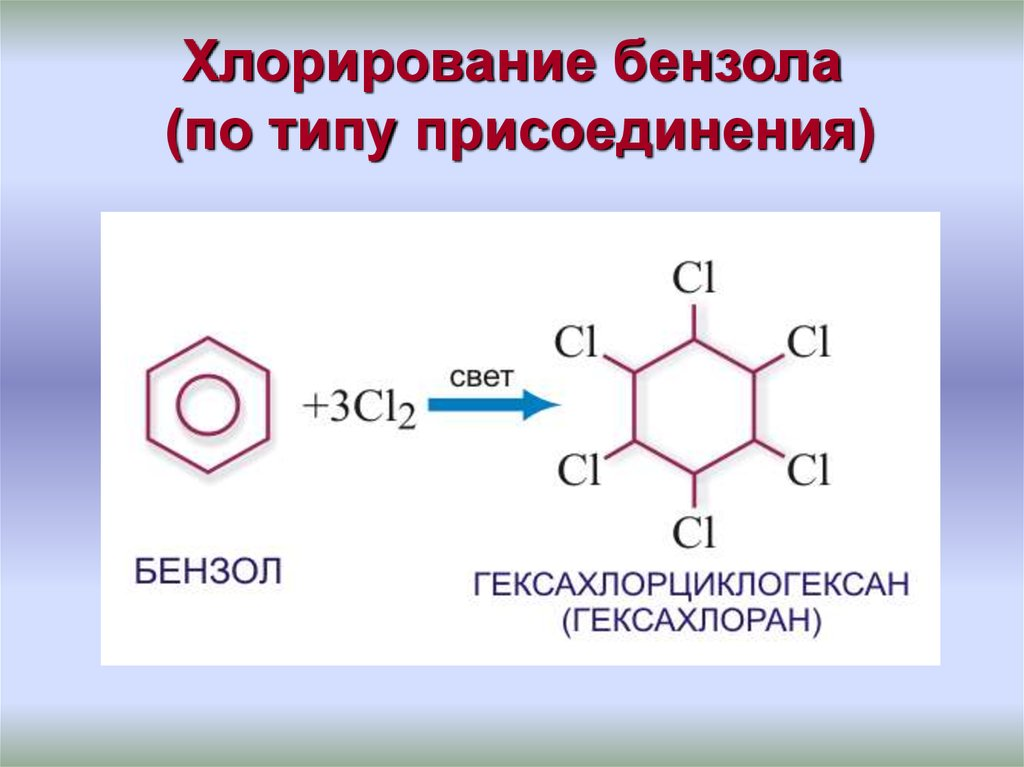
Реакции присоединения. Эти реакции не характерны для бензола, поэтому идут с большим трудом. Однако в жёстких условиях (высокая температура, облучение или присутствие катализатора) бензол проявляет слабовыраженный непредельный характер и может присоединять водород или хлор. Воду и галогеноводороды бензол не присоединяет.
Реакции присоединения Сама по себе молекула бензола весьма устойчива к действию окислителя. Обычные окислители не дйствуют на бензол, а под влиянием сильных окислителей (например, оксида ванадия (V) происходит разрыв кольца с образованием малеиновой кислоты.
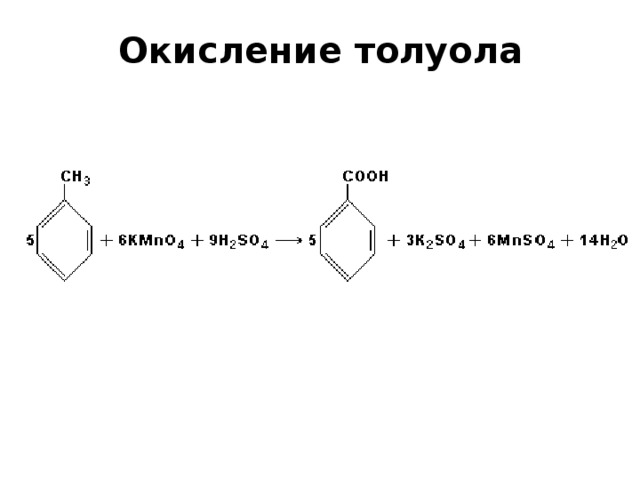
Гомологи бензола окисляются легко. При этом окисляется не кольцо, а боковая цепь. Вместо неё образуется карбоксильная группа.
Толуол Производные бензола
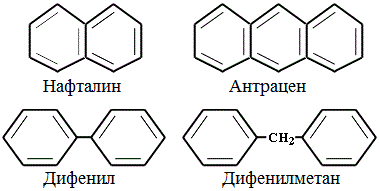
Нафталин - бесцветные кристаллы. Содержится в каменноугольной смоле и нефти. Важное сырье химической промышленности: применяется для синтеза многих органических красителей.
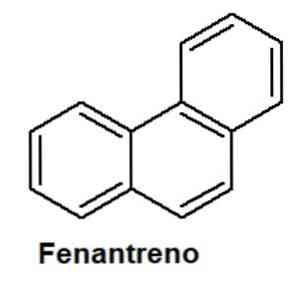
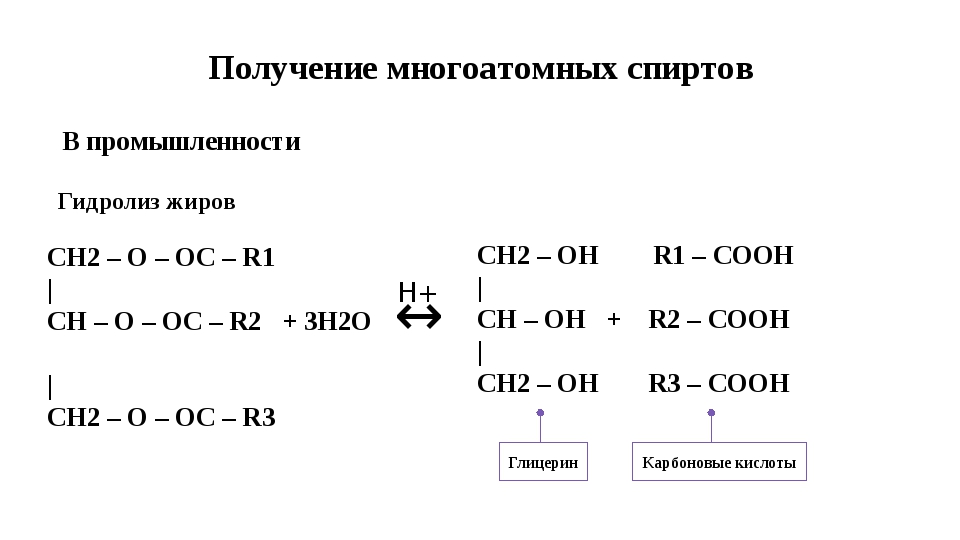
Фенантрен используется в фармакологии. Опиоидные препараты могут быть природного происхождения или производными фенантрена. Среди них морфин, кодеин и тебаин. не только фенантрен, но и все полициклические ароматические углеводороды, обычно известные как ПАУ, токсичны и вредны для здоровья. Они обнаруживаются в воде, на земле и в воздухе в результате сгорания, разливов нефти или как продукт реакций в промышленной сфере.. Токсичность возрастает по мере увеличения их цепей с конденсированными бензольными кольцами, хотя это не означает, что ПАУ с короткой цепью - нет.. Из бензола, который является фундаментальной структурной единицей этих соединений, уже известно его высокая токсичность и мутагенная активность у живых существ.. Нафталин, вызываемый против моли, используется в качестве средства борьбы с вредителями, которые нападают на ткани одежды. Антрацен - это микробицид, используемый в форме таблеток для противодействия запахам, вызываемым бактериями.. В случае фенантрена он накапливается в жировых тканях живых существ, создавая токсичность, когда человек подвергается воздействию загрязнителя в течение длительных периодов времени.. Спирты. Способы получения. Предельные одноатомные 1) Гидратация алкенов: CH2=CH2+ H-OH->CH3-CH2OH(этанол) 2) Щелочной гидролиз моногалогеналкиловв
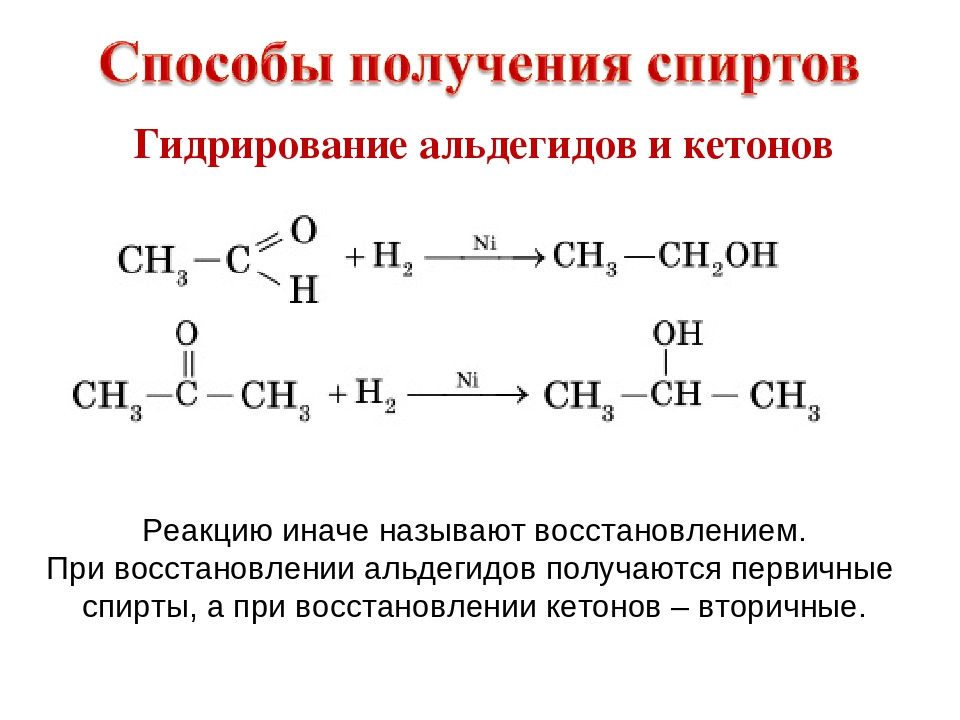
3) Гидрирование альдегидов и кетонов. Из альдегидов – первичные спирты, из кетонов – вторичные
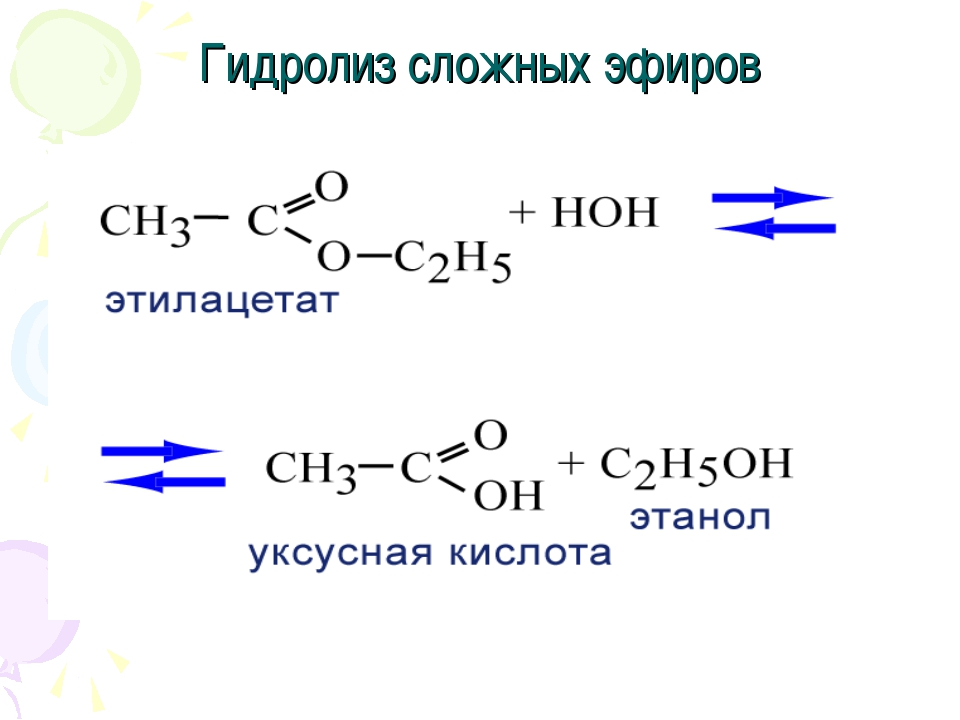
4) Гидролиз сложных эфиров
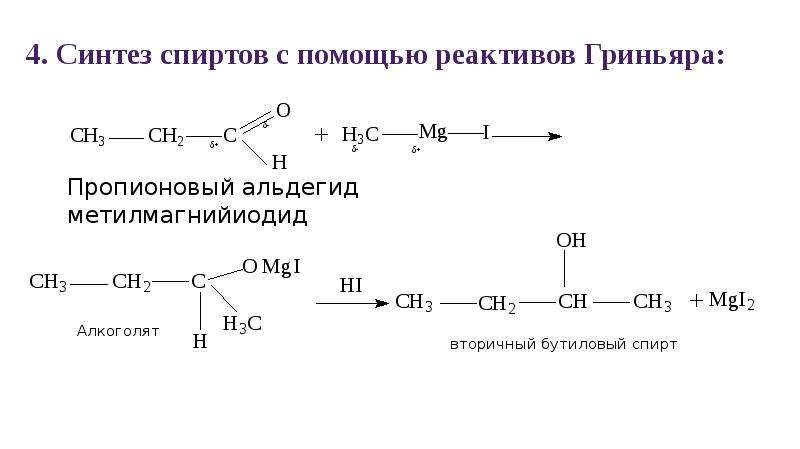
5) Синтез Гриньяра
Из альдегидов – первичные, кетонов – третичные 6) Брожение сахаров C6H12O6->ферменты 2C2H5OH + 2CO2 Предельные двухатомные Получение
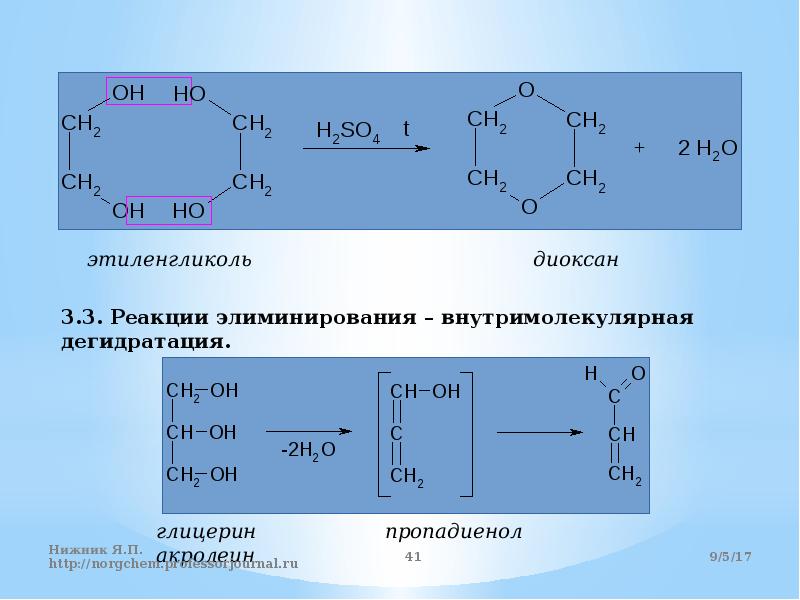
2) Г идратация алкенов(реакция Вагнера) СH2=Ch2+KMnO4+H20-> CH2OH-CH2OH(этандиол-1,2) + 2NaBr Предельные трехатомные
Из пропилена(лучше посмотрите в лекции, не нашла норм картинки) Одноатомные Р-ции на гидроксильный водород: Взаимод с щелочными МЕ: 2 CH3-OH+ 2Na -> 2CH3-ONa (метилат натрия) + H2 Образование сложных эфиров: CH3COOH+ CH3OH-> CH3-CO=O-CH3 (метил-ацетат) + H2O Образование простых эфиров(межмолекулярная дегидратация): CH3-OH + HO-CH3 -> CH3 – O-CH3 (диметиловый эфир) + H2O Один спирт отдает только гидроксильный водород, другой он группу Реакции на гидроксил Замещение на атом галогена: CH3-OH + PCl5 -> CH3-Cl + POCL3 + HCl Внутримолекулярная дегидратация
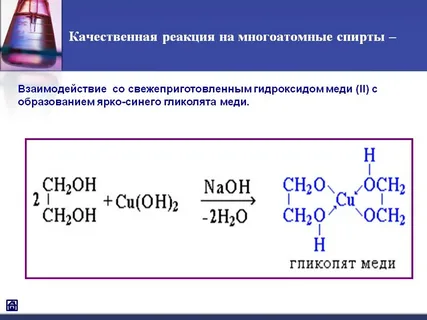
Межмолекулярная дегидратация: CH3-OH + HO-CH3 -> CH3 – O-CH3 (диметиловый эфир) + H2O Реакции окисления Первичные – до альдегидов, вторичные – до кетонов, третичные – с трудом Двухатомные Взаимод с Cu(OH)2
Реация дегидратации: внутримолек(2) и межмолек(1)
Т рехатомные ОБРАЗОВАНИЕ ГЛИЦЕРАТОВ
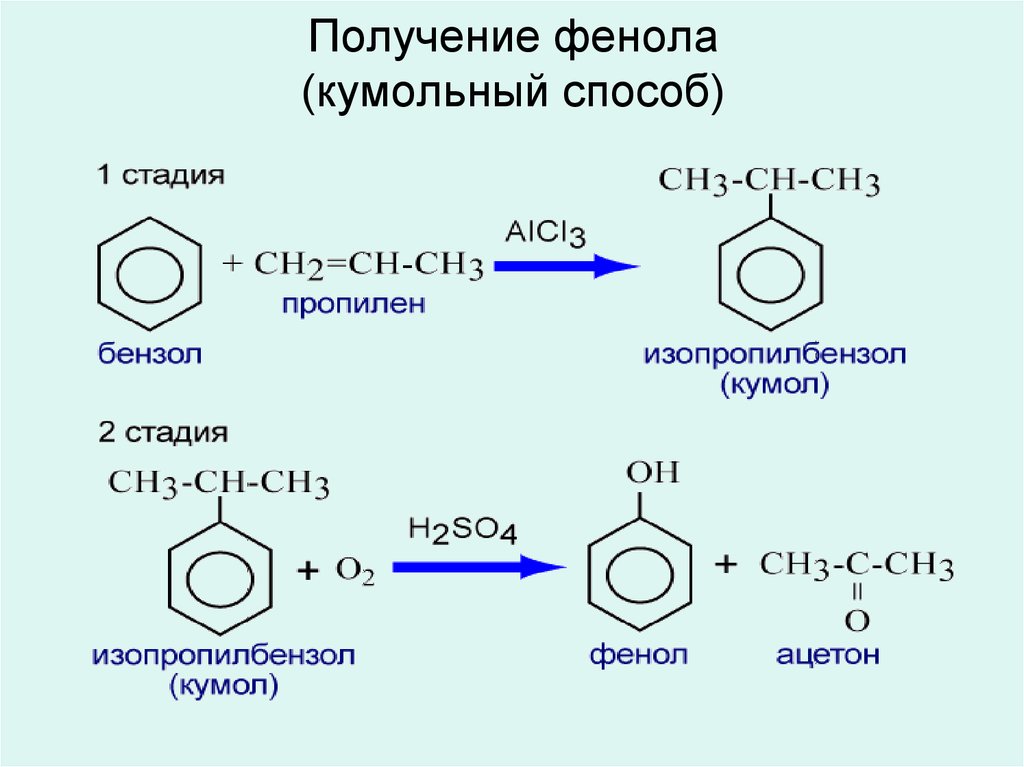
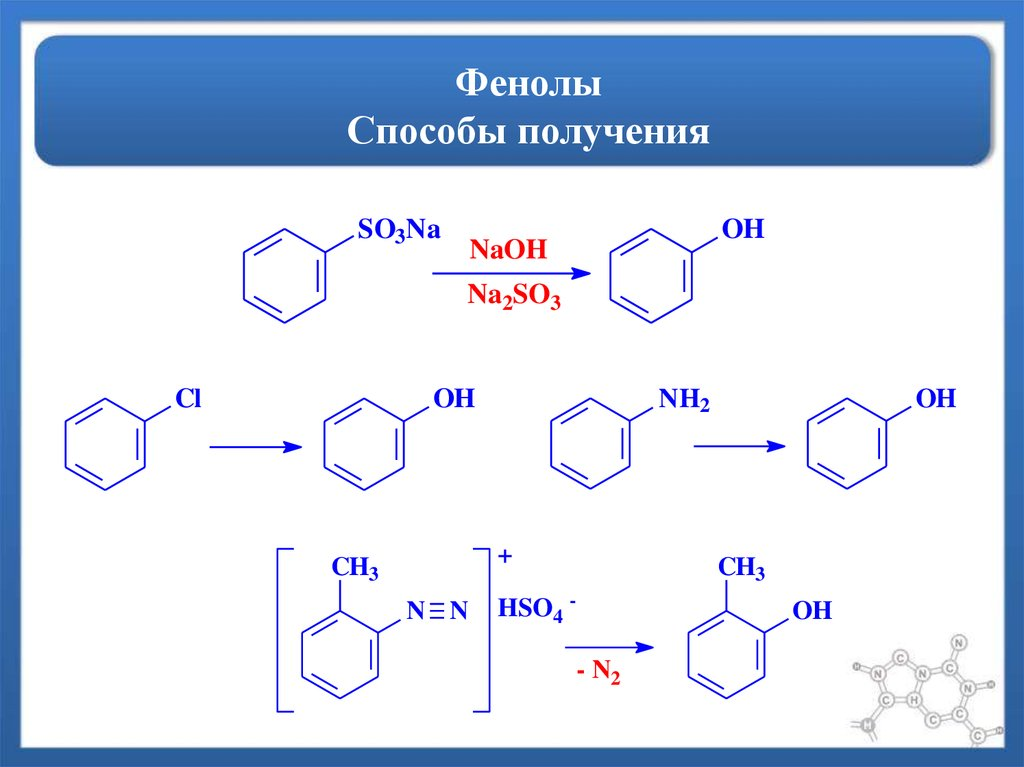
Фенолы. Способы получения.
1- Сплавление солей бензосульфакислот с щелочами 2- Воздействие щелочи на галогепроизводные бензола (там над стрелкой должен быть NaOH, под – NaCL) Гомологический ряд
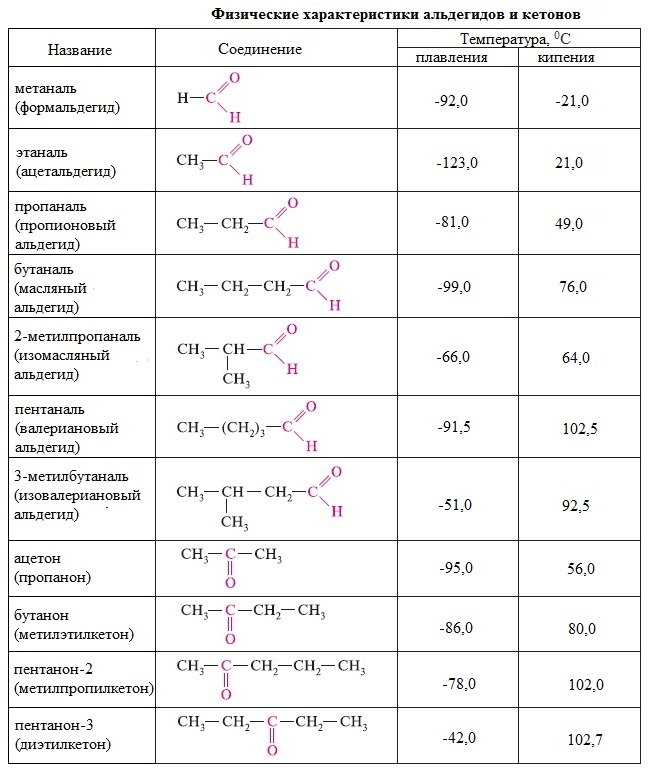
Изомерия: углеродного скелета Положения карбонильной группы(только у кетонов) Межклассовая(между собой) Номенклатура: В соответствии с номенклатурой ИЮПАК названия предельных альдегидов образуются из названия с помощью суффикса -аль. Нумерацию атомов углерода главной цепи начинают с атома углерода альдегидной группы. Наряду с систематической номенклатурой используют и тривиальные названия широко применяемых альдегидов. Эти названия, как правило, образованы от названий карбоновых кислот, соответствующих альдегидам. Для названия кетонов по систематической номенклатуре кетогруппу обозначают суффиксом -он и цифрой, которая указывает номер атома углерода карбонильной группы (нумерацию следует начинать от ближайшего к кетогруппе конца цепи).
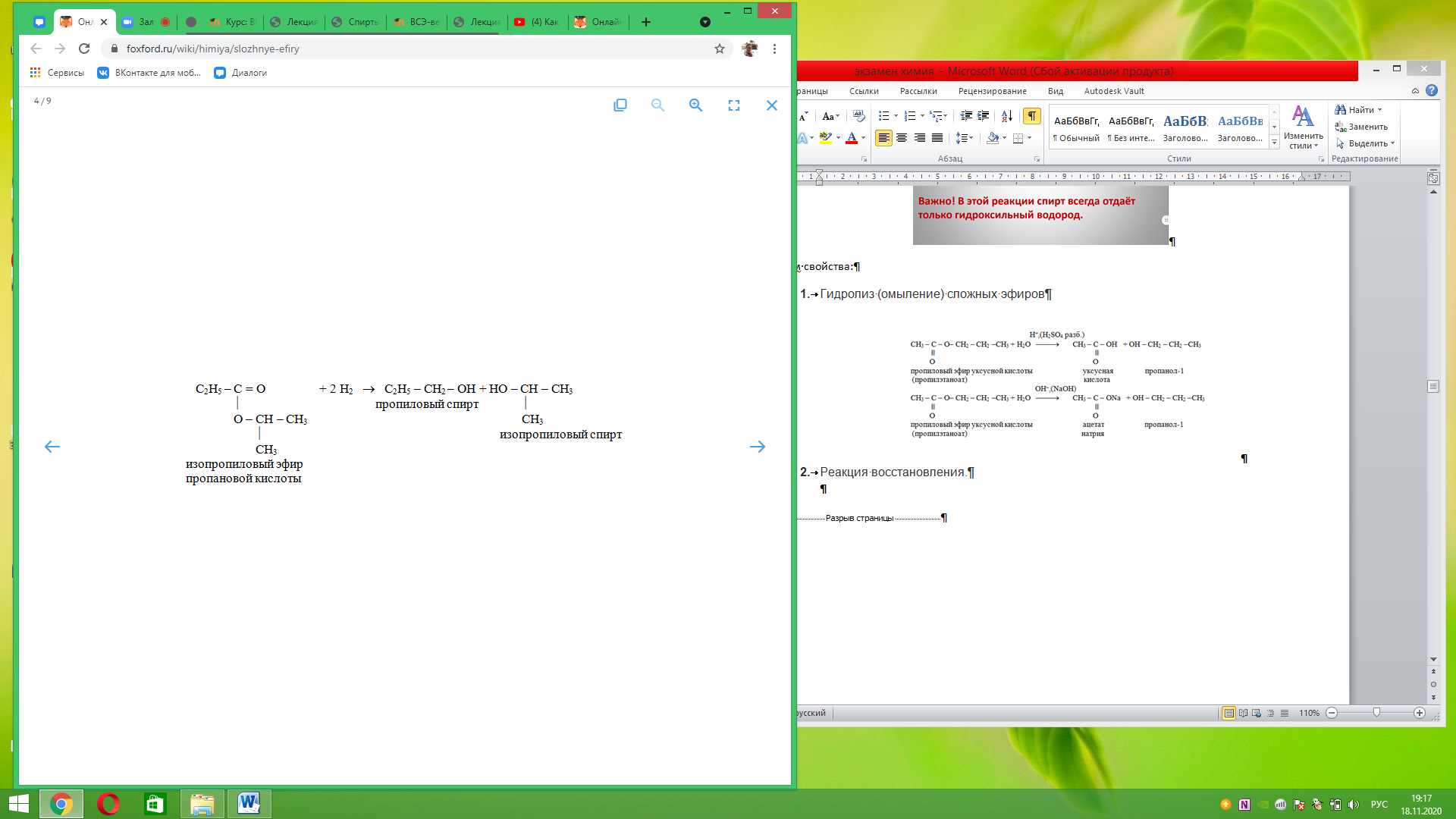
Реакция восстановления.
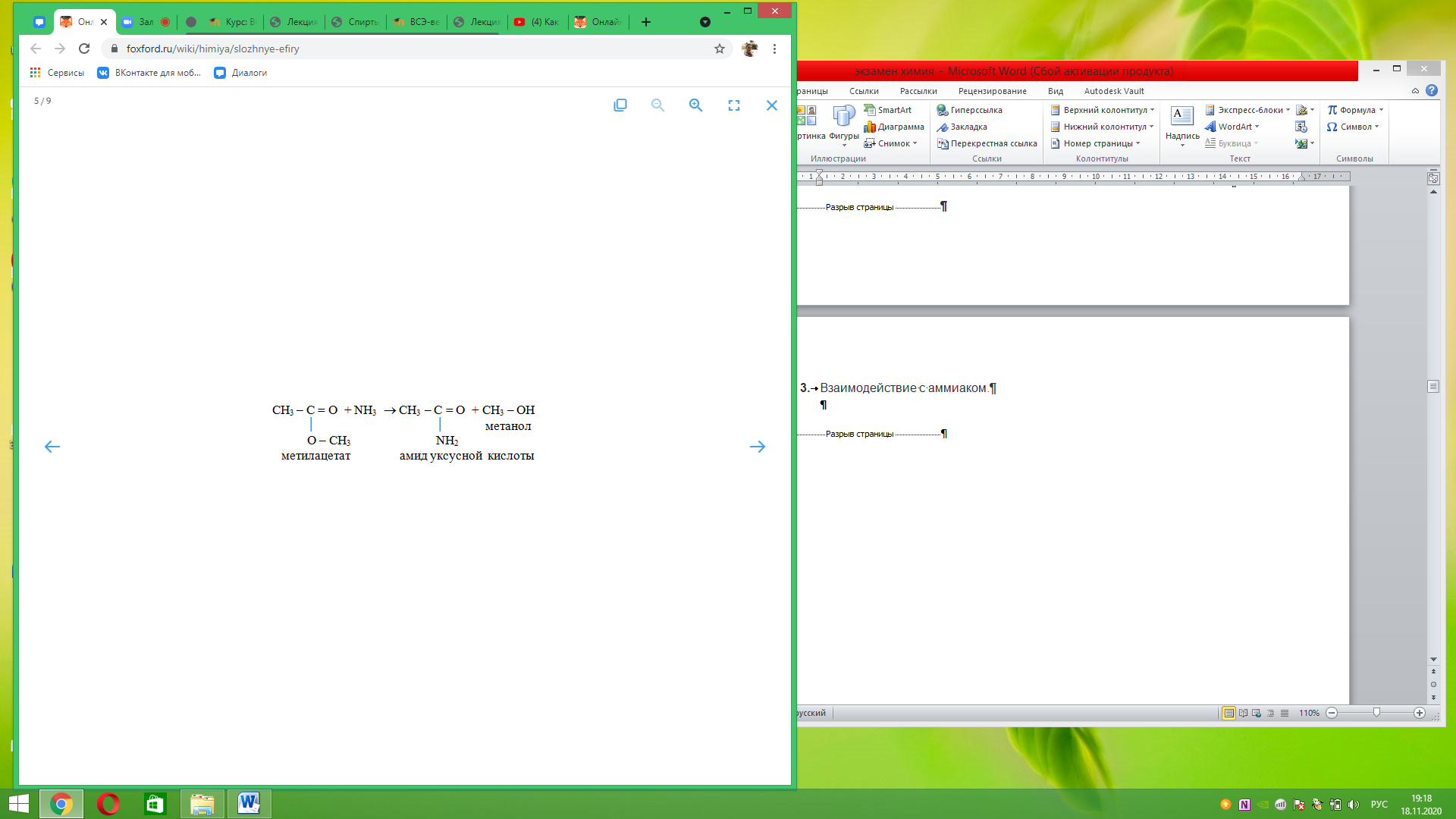
Взаимодействие с аммиаком.
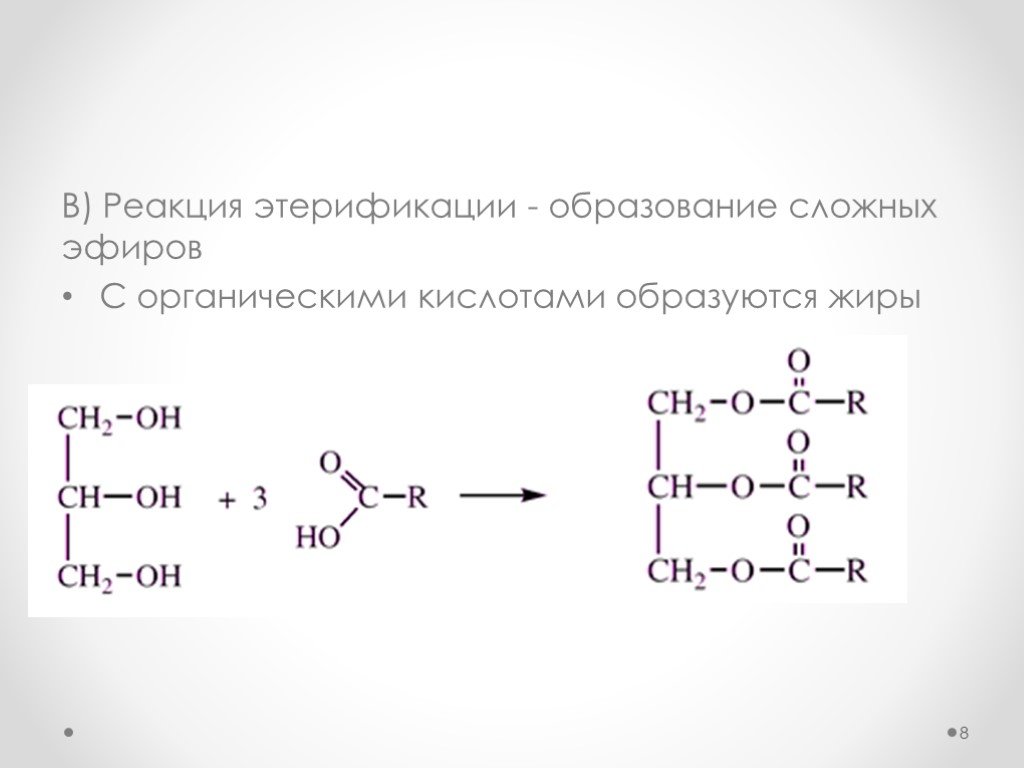
Сложные эфиры входят в состав эфирных масел многих растений и фруктов, придавая им специфический приятный запах Сложные эфиры на основе низших спиртов и кислот используют в пищевой промышленности при создании фруктовых эссенций, а сложные эфиры на основе ароматических спиртов – в парфюмерной промышленности В значительных количествах сложные эфиры представлены в природе восками. Основа природных восков - эфиры высших одноосновных кислот и высших одноатомных спиртов. Например, пчелиный воск содержит сложный эфир пальмитиновой кислоты и мирицилового спирта (мирицилпальмитат):
Пуриновые нуклеотиды.
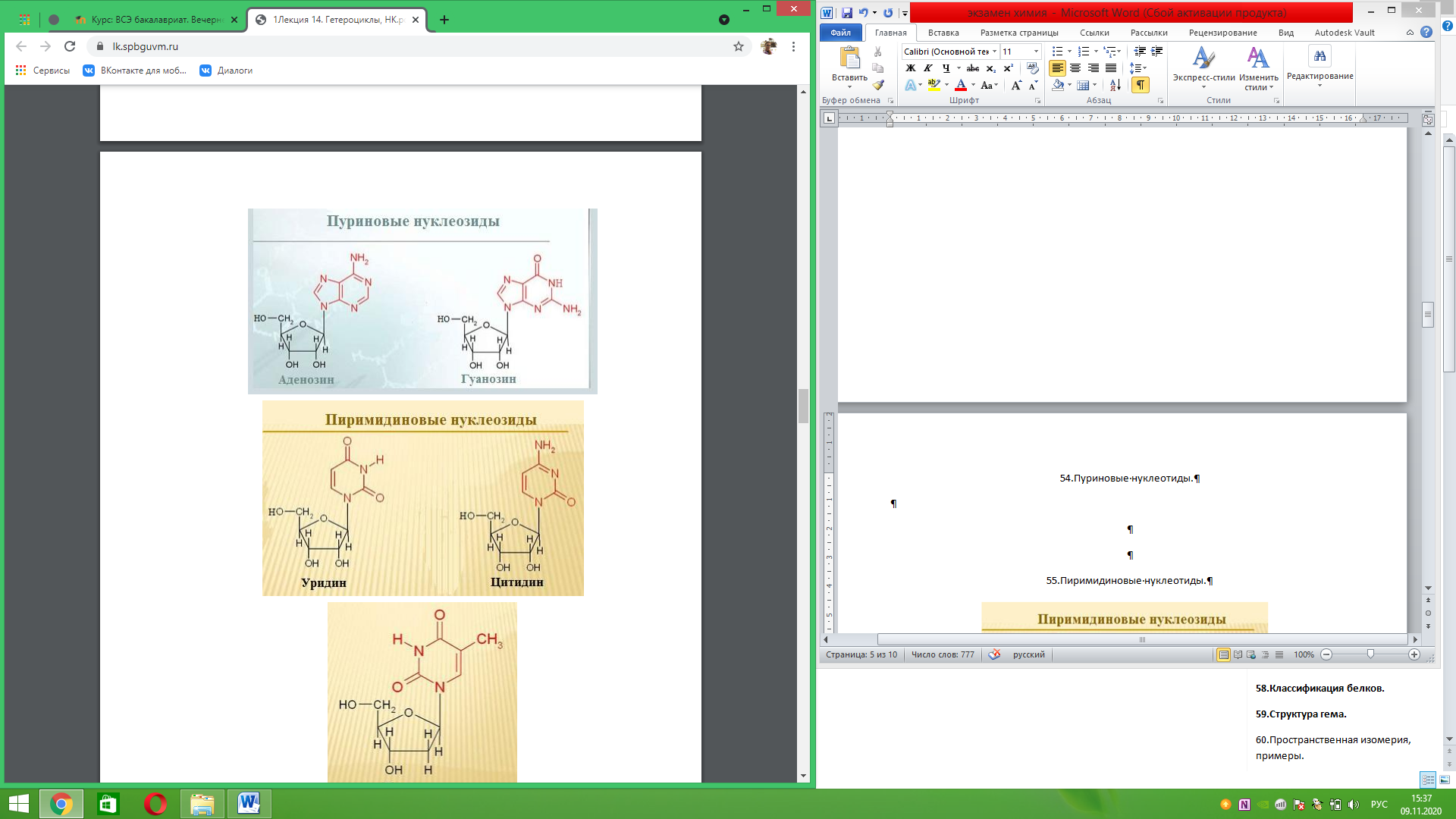
Пиримидиновые нуклеотиды.
Классификация белков. Белки разделяют на простые и сложные. Простые белки состоят только из аминокислот, а сложные белки содержат небелковую часть. В зависимости от химической природы небелковой части сложные белки подразделяют на следующие группы: Фосфопротеины, Металлопротеины, Гликопротеины, Хромопротеины, Липопротеины, Нуклеопротеины
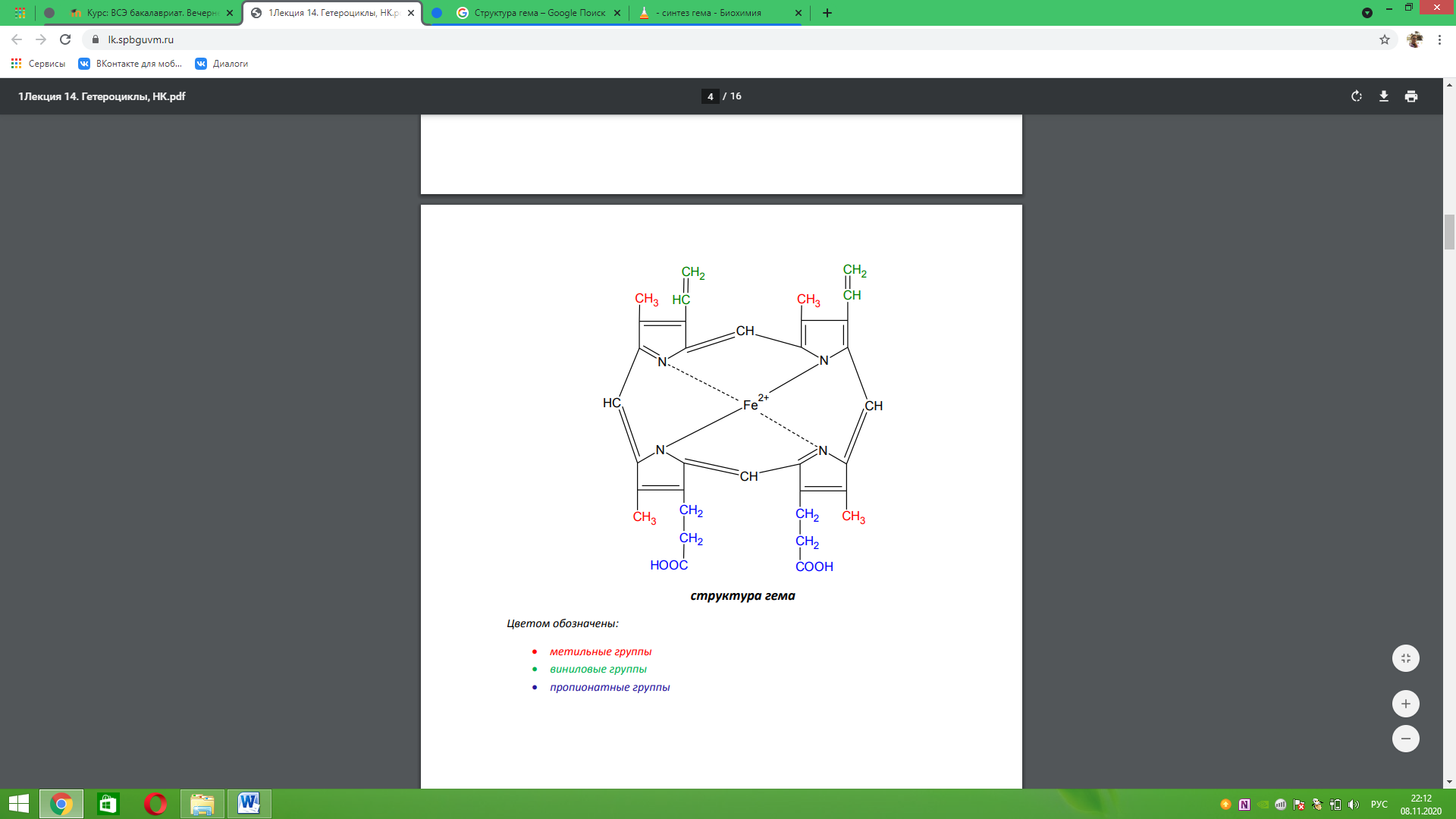
Структура гема. Циклы, в состав которой входят четыре пиррольных цикла, объединены метиновыми мостиками в один большой цикл, который в совокупности с боковыми группировками и ионом железа является гемом. Боковые группы при пиррольных циклах представлены четырьмя метильными, двумя виниловыми группами и двумя протионатными группами.
60.Пространственная изомерия, примеры. Пространственная изомерия (стереоизомерия) — вид изомерии, при котором молекулы веществ, обладающие одинаковым составом и одинаковым химическим строением, отличаются различным расположением заместителей в пространстве.
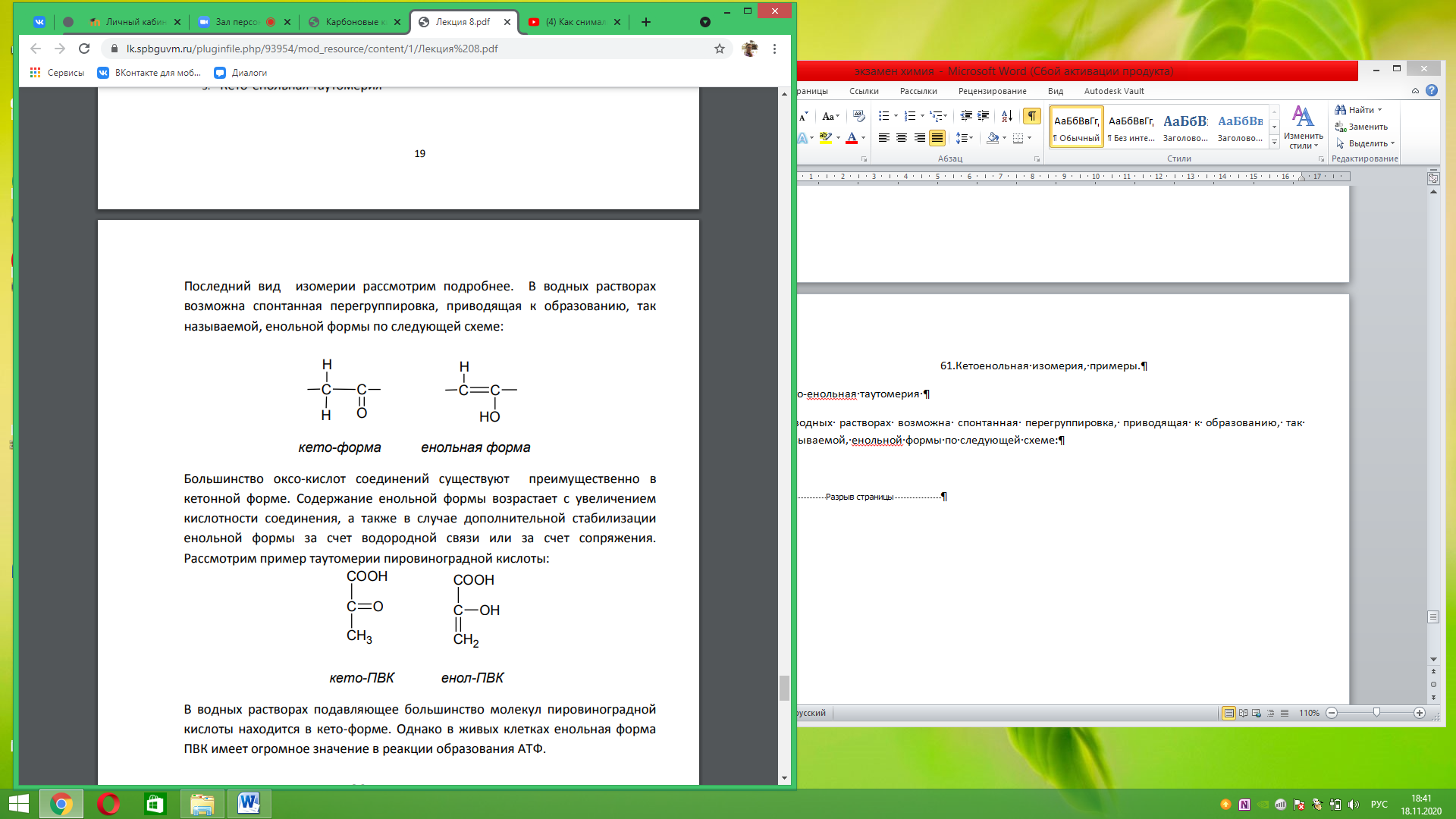
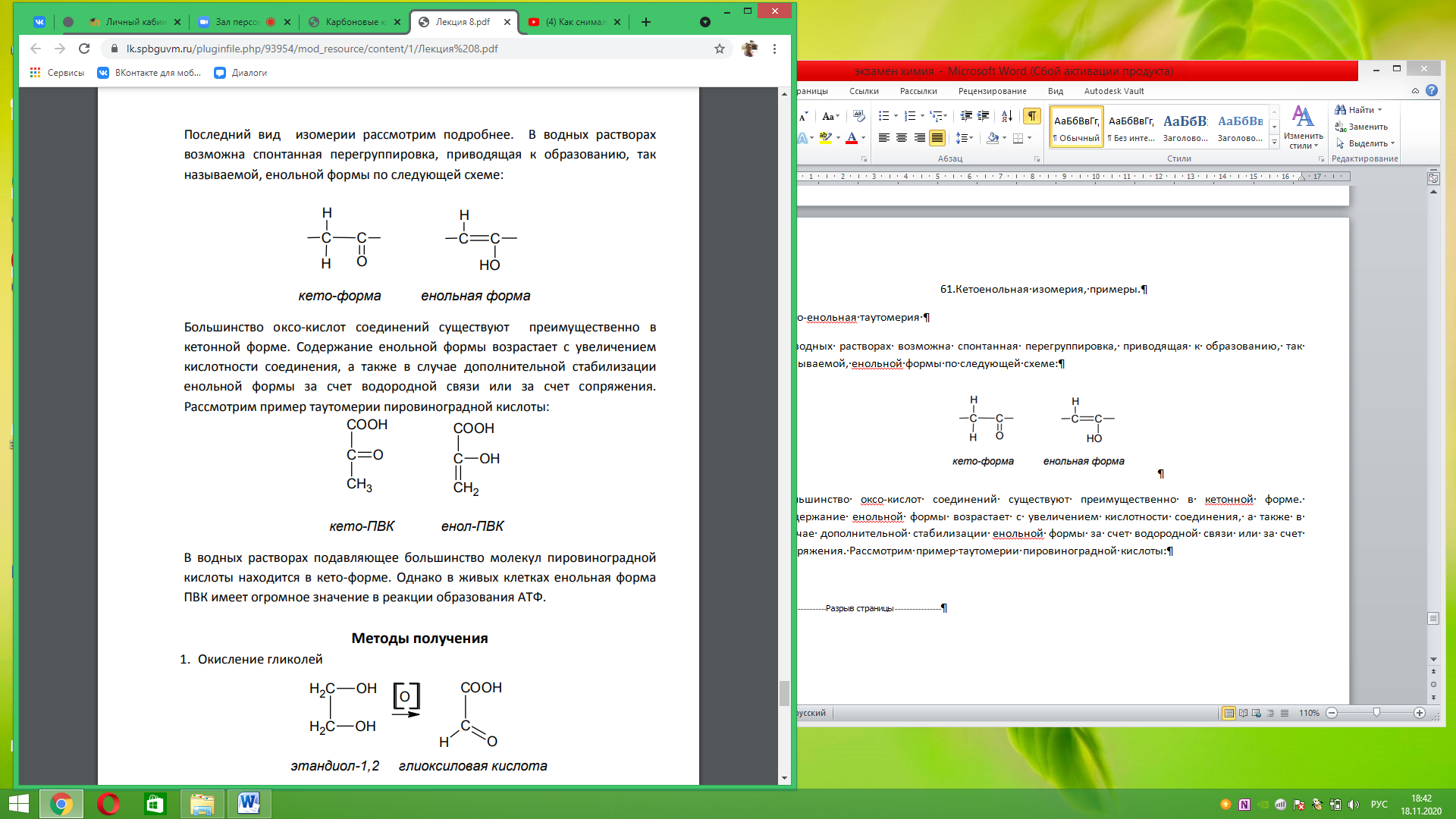
61.Кетоенольная изомерия, примеры. Кето-енольная таутомерия В водных растворах возможна спонтанная перегруппировка, приводящая к образованию, так называемой, енольной формы по следующей схеме:
Большинство оксо-кислот соединений существуют преимущественно в кетонной форме. Содержание енольной формы возрастает с увеличением кислотности соединения, а также в случае дополнительной стабилизации енольной формы за счет водородной связи или за счет сопряжения. Рассмотрим пример таутомерии пировиноградной кислоты:
В водных растворах подавляющее большинство молекул пировиноградной кислоты находится в кето-форме. Однако в живых клетках енольная форма ПВК имеет огромное значение в реакции образования АТФ.
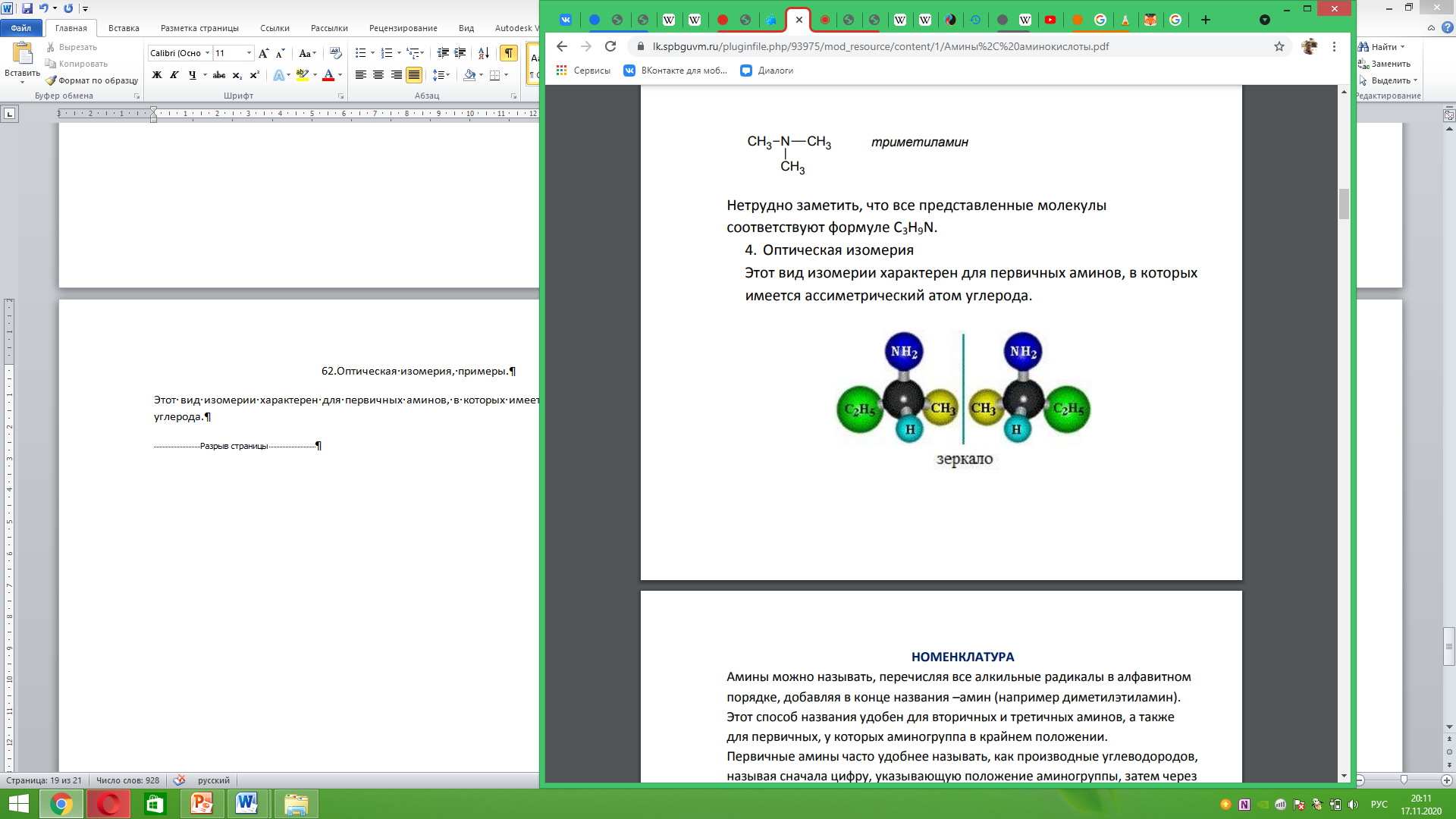
62.Оптическая изомерия, примеры. Этот вид изомерии характерен для первичных аминов, в которых имеется ассиметрический атом углерода.
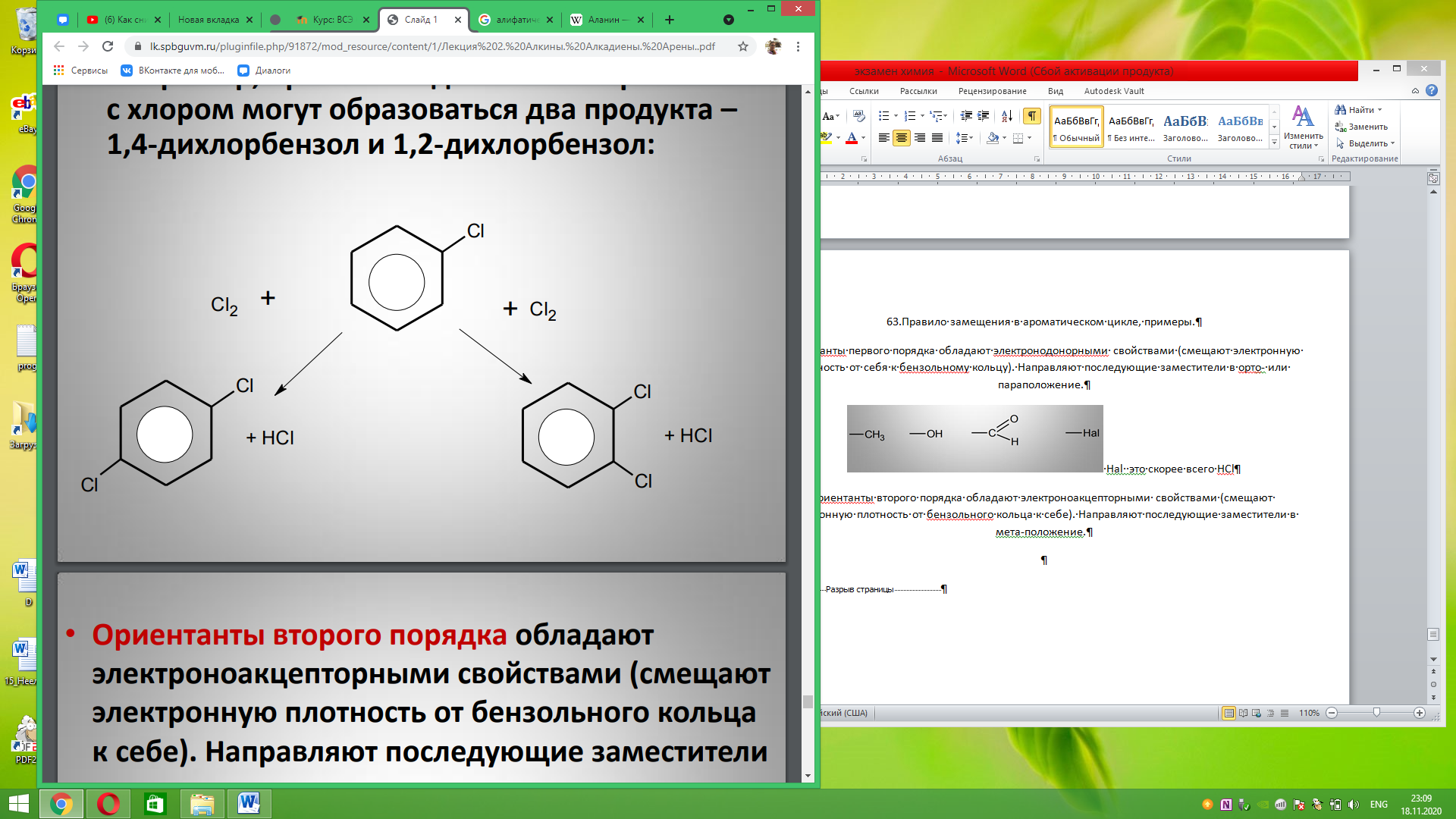
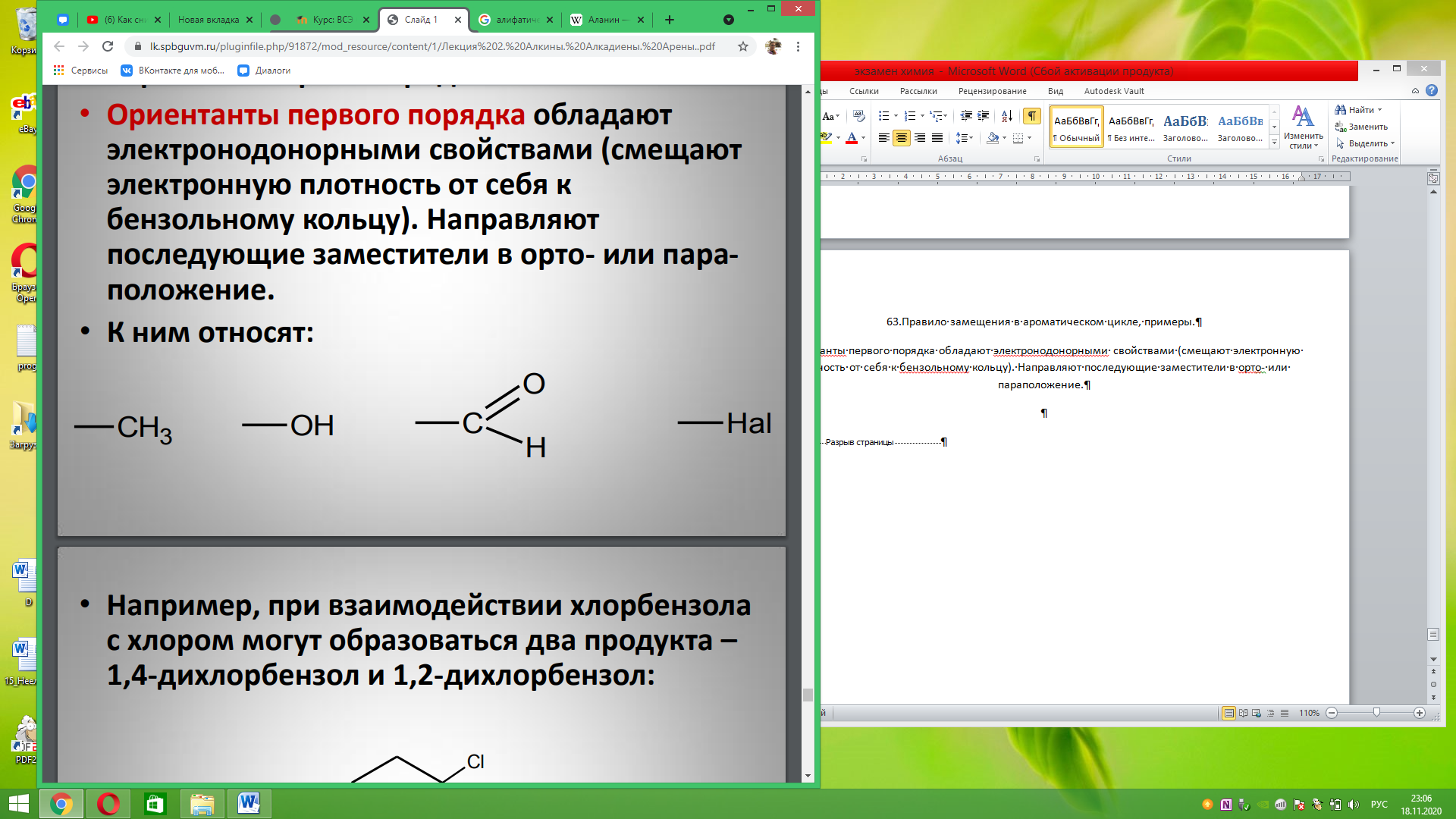
63.Правило замещения в ароматическом цикле, примеры. Ориентанты первого порядка обладают электронодонорными свойствами (смещают электронную плотность от себя к бензольному кольцу). Направляют последующие заместители в орто- или параположение.
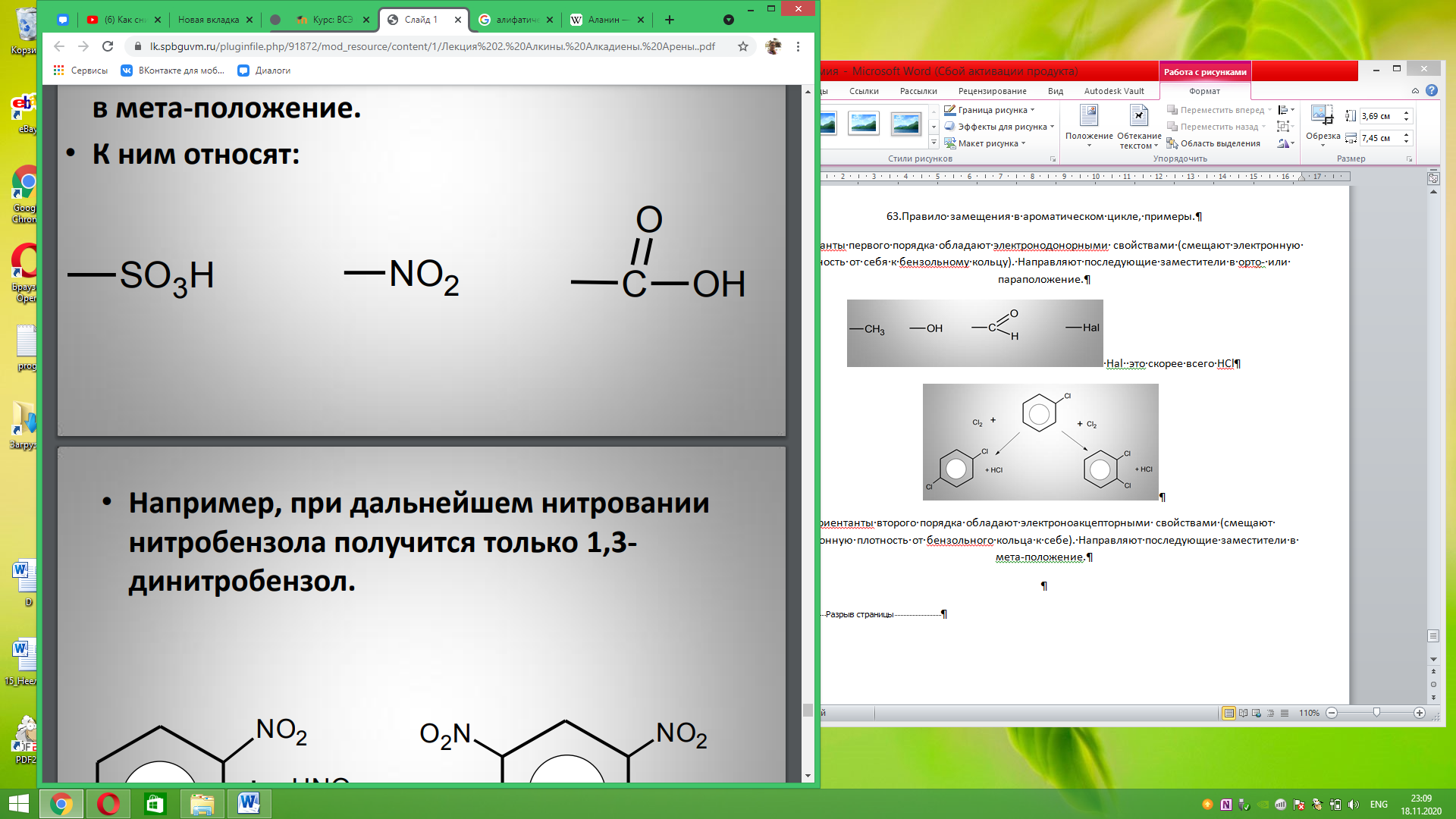
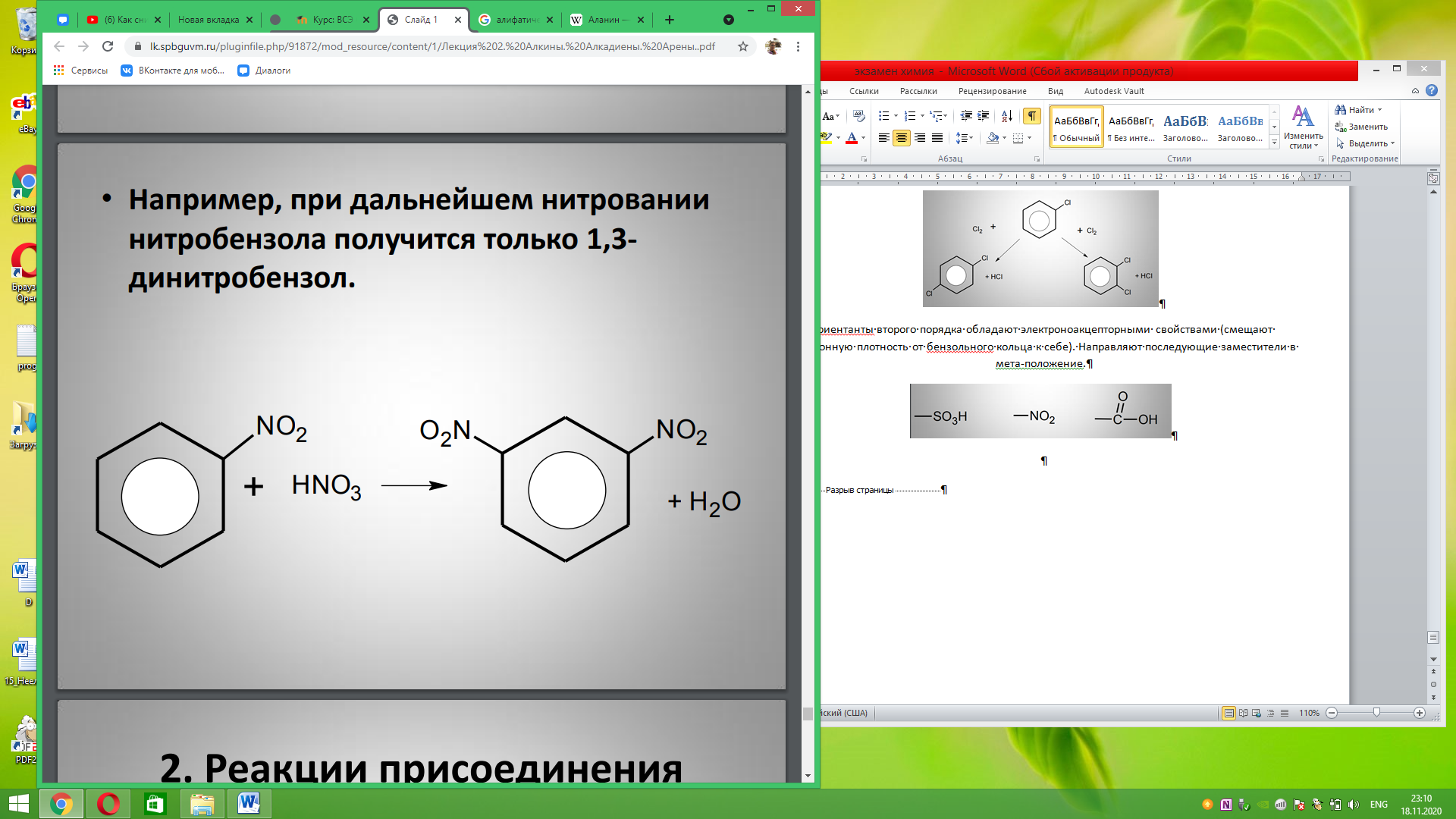
Ориентанты второго порядка обладают электроноакцепторными свойствами (смещают электронную плотность от бензольного кольца к себе). Направляют последующие заместители в мета-положение.
Коллоидная химия это наука о дисперсных системах и поверхностных явлениях, возникающих на границах раздела фаз. Значение изучение физико-химических свойств коллоидных растворов и студней, образуемых белками и другими биополимерами. Состав дисперсной системы 1 дисперсная фаза - раздробленное вещество 2 дисперсионная среда – однородное вещество, в объеме которого распределены частицы дисперсной фазы По величине частиц веществ, составляющих дисперсную фазу, дисперсные системы делятся на: ¾ грубодисперсные (взвеси) с размерами частиц более 100 нм; ¾ тонкодисперсные (коллоидные растворы или коллоидные системы) с размерами частиц от 100 до 1 нм; ¾ гомогенные системы(истинные растворы), или растворы с размером частиц менее 1 нм Растворы гомогенные (истинные растворы) смеси, состоящие из двух или более компонентов, относительные количества которых могут изменяться в широких пределах. Состав раствора ¾ растворенное вещество ¾ растворитель За растворитель принимают тот компонент раствора, который при образовании раствора не меняет своего агрегатного состояния. Если все компоненты раствора находятся в одном агрегатном состоянии, то растворителем считают тот компонент, которого в смеси больше ¾ газообразными (например, воздух, основными компонентами которого являются азот и кислород) ¾ жидкими (например, растворы спирта в воде, соли в воде, кислорода в воде) ¾ твердыми (металлические сплавы) Основные виды коллоидов ¾ Гели - Структурированные дисперсные системы, состоящие из высокомолекулярных и низкомолекулярных веществ. Наличие трёхмерного полимерного каркаса (сетки) сообщает гелям механические свойства твёрдых тел (отсутствие текучести, способность сохранять форму, прочность и способность к деформации (пластичность и упругость)). В отличие от золей частицы дисперсной фазы гелей, связанные в пространственную структуру, не могут участвовать в броуновском движении. Гели состоят, по крайней мере, из двух компонентов, один из которых образует непрерывную трёхмерную макромолекулярную сетку, выступающую в роли каркаса, пустоты в которой заполнены низкомолекулярным растворителем — дисперсионной средой. ¾ Золи - Высокодисперсные системы с частицами из твердого вещества, находящимися в броуновском движении. Чаще всего золями называют системы с жидкой дисперсионной средой. Золи – типичные коллоидные системы, которые наиболее ярко проявляют свойства, присущие веществу в высокодисперсном состоянии. Строение мицеллы. Коллоидная мицелла состоит: ¾ Ядра ¾ Адсорбционого слоя ¾ Диффузного слоя Ядро мицеллы представляет собой микрокристалл или агрегат из многих микрокристаллов. Поверхность ядра обладает запасом свободной энергии и избирательно поглощает ионы из интермицеллярной жидкости. На поверхности ядра предпочтительно адсорбируются ионы, способные достраивать его кристаллическую решётку или образующие с ионами, входящими в состав кристаллической решётки, малорастворимые соединения (правило Фаянса - Панета). В результате поверхность ядра мицеллы приобретает заряд. Ионы, создающие заряд ядра мицеллы, называются потенциалообразующими или потенциалопределяющими. Образующийся заряд притягивает из интермицеллярной жидкости противоположно заряженные ионы – противоионы, часть которых достаточно прочно удерживается вблизи поверхности, но полностью не нейтрализует её заряд. Потенциалоопределяющие ионы с этой частью противоионов образуют адсорбционный слой. Остальная часть противоионов, количество зарядов которых x равно разности между количеством зарядов потенциалообразующих ионов (n) и противоионов адсорбционного слоя (n-x), 30 расположена на более удалённом расстоянии от ядра, образуя диффузный слой. Ядро вместе с адсорбционным слоем образует гранулу, а гранула с диффузным слоем – мицеллу. Гранула имеет либо положительный, либо отрицательный заряд. Мицелла всегда электронейтральна. Теория растворения. Было 2 основные теории ¾ Сторонники физической теории растворов, которую развивали Вант-Гофф, Аррениус и Оствальд, считали, что процесс растворения является результатом диффузии, т. е. проникновения растворённого вещества в промежутки между молекулами воды. ¾ В противоположность представлениям физической теории растворов Д. И. Менделеев и сторонники химической теории растворов доказывали, что растворение является результатом химического взаимодействия растворённого вещества с молекулами воды. В результате химического взаимодействия растворённого вещества с водой образуются соединения — гидраты. Теория катализа. Изменение скорости химической реакции под влиянием катализатора называется катализом Для объяснения механизма каталитических реакций были предложены три группы теорий: геометрические, электронные и химическая. В геометрических теориях основное внимание обращено на соответствие между геометрической конфигурацией атомов активных центров катализатора и атомов той части реагирующих молекул, которая ответственна за связывание с катализатором. Электронные теории исходят из представления, что хемосорбция обусловливается электронным взаимодействием, связанным с переносом заряда, т.е. эти теории связывают каталитическую активность с электронными свойствами катализатора. Химическая теория рассматривает катализатор как химическое соединение с характерными свойствами, которое образует химические связи с реагентами, в результате чего формируется нестабильный переходный комплекс. После распада комплекса с высвобождением продуктов катализатор возвращается в исходное состояние. Последняя теория считается сейчас наиболее верной.
Алканы. Гомологический ряд, изомерия, номенклатура, химические свойства. Алканы – это углеводороды, в которых атомы углерода соединяются между собой простыми одинарными ϭ-связями. Оставшиеся валентности углеродного атома полностью насыщены атомами водорода. • Общая формула гомологического ряда: CnH2n+2 Гомологический ряд Метан СН4 – (Радикал) -СН3 Метил Этан С2Н6 – (R) С2Н5 Этил Пропан С3Н8 – (R) С3Н7 Пропил Бутан С4Н10 – R - С4Н9 Бутил Пентан С5Н12 Гексан С6Н14 Гептан С7Н16 Октан С8Н18 Нонан С9Н20 Декан С10Н22 Изомеры – это молекулы, имеющее одинаковый атомарный состав, но разное строение. Для алканов характерна только изомерия углеродного скелета. Н-р, n-пентан, 2-метилбутан, 2,2-диметилпропан Номенклатура В названиях всех представителей окончание –ан. Начиная с пентана названия углеводородов производятся от греческих или латинских числительных. При наименовании разветвлённых алканов необходимо пользоваться следующим алгоритмом: • Сначала находят главную цепь. Главная цепь – эта самая длинная неразветвлённая цепь. • Нумеруют атомы углерода в главной цепи, начиная с того конца, к которому ближе расположен боковой радикал. • После этого называют боковые радикалы. Если имеется только один боковой радикал. В этом случае вначале называют цифру, показывающую местоположение радикала, затем называют сам радикал (если название пишется, то между арабской цифрой и названием радикала ставится дефис), и в последнюю очередь называется алкан по главной цепи. Если есть несколько одинаковых радикалов, то вначале в порядке возрастания перечисляют цифры, показывающие положение радикалов, затем называют греческую приставкучислительное, соответствующую количеству радикалов, затем называют радикал. После этого называют алкан по главной цепи. Химические свойства Алканы являются устойчивыми неполярными молекулами с прочными ковалентными связями. Поэтому соединения этого класса самые инертные из всех углеводородов. Характерными реакциями являются реакции замещения, расщепления и окисления. Алканы неохотно вступают и в эти реакции, поэтому для их инициации необходимо нагревание, облучение или присутствие катализатора. 1. Реакции замещения • Галогенирование. Реакция идёт по радикальному механизму. Для инициации требуется ультрафиолетовое облучение. Под влиянием кванта света молекула галогена распадается на два радикала, каждый из которых в свою очередь атакует молекулу алкана. hν CH4 + Сl2 → CH3Cl(хлорметан)+ HCl hν CH3Cl + Сl2 → CH2Cl2(дихролметан) + HCl hν CH2Cl2 + Сl2 → CHCl3(хлороформ) + HCl hν CHCl3 + Сl2 → СCl4(тетрахлорметан) + HCl • Реакции нитрования (реакция Коновалова) Нитрование происходит с участием азотной кислоты (HNO3) при нагревании (порядка 140⁰С). В такой реакции атом водорода замещается на нитрогруппу (–NO2). H3C- CH2 -CH3 + HO - NO2-> H3C -CH -CH3 + H2O Замещение в первую \ NO2 2-нитропропан очередь идёт при третичном или вторичном атоме углерода 2. Реакции расщепления • Эти реакции проходят с разрывом углерод-углеродных или углеродводородных связей. В связи с этим различают реакции дегидрирования, термического разложения и изомеризации. • Дегидрирование При воздействии температуры и катализатора происходит отщепление молекулы водорода от алкана. При этом в молекуле алкана образуется двойная связь и он, таким образом, становится алкеном. (t⁰, Cr2O3) СН3 – СН3 (этан)->СН2 = СН2(этилен) + Н2 Этан Этилен • Термическое разложение (крекинг) При термическом разложении в молекуле алкана разрывается углерод-углеродная связь и из реакции выходят два продукта, один из которых – алкан, а второй – алкен. 500⁰С СН3 – СН2 – СН3 ->СН2 = СН2 + CH4 • Изомеризация Для того, чтобы это строение изменить, необходимо разорвать углерод-углеродные связи. Реакция идёт в присутствии катализатора – хлорида алюминия. AlCl3 H3C -CH2- CH2 -CH3 -> H3C -CH -CH3 | H3C 3. Реакции окисления В обычных условиях алканы практически не окисляются. В присутствии сильных окислителей в жёстких условиях способны окисляться только высшие алканы с образованием различных продуктов окисления – спиртов, альдегидов, карбоновых кислот. Однако алканы прекрасно вступают в реакции горения. Горение в присутствии большого количества кислорода 2СН4 + 3О2 ->2СО2 + 2Н2О 2С2Н6 + 7О2 ->4СО2 + 6Н2О При недостатке кислорода образуется окись углерода (угарный газ) 2СН4 + О2-> 2СО+ 2Н2
2 Алканы. Способы получения. Первые четыре представителя гомологического ряда – газообразные вещества. Их получают из природного газа и попутных нефтяных газов. С5 – С15 – жидкости. Они входят в состав нефти. Высшие алканы – твёрдые вещества, парафины. Они также встречаются в нефти в растворённом состоянии. 1. Гидрирование, или «сжижение» угля: (500⁰, оксиды железа) nС + 2nН2 ->СnН2n+2 2. Гидрирование алкенов. (Pt, 200⁰С) СН2=СН2 + Н2 ->СН3 –СН3 3. Синтез Ш.А. Вюрца СН3 –Cl + 2Na + Cl–CH3 ->СН3 – CH3 + 2NaCl 4. Сплавление соле
|
||
|
Последнее изменение этой страницы: 2020-12-09; просмотров: 642; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.220 (0.011 с.) |








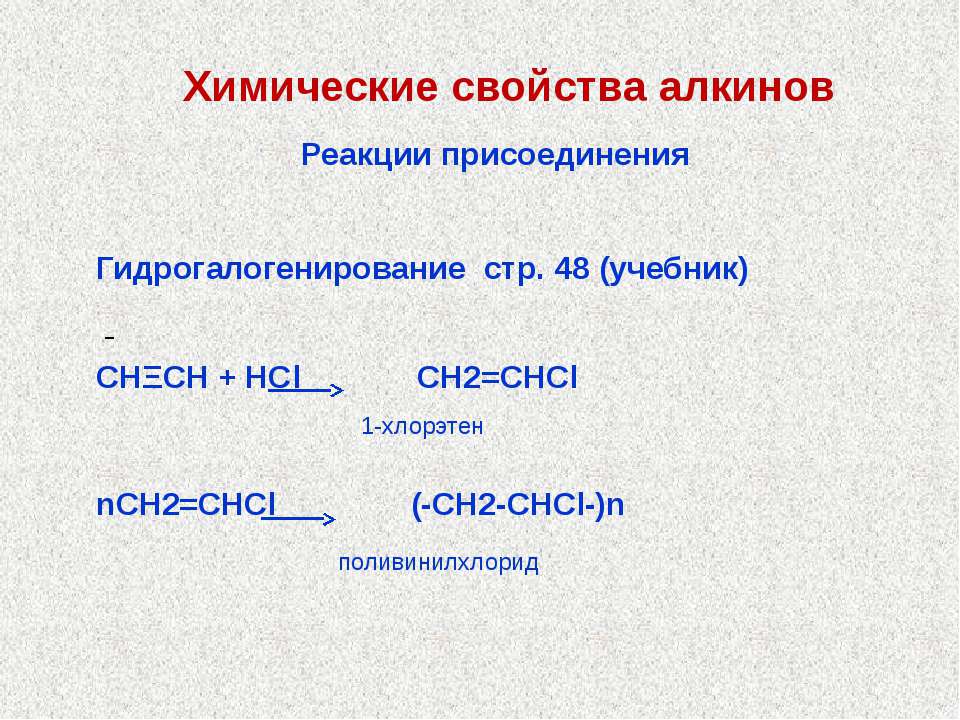




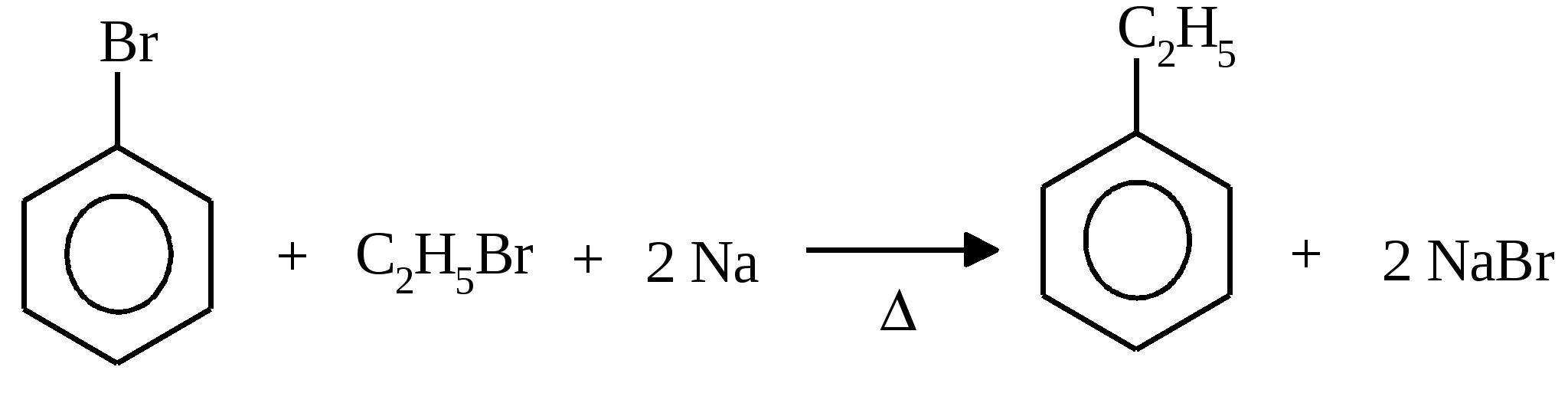




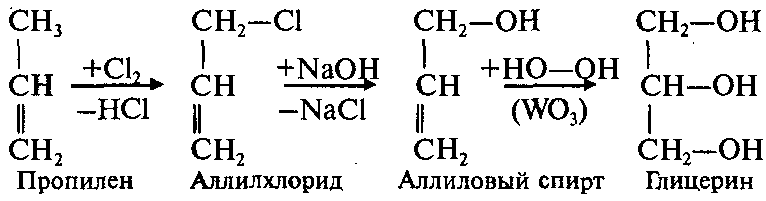


 Hal это скорее всего HCl
Hal это скорее всего HCl