
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Термодинамические понятия – теплота и работа газа. Количество теплоты. Молярная и удельная теплоемкости газаСодержание книги
Поиск на нашем сайте
Известны две формы обмена энергией термодинамической системы с окружающей средой: теплота Элементарная работа Бесконечно малое количество теплоты
где
36. Вычисление работы идеального газа в различных изопроцессах. Элементарная работа а) в изобарном процессе ( б) в изохорном процессе ( в) в изотермическом процессе ( г) в адиабатном процессе
Первое начало термодинамики. Применение первого начала к изопроцессам: изохорному, изобарному, изотермическому и адиабатному процессу Первое начало термодинамики – это закон сохранения и превращения энергии в тепловых процессах: Согласно первому закону ТД, подведенное тепло идет на приращение внутренней энергии системы и на совершение системой работы против внешних сил. Для элементарного процесса: где В изохорном процессе
Отсюда получаем формулу молярной теплоемкости идеального газа при постоянном объеме:
В изобарном процессе, согласно первому началу ТД:
Используя формулы теплоемкостей найдем отношение теплоемкостей –
Вычисление молярной теплоемкости газа в изохорном и изобарном процессах. Теорема Майера В изохорном процессе
Отсюда получаем формулу молярной теплоемкости идеального газа при постоянном объеме:
В изобарном процессе, согласно первому началу ТД:
|
||||
|
Последнее изменение этой страницы: 2020-11-28; просмотров: 163; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.101.75 (0.008 с.) |

 – энергия, переданная путем теплообмена, и работа A – характеристика процесса, в котором изменяется объем газа.
– энергия, переданная путем теплообмена, и работа A – характеристика процесса, в котором изменяется объем газа. , где
, где  – приращение объема газа. Полная работа газа вычисляется путем интегрирования:
– приращение объема газа. Полная работа газа вычисляется путем интегрирования: .
.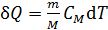 ,
, – молярная теплоемкость (количество теплоты, необходимое для нагрева 1-го моля вещества на 1 К);
– молярная теплоемкость (количество теплоты, необходимое для нагрева 1-го моля вещества на 1 К); 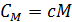 , где
, где  – удельная теплоемкость газа;
– удельная теплоемкость газа; 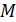 – его молярная масса.
– его молярная масса.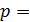 const) работа
const) работа 
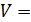 const;
const; 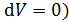 величина
величина 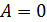 ;
;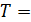 const)
const)  , тогда
, тогда  ;
;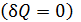 из формулы 1-го закона ТД следует, что
из формулы 1-го закона ТД следует, что 
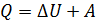 .
.  ,
, 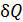 – бесконечно малое количество теплоты;
– бесконечно малое количество теплоты; 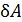 – элементарная работа;
– элементарная работа; 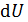 – бесконечно малое приращение внутренней энергии. Символ
– бесконечно малое приращение внутренней энергии. Символ  вместо
вместо 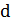 означает, что
означает, что 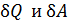 не являются полными дифференциалами величин
не являются полными дифференциалами величин 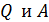 – эти величины являются характеристиками процесса, т. е. они зависят от процесса перехода газа из состояния 1 в состояние 2.
– эти величины являются характеристиками процесса, т. е. они зависят от процесса перехода газа из состояния 1 в состояние 2.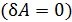 и, согласно первому закону ТД, имеем
и, согласно первому закону ТД, имеем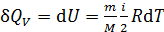 .
. .
.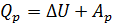 , – отсюда видим, что
, – отсюда видим, что 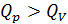 , так как требуется дополнительное количество теплоты на совершение работы. Соответствующее соотношение молярных теплоемкостей
, так как требуется дополнительное количество теплоты на совершение работы. Соответствующее соотношение молярных теплоемкостей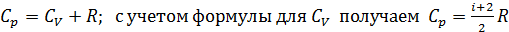 .
.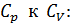
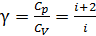 .
.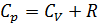 .
.


