Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Полимеразная цепная реакция (ПЦР)Стр 1 из 16Следующая ⇒
Полимеразная цепная реакция (ПЦР)
В настоящее время существует множество модификаций ПЦР: ПЦР в реальном времени, количественная ПЦР (quantitative, qPCR), мостиковая ПЦР (bridge PCR, bPCR), эмульсионная (emulsion PCR, ePCR) и цифровая капельная ПЦР (digital drop PCR, ddPCR). Несмотря на большое разнообразие отдельных подходов, в основе всех разновидностей метода ПЦР лежит общий принцип способности нуклеиновых кислот к самокопированию (репликации). Поэтому рассмотрение биологических основ и отличительных особенностей каждого из этих методов следует начать с рассмотрения принципа классической ПЦР.
Классическая ПЦР
Каждый цикл ПЦР включает три этапа (Рис. 1). Сначала двухцепочечную ДНК ненадолго нагревают до 90-96°С, чтобы отделить цепи друг от друга (плавление ДНК). Температура плавления каждого образца ДНК индивидуальна и определяется соотношением G≡C и А=Т пар в первичной структуре амплифицируемого фрагмента. Как известно, при образовании Уотсон-Криковских пар между азотистыми основаниями, между G и C формируется три водородные связи, тогда как пара А=Т образована двумя водородными связями. Поэтому, чем выше содержание G≡C пар в первичной структуре нуклеиновой кислоты, тем выше ее температура плавления (Tm). Приблизительную температуру плавления короткого фрагмента двухцепочечной ДНК можно рассчитать по уравнению:
k - число, находящееся в интервале 0< k <5. Обычно принимают k = 4.
Рис. 1 Первый цикл ПЦР После расхождения цепей ДНК охлаждают (примерно до 40-75°С) в присутствии переизбытка праймеров, что позволяет им гибридизоваться с комплементарными последовательностями на цепях ДНК. Затем смесь инкубируется с ДНК-полимеразой и 4-мя видами dNTP, чтобы ДНК синтезировалась, начиная с двух праймеров. Затем цикл начинается заново с нагревания, чтобы отделить вновь синтезированные цепи ДНК друг от друга. Поскольку процесс плавления ДНК требует использования высоких температур, данная методика требует использовать особые виды ДНК-полимераз, способные выдерживать нагревание до 96°С. Большинство известных ДНК-полимераз, как и других ферментов, при нагревании до столь высоких температур подвергаются денатурации и теряют биологическую активность. Поэтому для проведения ПЦР используют специальные ДНК-полимеразы, выделенные из термофильных бактерий, которые устойчивы к действию гораздо более высоких температур, чем эукариотические ДНК-полимеразы. Это снимает необходимость добавления новой порции фермента после каждого цикла ПЦР. Долгое время для проведения ПЦР использовались отдельные термостабильные ДНК полимеразы: Taq, Tth, Pwo, Pfu и др. В настоящее время, для различных целей, в ПЦР используют смеси полимераз с различными свойствами, включая искусственно полученные модификации природных ферментов. Большинство используемых в настоящее время ферментов получены на основе технологии рекомбинантных ДНК. Taq -полимераза была выделена из термофильной эубактерии Thermus aquaticus. Фермент представляет собой одну полипептидную цепь с молекулярной массой 95 кДа. Данный фермент эффективно амплифицирует фрагменты длиной 3000-5000 п. н. и обладает хорошо выраженной 5ʹ-3ʹ-экзонуклеазной активностью, но не проявляет корректирующей 3ʹ-5ʹ-экзонуклеазной активности. Получаемые при использовании Taq -полимеразы фрагменты ДНК, как правило, содержат выступающий 3ʹ-концевой нуклеотид (чаще всего А), который нематрично присоединяется ферментом. Это свойство Taq -полимеразы используют для эффективного клонирования продуктов ПЦР в линеаризованные векторы с 3ʹ-выступающим Т. Tth -полимераза была выделена из термофильной эубактерии Thermus thermophilus. Это также высокопроцессивный фермент, амплифицирующий до 3000 п. н., имеющий молекулярную массу порядка 94 кДа, обладающий хорошо выраженной 5ʹ-3ʹ-экзонуклеазной активностью, но не проявляющий корректирующей 3ʹ-5ʹ-экзонуклеазной активности. Особенностью этой полимеразы является наличие ревертазной активности. Данный фермент обычно используют для проведения ПЦР с обратной транскрипцией (RT-PCR).
Pwo -полимераза была выделена из гипертермофильной архебактерии Pyrococcus woesei. Молекулярная масса фермента около 90 кДа. Это процессивный фермент, обеспечивающий амплификацию до 3000 п. н., не проявляющий 5ʹ-3ʹ-экзонуклеазной активности, но обладающий выраженной 3ʹ-5ʹ-экзонуклеазной активностью. Pfu -полимераза получена из Pyrococcus furiosus. Молекулярная масса около 92 кДа. Pfu -полимераза характеризуется сравнительной процессивностью и эффективно амплифицирует фрагменты до 1000 п. н. Фермент обладает 3ʹ-5ʹ-экзонуклеазной активностью, наличие которой делает его пригодным для тех вариантов ПЦР, в которых необходимо получение продукта с высокой точностью синтеза (например, для последующего секвенирования).
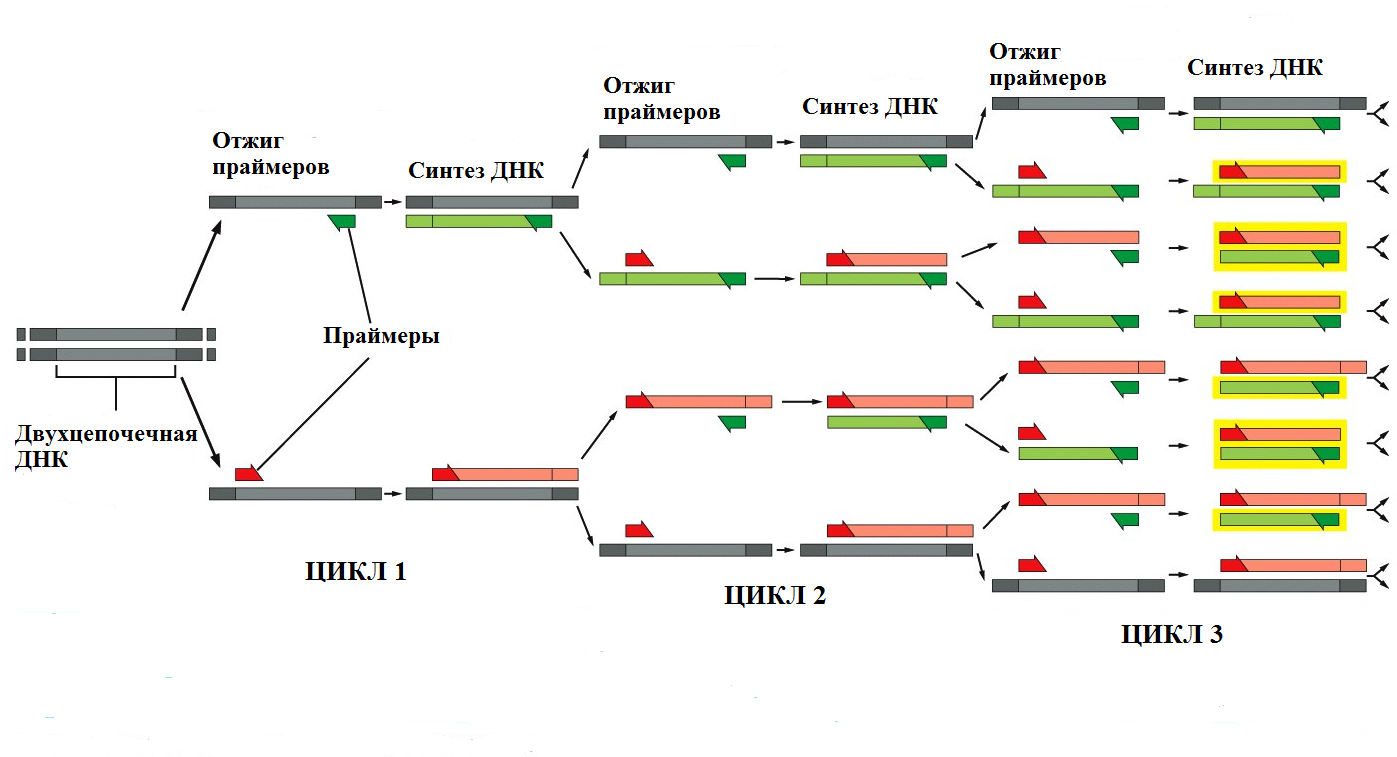
Рис. 2 Схема амплификации ДНК в течение трех циклов ПЦР Помимо ДНК-матрицы, ДНК-полимеразы и праймеров, необходимыми компонентами реакционной смеси являются dNTP 4-х типов (dATP, dGTP, dCTP и dTTP), а также ионы Mg2+ (чаще всего в форме MgCl2). После множества циклов амплификации образуется большое число, обычно миллиарды копий исходной последовательности (Рис. 2). В результате каждого цикла количество копий амплифицированного фрагмента увеличивается как 2n. При этом относительная концентрация целевых последовательностей многократно возрастает (показано желтым), в то время как доля нецелевых участков прогрессивно уменьшается. ПЦР крайне чувствительна и может зарегистрировать присутствие единичной копии последовательности ДНК в образце, амплифицируя ее так, что эту ДНК становится возможным увидеть с помощью, например, окрашивания бромистым этидием (интеркалирующего агента, встраивающегося между цепями двойной спирали ДНК и вызывающего ее сверхспирализацию, в результате чего образовавшийся комплекс приобретает способность флуоресцировать в УФ-свете) после разделения гель-электрофорезом.
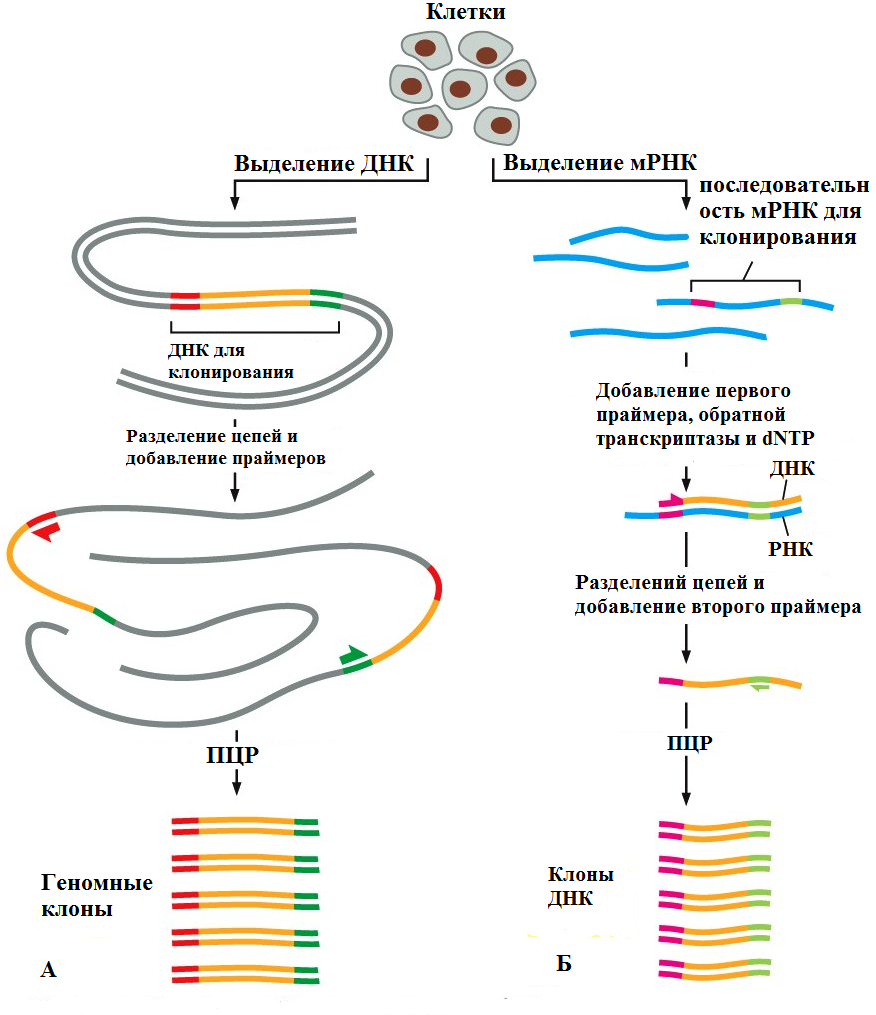
Рис. 3 Получение геномных (А) и кДНК копий с помощью ПЦР Существует несколько особенно важных областей применения ПЦР. На сегодняшний день, это основной метод клонирования относительно коротких фрагментов ДНК (менее 10 000 п. н.). Изначальной матрицей для реакции может служить как ДНК, так и РНК, что позволяет с помощью ПЦР получать как полногеномные копии, так и копии кДНК (Рис. 3). Удобство метода состоит в том, что ген можно клонировать непосредственно с любого фрагмента ДНК или РНК без необходимости первоначального создания библиотек.
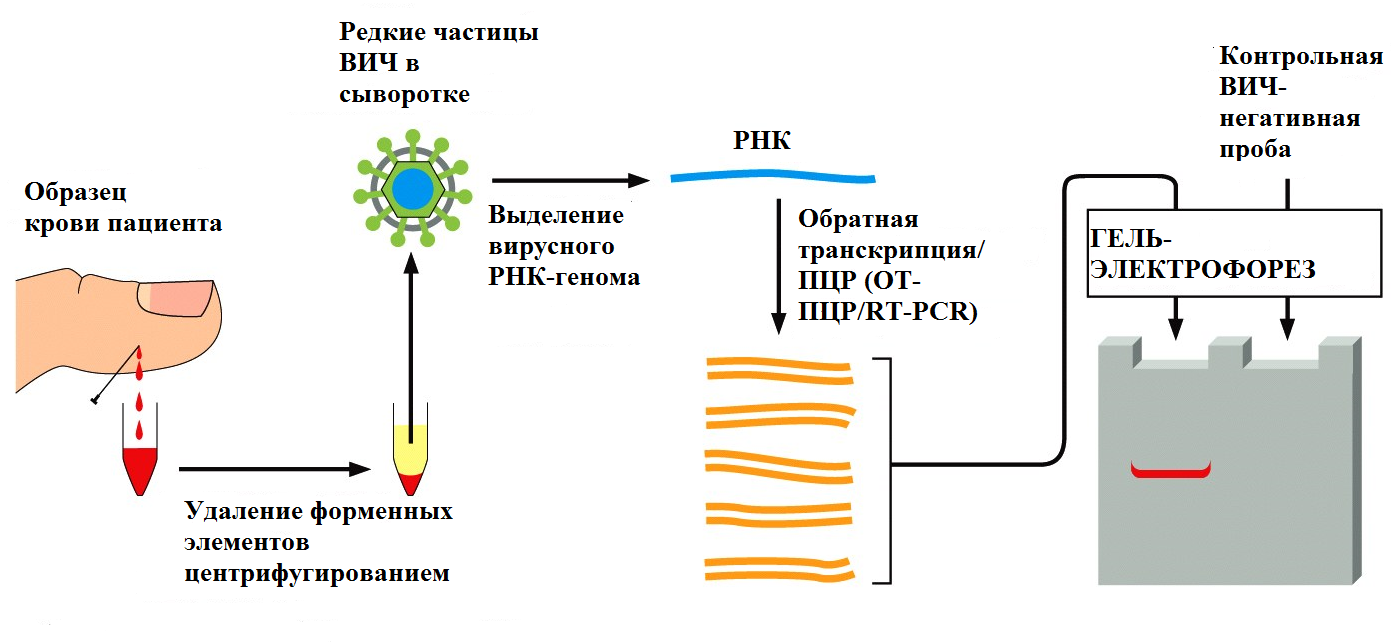
Другое применение ПЦР, связанное с ее особой чувствительностью, это поиск патогенов инфекционных заболеваний на ранних стадиях. В этом случае, в качестве праймеров используют короткие фрагменты ДНК, комплементарные какой-либо из уникальных последовательностей генома возбудителя. С помощью большого числа циклов ПЦР можно проверить наличие или отсутствие даже единичных его копий в образце крови (Рис. 4).
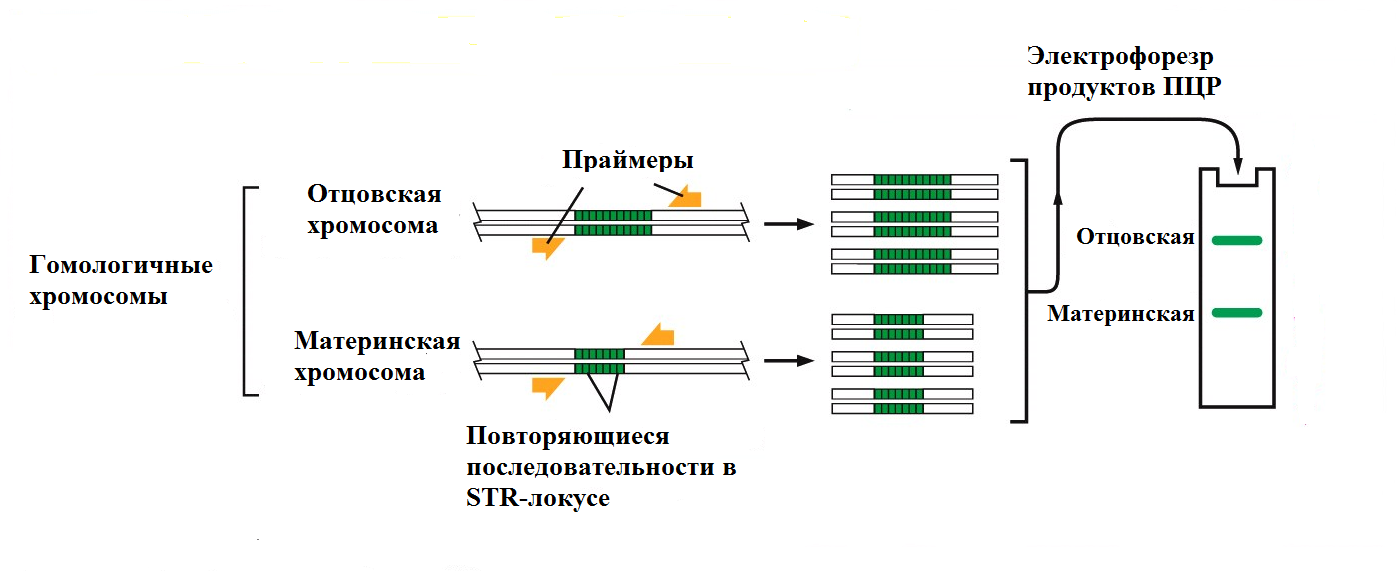
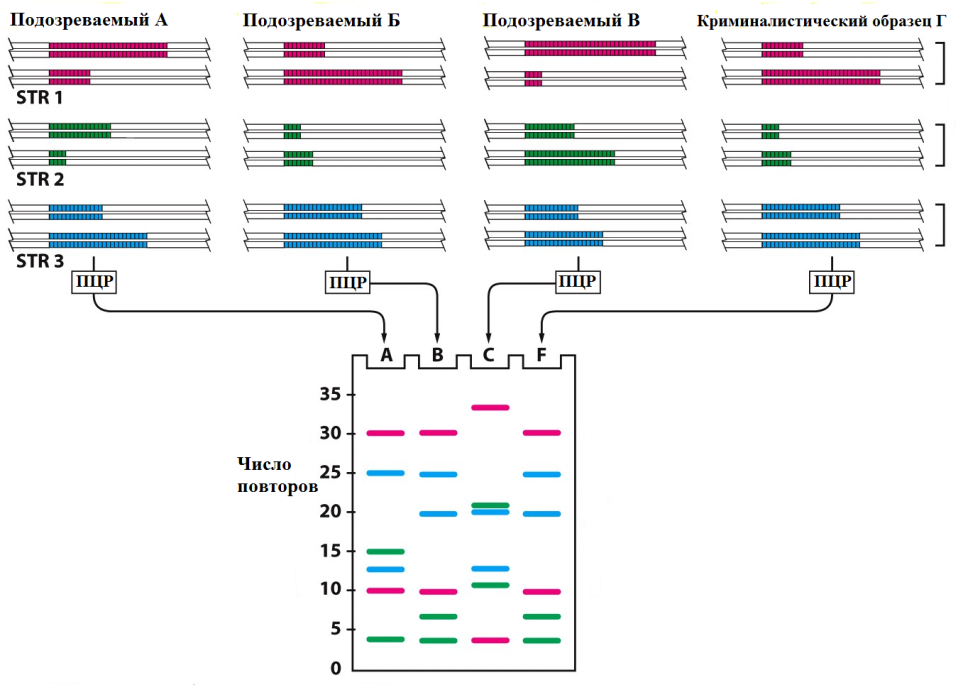
Рис. 4 Использование метода ПЦР для диагностики инфекционных заболеваний. ПЦР - самый чувствительный метод диагностики для многих инфекций. В настоящее время он часто заменяет иммунологические методы диагностики, такие как ИФА. ПЦР широко применяется в судебной медицине и криминалистике. Крайне высокая чувствительность этого метода позволяет работать с очень маленькими образцами, такими как волосяная луковица от волоса, мельчайшие следы крови или тканей, которые могут содержать фрагменты лишь одной клетки. Используя ДНК, выделенную из таких образцов, можно получать генетические "отпечатки пальцев" человека, от которого получен образец. Геном каждого человека, за исключением монозиготных близнецов, отличается по последовательности ДНК от генома любого другого человека. ДНК, амплифицированная с помощью ПЦР с использованием определенных праймеров будет различаться по последовательности у разных людей. Используя набор праймеров, покрывающих известные высоковариабильные участки генома человека, можно с помощью ПЦР получить различающиеся генетические "отпечатки пальцев" для каждого человека. Обычно, в таком анализе используют так называемые короткие тандемные повторы (short tandem repeats, STRs), состоящие из таких последовательностей как САСАСА... или GTGTGT..., и находящиеся в различных локусах в геноме человека. Число повторов в каждом STR высоковариабильно в популяции, с разбросом от 4 до 40 у разных индивидов. Из-за разнообразия в этих последовательностях люди обычно наследуют разные варианты каждого STR от матери и от отца; два неродственных человека, как правило, несут разные пары последовательностей. После ПЦР с использованием праймеров, ограничивающих локус, образуется пара полос амплифицированной ДНК от каждого человека, одна из которых представляет материнский вариант STR, а вторая - отцовский. Длина ПЦР-продукта и, соответственно, положение полосы в геле после электрофореза будет зависеть от точного числа повторов в локусе (Рис. 5).
Рис. 5 ПЦР-анализ одного STR -локуса На Рис. 6 представлен пример анализа трех STR-локусов у трех подозреваемых (А, Б и В), что приводит к образованию шести полос для каждого человека после электрофореза в полиакриламидном геле (ПААГ). Несмотря на то, что у разных людей отдельные полосы могут совпадать, общая картина уникальна для каждого человека. Четвертая дорожка геля (Г) содержит продукты ПЦР проведенной с образцом ДНК, полученным из биологического материала, собранного на месте преступления. Чем больше локусов будет проанализировано, тем ниже будет вероятность ошибки из-за совпадения числа повторов в отдельных локусах. Если исследовать вариабельность 5-10 разных STR-локусов, то вероятность того, что у двух случайных людей совпадут "отпечатки пальцев" будет примерно 1 на 10 млн.
Рис. 6 Анализ трех STR -локусов методом ПЦР В рассмотренном случае, индивиды А и В могут быть исключены из числа подозреваемых, а Б остается явным подозреваемым в совершении преступления. Аналогичный подход используется при определении отцовства. Типы ПЦР-амплификаторов
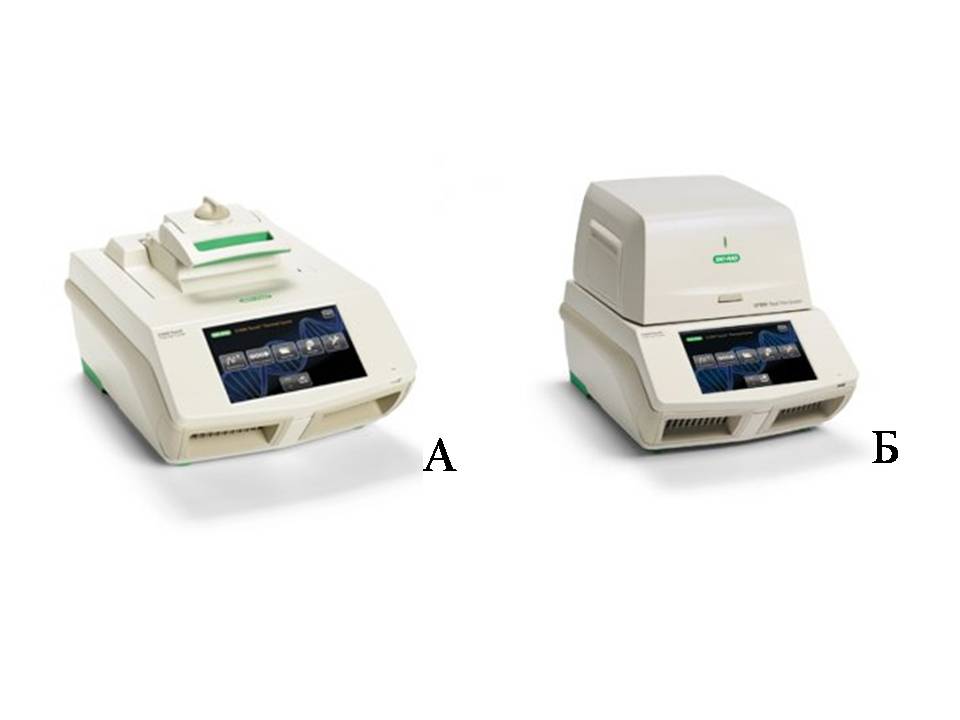
Рис. 7. Примеры обычного (А) амплификатора С1000 Touch, BioRad (США) и детектирующего амплификатора CFX 96 Touch, BioRad (США) Рис. 8.Детекция кинетики ПЦР в реальном времени с помощью флуоресцентных зондов. Экспоненциальная стадия ПЦР описывается уравнением:
где Pn - количество молекул продукта/репортерной флуоресценции к циклу n, P0 - исходное количество молекул, содержащих амплифицируемый фрагмент (template), E - эффективность амплификации. В идеальных условиях E = 2, т.к. на каждом цикле ПЦР происходит удвоение количества продукта. Прологарифмировав обе части уравнения (1) получим:
Назовем пороговым циклом (threshold cycle, Ct)) такой цикл n, на котором достигается некий заданный уровень репортерной флуоресценции - пороговая флуоресценция PCt = const. Для n=Ct уравнение 2 принимает вид:
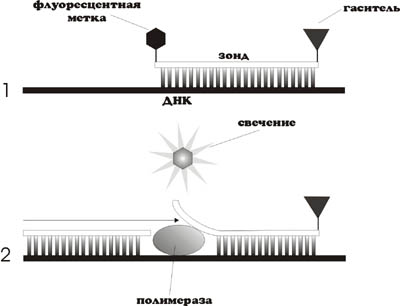
Т.е. значение Сt прямо пропорционально логарифму количества субстрата. Таким образом, ПЦР в реальном времени позволяет сравнивать количества субстрата при условии, что эффективность реакции и заданный уровень пороговой флуоресценции одинаковы для каждой из сравниваемых реакций. Однако величина Сt может зависеть от многих случайных факторов, например чувствительности детектора, качество фильтра. Поэтому точно начальное количество интересующего продукта померить нельзя. Для решения этой проблемы существуют методы нормировки. Измеряют отношение количеств двух молекул в пробе. Нормализацию обычно проводят по продуктам амплификации так называемых генов домашнего хозяйства (housekeeping genes) уровень экспрессии которых в клетке всегда примерно одинаков. Вместе с тем, классическая ПЦР сохраняет свою актуальность в методиках, требующих наработки фрагментов ДНК с целью их дальнейшего использования (клонирования или секвенирования). В этих случаях, присутствие интеркалирующих красителей может помешать последующим процедурам. Рис. 9 Кривая плавления продуктов ПЦР (сплошная линия). Прерывистой линией показан график первой производной. Значения максимумов первых производных принимаются за температуру плавления ампликонов. Фрагменты ДНК различной длины и состава будут плавиться (гибридизоваться) при разной температуре, что позволяет приблизительно оценить состав реакционной смеси после ПЦР. Данный подход имеет низкую разрешающую способность и обычно используется для различения димеров праймеров и длинных продуктов ПЦР. 1.3.1.1.2 Меченные праймеры с адаптерной последовательностью (амплифлюры) Существует несколько вариантов использования адаптерных 5ʹ-концевых последовательностей для регистрации накопления продукта ПЦР с участием флуоресцентно меченного праймера. В наиболее простом варианте, праймер несёт дополнительную последовательность на 5ʹ-конце, способную образовывать шпилечную структуру (Рис. 10). Рис. 10 Схема работы праймеров "амплифлюр" а - праймер содержит 5ʹ-адаптер с инвертированным повтором, по краям которого расположены флуорофор и гаситель флуоресценции. При температуре элонгации, инвертированный повтор образует шпилечную структуру в которой флуорофор и гаситель оказываются сближены. В ходе синтеза второй цеп ДНК, шпилечная структура "разворачивается" и интенсивность флуоресценции возрастает. б - праймер содержит меченный 5ʹ-адаптер, комплементарный дополнительному олигонуклеотиду с гасителем. Синтез второй цепи "сталкивает" олигонуклеотид с гасителем. Праймеры несут флуоресцентную метку (флуорофор) и гаситель флуоресценции, расположенные так, что при образовании шпилечной структуры флуорофор и гаситель оказываются пространственно сближенными. В растворе праймеры сохраняют структуру шпильки, имеющую низкий уровень флуоресценции. В ходе реакции, шпилька меченного праймера раскрывается (поскольку меченный праймер становится частью двухцепочечного продукта), что приводит к усилению флуоресценции. Существует также вариант этого метода, при котором гаситель флуоресценции находится на отдельном нуклеотиде, комплементарном 5ʹ-концевой адаптерной последовательности. В этом случае, при встраивании праймера в ДНК гибридизация с гасящим олигонуклеотидом оказывается невозможной. Рис. 11 Схема работы праймеров-скорпионов Таким образом, после образования продукта реакции, петлевая часть адаптерной последовательности может гибридизоваться на внутреннюю часть фрагмента, что ведет к разобщению флуорофора и гасителя флуоресценции и, как следствие, у усилению сигнала. 1.3.1.2.2 Линейные разрушаемые пробы (TaqMan) В данном подходе, олигонуклеотид, комплементарный продукту ПЦР, метят флуорофором и гасителем флуоресценции. В отсутствии мишени флуорофор и гаситель сближены и флуоресценция подавлена. При накоплении соответствующего продукта реакции, проба гибридизуется на ампликон, что ведет к ее разрушению за счет 5ʹ-экзонуклеазной активности Taq -полимеразы (Рис. 12).
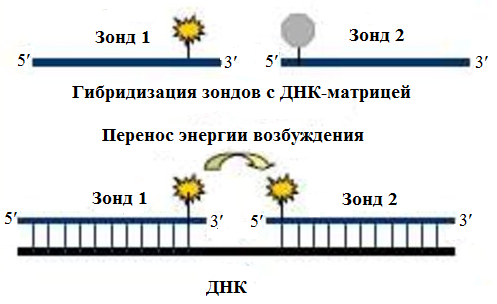
Рис. 12 Схема действия механизма TaqMan При этом интенсивность сигнала нарастает пропорционально увеличению количества ампликонов. В данном подходе, принципиальным моментом является использование ДНК-полимераз с хорошо выраженной 5ʹ-экзонуклеазной активностью. 1.3.1.2.3 Пробы с инвертированными концевыми повторами (ИКП) (молекулярные "маячки", molecular beacons) В данной методике флуорофор и гаситель располагают на противоположных концах олигонуклеотида. Зонды, находящиеся в растворе при температуре ниже 55-60°С образуют структуру типа "стебель-петля" с очень низким уровнем флуоресценции. При гибридизации с ампликоном зонд разворачивается, что ведет к увеличению уровня флуоресценции (Рис. 13). Рис. 13 Схема работы молекулярных "маячков" 1.3.1.2.4 Метки, работающие на основе метода флуоресцентного резонансного переноса энергии (fluorescent resonance energy transfer, FRET). В данной методике используются 2 олигонуклеотидных зонда, каждый из которых помечен своим флуорофором, один из которых имеет максимум поглощения в более коротковолновой, а другой в более длинноволновой части спектра. Метки подбираются таким образом, чтобы максимум эмиссии флуорофора с более коротковолновым максимумом поглощения был близок к максимуму поглощения второго флуорофора. Таким образом, один зонд несет флуорофор-донор, а другой - флуорофор-акцептор флуоресценции. Последовательность зондов задается таким образом, чтобы они могли гибридизоваться с матричной ДНК в непосредственной близости друг от друга. Гибридизация двух зондов с матрицей ведет к сближению флуорофоров и к туннельному переносу энергии с донора на акцептор (Рис. 14). Детекцию продуктов амплификации ведут посредством регистрации флуоресценции флуорофора-акцептора при длине волны возбуждения флуорофора-донора. Данный подход наиболее широко используется при анализе однонуклеотидных полиморфизмов (single nucleotide polymorphisms, SNPs).
Рис. 14 Детекция продуктов ПЦР методом FRET Мостиковая ПЦР
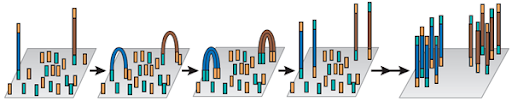
Одним из методов, позволяющих решить данную задачу, является мостиковая ПЦР (bridge PCR). Принцип данного метода заключается в проведении ПЦР с праймерами, прикрепленными к твердой подложке, наподобие предметного стекла. С пришитого к поверхности праймера синтезируется фрагмент ДНК. После этапа денатурации, фрагмент снова взаимодействует с праймером на поверхности, образую дугу (мостик) между двумя точками на подложке (Рис. 15).
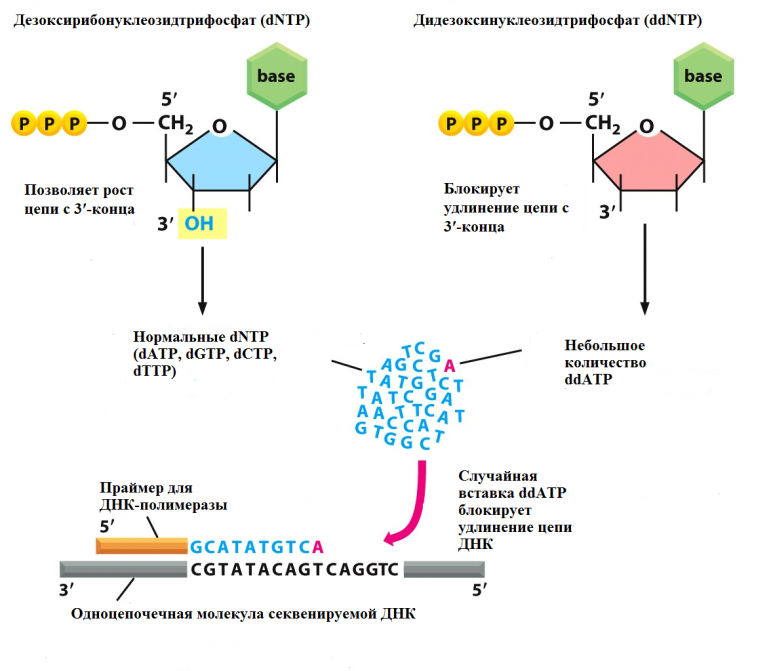
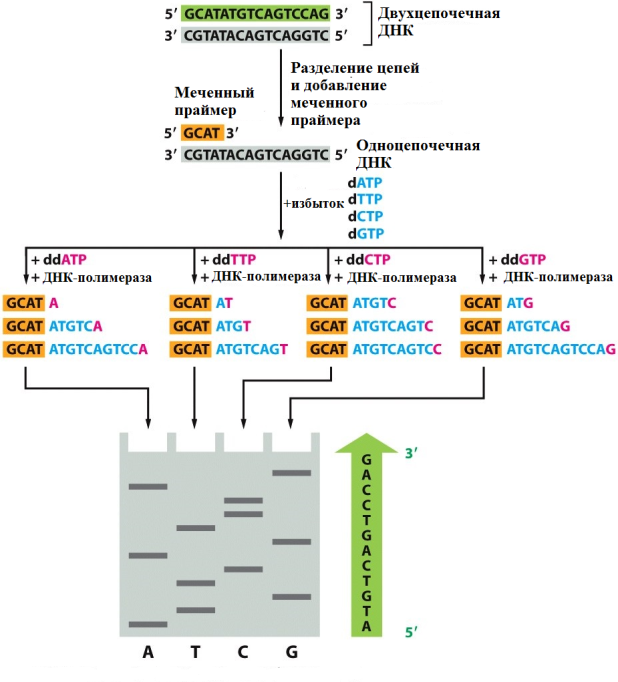
Рис. 15 Принцип действия мостиковой ПЦР При повторных циклах ПЦР, из точки синтеза первого фрагмента колония фрагментов ДНК будет быстро расти. Технология мостиковой ПЦР используется для создания клональных библиотек фрагментов ДНК в приборах компании Illumina. Рис. 16 Принцип действия эмульсионной ПЦР Для оценки качества библиотеки, полученной с помощью эмульсионной капельной ПЦР исходят из правила, что соотношение числа "сработавших" микросфер к "несработавшим" должно быть примерно 30/70. Оценить количество сработавших микросфер можно посредством измерения флуоресценции несущих ДНК микросфер относительно несработавших. Для этого применяется набор реагентов Ion Sphere Quality Control Kit (Life Technologies, Thermo Fisher). Рис. 17 Принцип работы цифровой капельной ПЦР Это позволяет проводить амплификацию молекул ДНК и идентифицировать ПЦР-продукты, полученные с каждой отдельной ДНК-матрицы, при этом не требуются использовать стандарты. Данный метод незаменим для решения таких задач, как определение редких последовательностей ДНК, например, соматических мутаций клеток опухолей в парафинизированных гистологических срезах и биоптатах, даже при низком количестве целевой ДНК, выявление наличия циркулирующих опухолевых клеток в очень небольшом титре у пациентов, высокоточное определение количества копий гена, анализ экспрессии генов и miRNA единичных клеток в неоднородных популяциях, оценка качества приготовления образцов для высокопроизводительного секвенирования (секвенирования нового поколения, new generation sequencing, NGS) для улучшения качества результатов сиквенса, выявление загрязнения даже единичными бактериальными клетками или вирусными частицами. Преимуществами цифровой ПЦР по сравнению с ПЦР в реальном времени являются: - прямое обнаружение редкого варианта мишени в сложном окружении; - исключительная чувствительность и точность даже при анализе единичных молекул ДНК; - отсутствие калибровочных кривых и отсутствие эффекта первых циклов ПЦР; - низкая чувствительность к присутствию ингибиторов. Рис. 18 Принцип метода Максама-Гилберта Расщепление одинаковых, помеченных с одного из концов, фрагментов ДНК по разным позициям дает фрагменты разной длины, затем фрагменты могут быть разделены с помощью электрофореза Например, реакция определения положения гуанина выглядит так: при помощи диметилсульфата проводят метилирование ДНК, в результате которого гуанин метилируется по положению 3, а аденин - по положению 7. Дальнейшая обработка соляной кислотой при 0°С приводит к выпадению из цепи метиладенина (апуринизация по остаткам аденина). Такую ДНК с "пустыми" остатками дезоксирибозы в позициях, где был аденин, можно гидролизовать при нагревании в щелочи. Гидролиз в случае с метилгуанином осуществляется при помощи пиперидина. Модификации по пиримидиновым основаниям (C и Т) проводят с гидразином. Если реакцию проводить в присутствии NaCl, модификация затронет только C. Гидролиз обработанной гидразином ДНК проводят пиперидином. После обработки, все четыре образца наносят на параллельные дорожки денатурирующего полиакриламидного геля (ПААГ), и проводят электрофорез таким образом, чтобы получить разделение фрагментов, отличающихся на один нуклеотид. Далее с помощью рентгеновской пленки получают электрофореграмму, по которой можно восстановить последовательность нуклеотидов, исследуемого фрагмента ДНК, отсчитывая, в какой из 4-х дорожек оказался фрагмент, следующий за самым легким продуктом, т.е. обладающим наибольшей электрофоретической подвижностью. Таким способом удается определить последовательность до 200 нуклеотидов за одно прочтение. В настоящее время метод Максама-Гилберта почти не используется в виду сложности пробоподготовки и необходимости работы с вредными реактивами. В основе большинства используемых на сегодняшний день методов секвинирования ДНК лежит метод терминаторов (метод Сэнгера). Тем не менее, метод Максама-Гилберта имеет ряд неоспоримых преимуществ, главными из которых являются его полная независимость от вторичных структур и отсутствие необходимости знания участка последовательности, интересующей исследователя ДНК. В связи с этим, до последнего времени, метод Максама-Гилберта использовался в случаях, когда фермент ДНК-полимераза не мог пройти через вторичную структуру в исследуемом образце ДНК, например через псевдоузел. Рис. 19 Структурные формулы нуклеотидов, используемых для обычного синтеза (А) и остановки синтеза ДНК (В) В отличие от обычного субстрата ДНК-полимеразы, дезоксинуклеозидтрифосфатов (dNTP), ddNTP не несут ОН-группы в 3ʹ-положении дезоксирибозы и вследствие этого не способны к присоединению ДНК-полимеразой следующего нуклеотида. Фрагмент ДНК, последовательность которого требуется определить, добавляется в реакцию аналогичную ПЦР: реакционная смесь включает термостабильную ДНК-полимеразу, dNTP всех четырех типов и праймеры, выступающие в качестве затравок для синтеза дочерних цепей ДНК.
Рис. 20 Принцип метода Сэнгера. Удлинение цепи ДНК ферментом происходит до момента включения ddNTP. Разделение полученных фрагментов методом электрофореза в геле позволяет определить последовательность нуклеотидов. Помимо этих компонентов, в реакционную смесь добавляются 4 соответствующих ddNTP (ddA, ddT, ddG и ddC) в концентрациях примерно в 20 раз меньше, чем dNTP. Каждый ddNTP помечен своим флуоресцентным красителем, что позволяет производить анализ в одной пробирке. Ранее для этой цели использовали изотопы P32, а реакцию проводили в 4-х отдельных пробирках для каждого азотистого основания, как и в методе Максама-Гилберта. В ходе ферментативного синтеза ДНК, в каком-то из положений случайным образом происходит включение в строящуюся цепь меченного ddNTP вместо обычного dNTP, что приводит к остановке синтеза, так как отсутствие 3ʹ-ОН группы блокирует образование фосфодиэфирной связи со следующим нуклеотидом. Реакцию проводят в циклическом режиме (как при ПЦР). Так как ddNTP составляют примерно 5% от dNTP, а мечение включает 40-50 циклов, в конце такой линейной амплификации получается набор одиночных цепей ДНК, отличающихся по длине и всегда заканчивающихся меченным нуклеотидом (Рис. 20). После мечения проводят разделение полученных одноцепочечных фрагментов методом электрофореза в ПААГ. В настоящее время данный процесс полностью автоматизирован. Автоматические секвенаторы позволяют проводить электрофорез меченных фрагментов ДНК в тонком капилляре, заполненном гелем (Рис. 21).
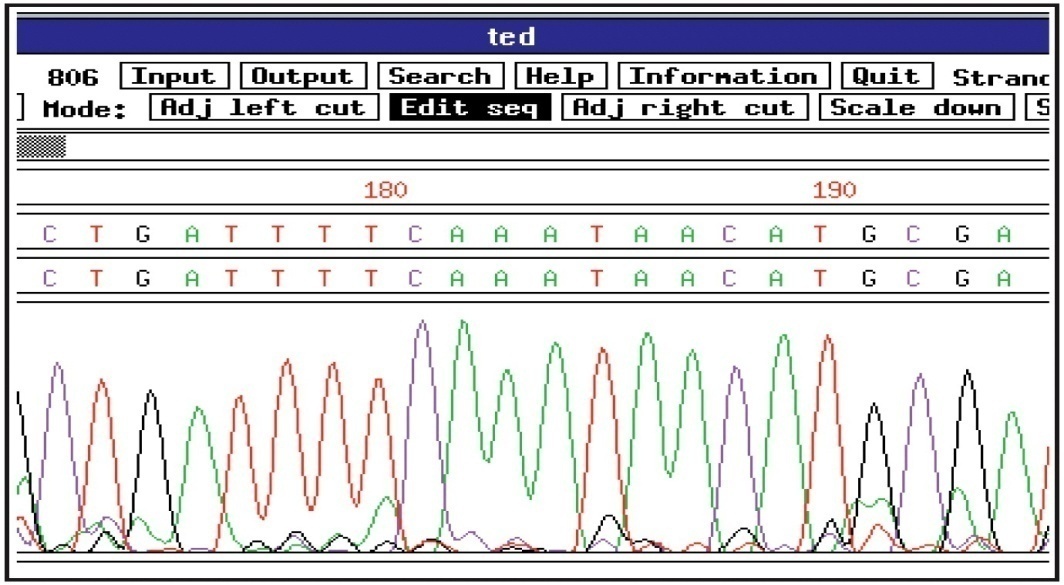
Рис. 21 Капиллярный автоматический секвенатор ABI 3130 xl Applied Biosystems (США) Детекция разделенных фрагментов происходит на дальнем конце капилляра за счет регистрации флуоресценции терминальных ddNTP, проходящих через детектор фрагментов ДНК. В зависимости от типа терминального ddNTP прибор регистрирует флуоресценцию в той или иной области спектра. Данные спектрограммы и прочтение нуклеотидной последовательности отображаются на экране компьютера (Рис. 22).
Рис. 22 Спектрограмма, полученная в результате секвенирования по методу Сэнгера на автоматическом секвенаторе Анализ данных капиллярного секвенирования сводится к "прочтению" последовательных пиков флуоресценции. В настоящее время, с использованием современных автоматических секвенаторов, длина одного прочтения по методу Сэнгера составляет 800-1000 нуклеотидов. Рис. 23 Принцип метода секвенирования на чипе После удаления несвязавшихся молекул ДНК можно зарегистрировать сигнал флуоресценции в тех участках чипа, где находится олигонуклеотид, комплементарная последовательность которого есть в секвенируемом образце ДНК. Полученный гибридизационный паттерн можно использовать для восстановления исходной последовательности путем сборки перекрывающихся участков сработавших проб (Рис. 23). К сожалению, невозможно подобрать условия, при которых с олигонуклеотидами будут гибридизоваться только полностью комплементарные фрагменты. Всегда находятся GC-богатые участки, которые будут гибридизоваться и при наличии одного или даже нескольких неспаренных оснований. В связи с этим, метод SBH пока не нашел широкого практического применения. Тем не менее, алгоритмы, разработанные на основе SBH для сборки коротких прочтений в более длинные фрагменты, стали основой для последующих алгоритмов высокоскоростной сборки и выравнивания, используемых с технологиях секвенирования нового поколения (new generation sequencing, NGS). Рис. 24 Принцип секвенирования ДНК на основе метода MALDI - TOF Заряженные молекулы ДНК в газовой фазе под действием высокого напряжения ускоряются в электрическом поле и попадают на детектор. Затем проводят повторный раунд расщепления и определения масс более мелких фрагментов. На основании полученных данных может быть вычислена масса анализируемой молекулы и расшифрована последовательность сравнительно короткого гомогенного фрагмента (Рис. 24). В настоящее время, метод MALDI-TOF не используется в коммерческих вариантах секвенаторов. Рис. 25 Секвенирование методом лигирования В настоящее время, данный принцип секвенирования реализуется в коммерческих технологиях Prolonator (Dover/Harvard) и SOLiD (Life Technologies Thermo Fisher Scientific). Рис. 26 Принцип метода пиросеквенирования Ферментативные реакции осуществляются АТФ-сульфурилазой, люциферазой и апиразой. Также в месте с ними в ячейке присутствуют аденозинфосфосульфат (APS) и люциферин. Выделяющийся в ходе образования очередной фосфодиэфирной связи пирофосфат вступает в реакцию с APS, катализируемую АТФ-сульфурилазой, с образованием АТФ. Образовавшийся АТФ является источником энергии для люциферазной реакции окисления люциферина в оксилюциферин, в процессе которой генерируются кванты света в видимой области спектра, в количестве, пропорциональном количеству включенных в растущую цепь ДНК нуклеотидов. Световой сигнал регистрируется ПЗС-матрицей (подобной тем, которые используются в обычных цифровых фотоаппаратах) и анализируется при помощи программного обеспечения, преобразующего так называемую пирограмму в последовательность нуклеотидов (Рис. 26). Не вовлеченные в синтез новой цепи нуклеотиды, а также АТФ деградируются при помощи апиразы. После этого можно начинать следующий цикл, т.е. добавлять другой тип нуклеотида. На принципе пиросеквенирования основана коммерческая технология 454 Life Sciences Roche. Рис. 27 Принцип секвенирования синтезом клональной библиотеки одноцепочечных фрагментов ДНК на твердой фазе Невключившиеся нуклеотиды смывают, и оптическая система считывает флуоресценцию каждой ДНК-колонии библиотеки. Каждая колония высвечивает при этом кванты флуоресценции, соответствующие включившемуся на данном этапе нуклеотиду. После этого флуорофор, наряду с 3ʹ-концевым блокатором, химически удаляют из синтезированной цепи, что позволяет повторить весь цикл сначала (Рис. 27). В отличие от пиросеквенирования в данном подходе сигнал флуоресценции можно регистрировать в течение длительного времени после присоединения очередного нуклеотида, что позволяет производить анализ очень большого количества ДНК-колоний. На данном принципе секвенирования основаны коммерческие технологии компаний Illumina и Pacific Bioscience. 2.8 Полупроводниковое секвенирование (регистрация акта присоединения нуклеотида по образующимся ионам водорода)
|
|||||||||
|
Последнее изменение этой страницы: 2020-10-24; просмотров: 547; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.54.199 (0.104 с.) |
 Ранее, клонирование с использованием библиотек ДНК было единственным способом изолировать ген или исследуемый фрагмент ДНК. Этот подход и в настоящее время сохраняет свою актуальность при полногеномном секвенировании, а также при работе с очень большими генами. Гораздо более быструю и простую альтернативу для многих приложений клонирования, в особенности для тех организмов, чьи полные последовательности геномов секвенированы, предлагает метод полимеразной цепной реакции (ПЦР) (polymerase chain reaction, PCR), предложенный в 1983 г. сотрудником компании "Cetus" Кэри Муллисом, удостоенным за данное изобретение Нобелевской премии по химии. В настоящее время, метод ПЦР в той или иной его модификации является неотъемлемой частью любого молекулярно-биологического исследования. В медицине ПЦР применяют для диагностики инфекционных и наследственных заболеваний, при диагностике рака и иммунных патологий. В криминалистике и судебной медицине ПЦР используют для идентификации личности, определения биологического родства индивидов и анализе образцов биологического материала, собранного на месте преступления. Санитарно-эпидемиологические службы используют ПЦР для контроля за микробиологическим загрязнением окружающей среды и продуктов питания, а также для выявления генетически модифицированных продуктов (ГМО). В научно-исследовательских лабораториях, ПЦР используют для изучения нуклеиновых кислот и проведения манипуляций с ними. Благодаря ПЦР стало возможным быстрое получение участков ДНК в чистом виде и достаточном количестве. На основе ПЦР были созданы современные технологии секвенирования нуклеиновых кислот (ДНК и РНК). Внедрение ПЦР в медицину открыло новое диагностическое направление - ДНК-диагностику.
Ранее, клонирование с использованием библиотек ДНК было единственным способом изолировать ген или исследуемый фрагмент ДНК. Этот подход и в настоящее время сохраняет свою актуальность при полногеномном секвенировании, а также при работе с очень большими генами. Гораздо более быструю и простую альтернативу для многих приложений клонирования, в особенности для тех организмов, чьи полные последовательности геномов секвенированы, предлагает метод полимеразной цепной реакции (ПЦР) (polymerase chain reaction, PCR), предложенный в 1983 г. сотрудником компании "Cetus" Кэри Муллисом, удостоенным за данное изобретение Нобелевской премии по химии. В настоящее время, метод ПЦР в той или иной его модификации является неотъемлемой частью любого молекулярно-биологического исследования. В медицине ПЦР применяют для диагностики инфекционных и наследственных заболеваний, при диагностике рака и иммунных патологий. В криминалистике и судебной медицине ПЦР используют для идентификации личности, определения биологического родства индивидов и анализе образцов биологического материала, собранного на месте преступления. Санитарно-эпидемиологические службы используют ПЦР для контроля за микробиологическим загрязнением окружающей среды и продуктов питания, а также для выявления генетически модифицированных продуктов (ГМО). В научно-исследовательских лабораториях, ПЦР используют для изучения нуклеиновых кислот и проведения манипуляций с ними. Благодаря ПЦР стало возможным быстрое получение участков ДНК в чистом виде и достаточном количестве. На основе ПЦР были созданы современные технологии секвенирования нуклеиновых кислот (ДНК и РНК). Внедрение ПЦР в медицину открыло новое диагностическое направление - ДНК-диагностику.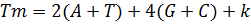 , где
, где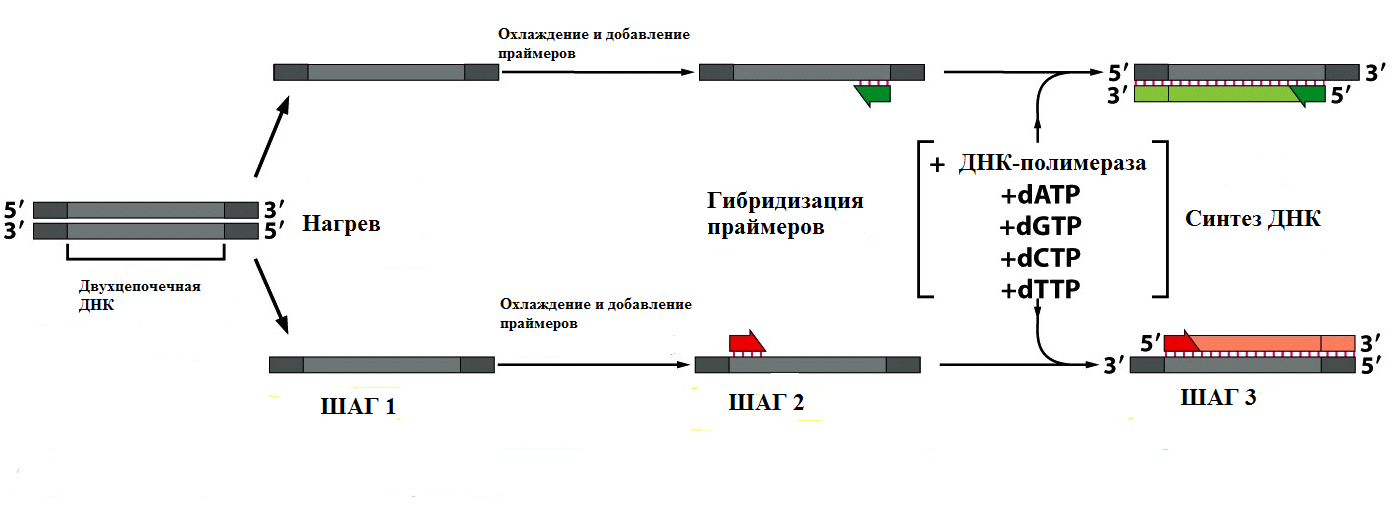
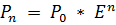 (1)
(1)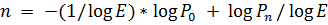 (2)
(2)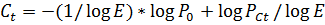 (3)
(3)