
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кроме того, теплоемкость зависит от способа подвода теплоты q к газу.Содержание книги
Поиск на нашем сайте В зависимости от этого различают: Теплоемкость газа при подводе теплоты к газу при его постоянном давлении (изобарная теплоемкость). Теплоемкость газа при подводе теплоты к газу при его постоянном объеме (изохорная теплоемкость). Отсюда- отсутствие изотермической и адиабатной теплоемкости. Таким образом, в термодинамике используются следующие теплоемкости:
2.2 Внутренняя энергия рабочего тела
Эту энергию можно представить как сумму отдельных видов энергий: 1) Кинетической энергии молекул (поступательного и вращательного движения молекул); 2) Колебательного движения атомов в самой молекуле; Энергии электронов и т.д.
Кинетическая и колебательная энергии молекул являются функцией температуры (поскольку с повышением температуры интенсифицируется Броуновское движение молекул). Значение кинетической энергии зависит от среднего расстояния между молекулами и, следовательно, от занимаемого газом объема V и давления газа
Величина Для идеального газа удельная внутренняя энергия определяется по формуле:
Изменение внутренней энергии идеального газа для любого процесса (изобарного, изохорного и т.д.) определяется по формуле:
2.3 Энтальпия рабочего тела
В термодинамике важную роль играет сумма внутренней энергии системы U и произведения давления системы Р на ее объем V, называемая энтальпией и обозначаемая I:
Величина
Удельную энтальпию идеального газа можно также определить по формуле:
Таким образом, удельная энтальпия показывает, какое количество теплоты содержится в 1кг идеального газа (рабочего тела). По аналогии с удельной внутренней энергией идеального газа, изменение удельной энтальпии идеального газа для любого процесса (изобарного, изохорного и т.д.) определяется по формуле:
Как видно из формул для определения удельной внутренней энергии и удельной энтальпии идеального газа, в расчетах в основном пользуются средней теплоемкостью. Лекция №3
3.1 Работа идеального газа
Пример (воздушный шарик, к которому подводится тепло, а не вдувается воздух). Если бесконечно малое расширение рабочего тела за счет подвода к нему теплоты, происходит во внешней среде (например, в атмосферном воздухе), находящегося повсюду под одним и тем же давлением Р, то увеличение объема V рабочего тела на бесконечно малую величину dV сопровождается работой:
которую совершает рабочее тело над окружающей средой и называется работой изменения объема (механическая работа). Из этой формулы следует, что 1) если 2) если же При изменении объема тела от значения объема
Для 1кг газа:
Это так называемая ”грязная” работа или работа ”брутто”.
|
|||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-10-24; просмотров: 300; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.220 (0.006 с.) |
||||||||||||||||||||||||||||

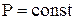 )
)
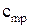
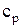
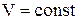 )
)
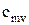
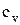
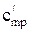
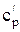
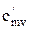
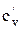
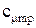
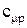
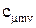
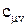
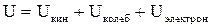 (2.9)
(2.9)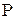 , т.е. является функцией давления и объема:
, т.е. является функцией давления и объема: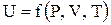 (2.10)
(2.10)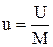 называется удельной внутренней энергией (
называется удельной внутренней энергией (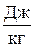 ) и представляет собой внутреннюю энергию 1кг идеального газа.
) и представляет собой внутреннюю энергию 1кг идеального газа.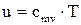
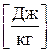 (2.11)
(2.11)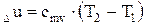 (2.12)
(2.12)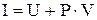
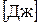 (2.13)
(2.13)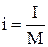 называется удельной энтальпией (
называется удельной энтальпией (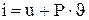
 (2.14)
(2.14)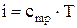
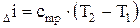 (2.16)
(2.16)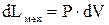
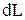 и
и 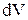 всегда имеют одинаковые знаки:
всегда имеют одинаковые знаки: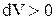 , то и
, то и 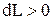 , т.е. при расширении работа тела положительна, при этом рабочее тело само совершает работу;
, т.е. при расширении работа тела положительна, при этом рабочее тело само совершает работу;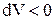 , то и
, то и 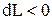 , т. е. при сжатии работа тела отрицательна; это означает, что не рабочее тело совершает работу, а на его сжатие затрачивается работа извне.
, т. е. при сжатии работа тела отрицательна; это означает, что не рабочее тело совершает работу, а на его сжатие затрачивается работа извне.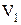 до значения
до значения 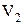 работа, совершаемая системой, будет равняться:
работа, совершаемая системой, будет равняться: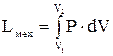 (3.2)
(3.2)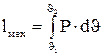 (3.3)
(3.3)


