
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Силами притяжения и отталкивания между молекулами газа.
Таким образом, чем ниже плотность реального газа, тем он ближе по своим свойствам к идеальному газу. Уравнение состояния идеального газа вывел в 1834 году французский ученый Эмиль Клапейрон. Уравнение состояния идеального газа связывает температуру, давление и плотность газа (или, другими словами, рабочего тела): - для М кг газа:
- для 1кг газа:
где
где
1.3 Смеси идеальных газов
В термодинамике пользуются понятиями чистого вещества и смеси. Чистое вещество -это вещество, молекулы которого одинаковы. Например, чистые вещества -это вода, азот железо. Смесь состоит из нескольких чистых веществ. Примерами смесей могут служить: воздух, сплавы металлов и т.д. Рассмотрим в качестве примера воздух, который, в грубом приближении, является смесью кислорода Состав газовой смеси может быть задан: 1) Массовыми долями; Объемными долями. Массовая доля- это отношение массы отдельного газа, входящего в смесь, к массе всей смеси:
где
В общем виде массовая доля i-го компонента в смеси определяется по формуле:
Объемная доля- это отношение объема отдельного газа, входящего в смесь, к объему всей смеси. На примере кислорода:
где
В общем виде объемная доля i-го компонента в смеси определяется по формуле:
Суммы массовых и объемных долей компонентов смеси равны единице:
В общем виде это записывается так:
Плотность смеси
Газовая постоянная смеси
Кажущаяся молекулярная масса смеси
Парциальное давление
Давление газовой смеси представляет собой сумму парциальных давлений отдельных компонентов смеси (закон Дальтона):
Исходя из уравнения (16) давление воздуха определяется по формуле:
Лекция №2
2.1 Теплоемкость идеального газа
Таким путем ученые пришли к понятию ”удельная теплоемкость вещества”. В курсе ”Термодинамика” мы будем рассматривать теплоемкости газов. Удельной теплоемкостью газа называется количество теплоты, которое необходимо для того, чтобы нагреть единицу количества газа (1кг, 1м3, 1моль) на один градус. Поэтому различают: 1) Массовую теплоемкость:
где
2) Объемную теплоемкость:
3) Мольную теплоемкость:
где Массовая, объемная и мольная теплоемкости связаны выражениями:
где
Теплоемкость не является постоянной величиной. Она зависит от температуры, т.е. В зависимости от этого различают: Среднюю теплоемкость Истинную теплоемкость. Разница между средней и истинной теплоемкостями заключается в следующем: - математическая запись средней теплоемкости:
- математическая запись истинной теплоемкости:
|
||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-10-24; просмотров: 163; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.244.201 (0.02 с.) |
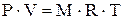 (1.6)
(1.6)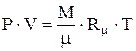 (1.7)
(1.7)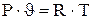 (1.8)
(1.8)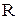 - газовая постоянная, которая определяется по формуле:
- газовая постоянная, которая определяется по формуле: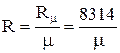
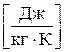 (1.9)
(1.9) - молекулярная масса газа,
- молекулярная масса газа, 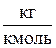 ;
;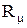 - универсальная газовая постоянная, которая равна:
- универсальная газовая постоянная, которая равна: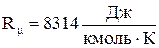
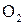 и азота
и азота 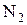 .
.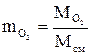 (1.10)
(1.10) (1.11)
(1.11)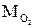 и
и 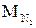 - масса кислорода и масса азота в смеси.
- масса кислорода и масса азота в смеси.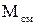 - масса всей смеси.
- масса всей смеси.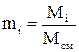 (1.12)
(1.12)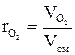 (1.13)
(1.13)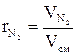 (1.14)
(1.14)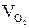 и
и  - объем кислорода и объем азота в смеси.
- объем кислорода и объем азота в смеси.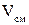 - объем всей смеси.
- объем всей смеси.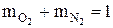
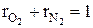
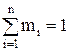
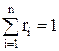
 определяется по формулам:
определяется по формулам: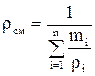 ;
; 
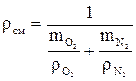 ;
; 
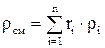 ;
; 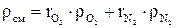
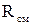 определяется по формулам:
определяется по формулам: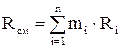 ;
; 
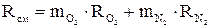
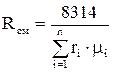 ;
; 
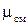 определяется по формулам:
определяется по формулам: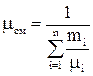 ;
; 
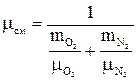
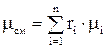 ;
; 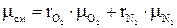
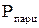 (давление отдельного компонента смеси) определяется по формулам:
(давление отдельного компонента смеси) определяется по формулам: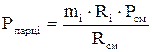 ;
; 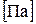

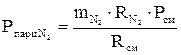
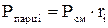 ;
; 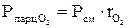
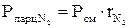
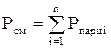 (1.16)
(1.16)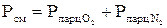

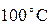 смешивается с 1 литром ртути при температуре
смешивается с 1 литром ртути при температуре 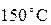 . Мы знаем, что среднее арифметическое
. Мы знаем, что среднее арифметическое 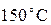 есть
есть 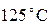 . Мы знаем, что температура, равная
. Мы знаем, что температура, равная 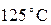 получается при смешении холодной воды при температуре
получается при смешении холодной воды при температуре 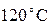 вместо
вместо 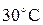 , вода же нагрелась только на
, вода же нагрелась только на 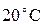 . Ртуть поэтому имеет меньшую емкость для теплоты, чем вода” (рисунок 2.1).
. Ртуть поэтому имеет меньшую емкость для теплоты, чем вода” (рисунок 2.1).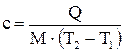
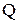 - количество теплоты, подведенной к газу, Дж;
- количество теплоты, подведенной к газу, Дж;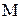 - масса газа, кг;
- масса газа, кг; и
и 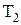 - начальная и конечная температуры газа, К;
- начальная и конечная температуры газа, К;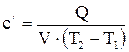
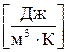 (2.2)
(2.2)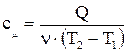
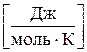 (2.3)
(2.3)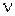 - количество молей газа, моль.
- количество молей газа, моль.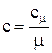 (2.4)
(2.4)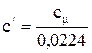 (2.5)
(2.5)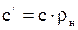 (2.6)
(2.6)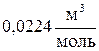 - объем 1 моля идеального газа;
- объем 1 моля идеального газа;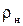 - плотность газа при нормальных условиях,
- плотность газа при нормальных условиях,  .
.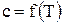 .
.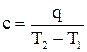 где
где 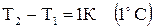 (2.7)
(2.7)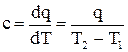 где
где 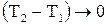 (2.8)
(2.8)


