
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Интенсивные свойства, определяющие состояние термодинамической системы, называются термодинамическими параметрами состояния системы.Стр 1 из 8Следующая ⇒
Лекция №1
1.1 Основные понятия и определения термодинамики
Термодинамика- это наука о закономерностях превращения различных видов энергии. Наиболее часто встречаются в природе такие виды энергии как тепловая и механическая энергии. Объектом изучения термодинамики являются различные термодинамические системы. Термодинамическая система представляет собой тело, способное обмениваться с другими телами энергией и веществом. То, что находится вне термодинамической системы, называется окружающей средой. Например, термодинамическая система- это газ, находящийся в цилиндре двигателя автомобиля, а окружающая среда- это сам цилиндр, поршень, уличный воздух. Вещество (например, вода) обычно пребывает в одном из трёх состояний: - в твердом; - жидком; - или газообразном состоянии. Очевидно, что одно и то же вещество (например, вода) при разных условиях (давление и температура) может находиться в различных состояниях и соответственно свойства вещества будут различными. Свойства термодинамической системы могут быть: - интенсивными; - экстенсивными. Интенсивными называют свойства, не зависящие от количества вещества в термодинамической системе (например, температура). Свойства, зависящие от массы вещества, называют экстенсивными (например, объем). Объем 10кг рабочего тела при одних и тех же условиях будет в 10 раз больше, чем объем 1кг рабочего тела. Интенсивные свойства, определяющие состояние термодинамической системы, называются термодинамическими параметрами состояния системы. Наиболее удобными параметрами состояния являются: - абсолютная температура ( - абсолютное давление ( - плотность (удельный объем) рабочего тела. Температурой называется физическая величина, характеризующая степень нагретости тела. В качестве параметра состояния системы принимают абсолютнуютемпературу Т. Она всегда положительна. В системе СИ абсолютная температура выражается в градусах Кельвина (К). На практике применяется измерение температуры в градусах Цельсия ( Соотношение между температурами в градусах Кельвина (Т) и градусах Цельсия (t) имеет вид:
Давление с точки зрения молекулярно-кинетической теории есть сила ударов молекул газа, находящихся в непрерывном хаотическом движении, о единицу площади стенки сосуда, в котором заключено рабочее тело:
В системе СИ давление выражается в Паскалях. Размерами молекул газа. Объемными долями. Массовая доля- это отношение массы отдельного газа, входящего в смесь, к массе всей смеси:
где
В общем виде массовая доля i-го компонента в смеси определяется по формуле:
Объемная доля- это отношение объема отдельного газа, входящего в смесь, к объему всей смеси. На примере кислорода:
где
В общем виде объемная доля i-го компонента в смеси определяется по формуле:
Суммы массовых и объемных долей компонентов смеси равны единице:
В общем виде это записывается так:
Плотность смеси
Газовая постоянная смеси
Кажущаяся молекулярная масса смеси
Парциальное давление
Давление газовой смеси представляет собой сумму парциальных давлений отдельных компонентов смеси (закон Дальтона):
Исходя из уравнения (16) давление воздуха определяется по формуле:
Лекция №2
2.1 Теплоемкость идеального газа
Таким путем ученые пришли к понятию ”удельная теплоемкость вещества”. В курсе ”Термодинамика” мы будем рассматривать теплоемкости газов. Удельной теплоемкостью газа называется количество теплоты, которое необходимо для того, чтобы нагреть единицу количества газа (1кг, 1м3, 1моль) на один градус. Поэтому различают: 1) Массовую теплоемкость:
где
2) Объемную теплоемкость:
3) Мольную теплоемкость:
где Массовая, объемная и мольная теплоемкости связаны выражениями:
где
Теплоемкость не является постоянной величиной. Она зависит от температуры, т.е. В зависимости от этого различают: Среднюю теплоемкость Истинную теплоемкость. Разница между средней и истинной теплоемкостями заключается в следующем: - математическая запись средней теплоемкости:
- математическая запись истинной теплоемкости:
Энергии электронов и т.д.
Кинетическая и колебательная энергии молекул являются функцией температуры (поскольку с повышением температуры интенсифицируется Броуновское движение молекул). Значение кинетической энергии зависит от среднего расстояния между молекулами и, следовательно, от занимаемого газом объема V и давления газа
Величина Лекция №3
3.1 Работа идеального газа
Пример (воздушный шарик, к которому подводится тепло, а не вдувается воздух). Если бесконечно малое расширение рабочего тела за счет подвода к нему теплоты, происходит во внешней среде (например, в атмосферном воздухе), находящегося повсюду под одним и тем же давлением Р, то увеличение объема V рабочего тела на бесконечно малую величину dV сопровождается работой:
которую совершает рабочее тело над окружающей средой и называется работой изменения объема (механическая работа). Из этой формулы следует, что 1) если 2) если же При изменении объема тела от значения объема
Для 1кг газа:
Это так называемая ”грязная” работа или работа ”брутто”. Лекция №4
4.1.1 Изотермический процесс
Изотермический процесс – это процесс подвода или отвода теплоты от рабочего тела при постоянной температуре рабочего тела ( Запишем уравнение состояния идеального газа для начального и конечного состояний газа:
Выразим
Левые части этих уравнений равны. Соответственно равны и правые части этих уравнений:
Поскольку мы рассматриваем изотермический процесс, при котором
Формулу (3.33) можно переписать в другом виде:
Запишем первый закон термодинамики:
Поскольку в изотермическом процессе
Механическая работа определяется по формуле (35):
Интегрирование этой формулы при условии
Однако не совсем ясно, какое давление следует подставлять в формулу (4.11) - Поэтому, вычислить механическую работу идеального газа по формуле (4.11) не представляется возможным.
Для определения механической работы в формуле (4.10) необходимо заменить Р на его выражение из уравнения состояния идеального газа:
Подставим формулу (61) в выражение (36):
В выражении (4.13) газовая постоянная R и температура Т- константы (поскольку рассматривается изотермический процесс) и их можно вынести за интеграл:
Поскольку для изотермического процесса справедливо соотношение:
то:
В формулах (63) и (65) в соответствии с уравнением состояния идеального газа выражение
4.1.2 Адиабатный процесс
Адиабатный процесс – это процесс, происходящий без теплообмена рабочего тела с окружающей средой или, другими словами, без подвода или отвода теплоты от рабочего тела ( Зависимости между начальными и конечными параметрами в адиабатном процессе следующие:
где к- показатель адиабаты:
Запишем первый закон термодинамики:
Поскольку в адиабатном процессе
или:
Механическую работу газа в адиабатном процессе можно определить по формулам:
Лекция №5
5.1 Цикл Карно
Очевидно, что чем больше теплоты ( В связи с этим, возникает вопрос: какое максимальное значение может иметь КПД цикла? Впервые этот вопрос изучил в 1827 году французский инженер Сади Карно. В результате своих исследований Карно предложил цикл, имеющий наивысший термический КПД в диапазоне температур горячего источника (
Рассмотрим цикл Карно в 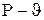 координатах. координатах.
На рисунке 5 изображены следующие процессы: 4-1- адиабатное сжатие смеси воздуха и топлива в цилиндре двигателя; 1-2- изотермический подвод теплоты к смеси воздуха и топлива (воспламенение и горение топливной смеси, например, от свечи зажигания). Продукты сгорания топлива расширяются, перемещают поршень в цилиндре и, следовательно, совершают работу. После того, как продукты сгорания топлива расширились до состояния, соответствующего точке 2, (все топливо сгорело и, следовательно, подвод теплоты прекращается), дальнейшее расширение газа до точки 3 происходит без подвода теплоты по адиабате.
Адиабатное расширение продуктов сгорания в цилиндре двигателя (топливо превратилось в продукты сгорания, следовательно, подвода теплоты нет). В процессе адиабатного расширения температура продуктов сгорания уменьшается, поскольку теплота к ним не подводится, и работа совершается только за счет изменения внутренней энергии продуктов сгорания.
Изотермическое вытеснение продуктов сгорания из цилиндра двигателя. На это затрачивается работа того же поршня. Одновременно с вытеснением продуктов сгорания из цилиндра, осуществляется передача теплоты продуктов сгорания холодному источнику теплоты. Таким образом, цикл Карно состоит из двух изотерм и двух адиабат. Работа, совершаемая газом при расширении, изображается в Лекция № 8
8.1 Термодинамический цикл поршневого компрессора
Аммиачные и т.д. По конструкции компрессоры делятся на: 1) Поршневые; 2) Винтовые; Ротационные и т.д. Таким образом, теоретически процесс 3-4 не совершается, поскольку в цилиндре отсутствует рабочее тело- газ. В действительности это не так. Поршень не может вплотную придвинуться к всасывающему и нагнетательному клапану и вытеснить весь воздух из цилиндра вследствие особенностей конструкции цилиндра. Объем между ВМТ и клапанами цилиндра называется мертвым объемом. Поэтому после вытеснения сжатого воздуха при давлении
Мертвый объем составляет около Следует различать индикаторную диаграмму и идеализированный цикл компрессора в В цикле компрессора, в отличие от циклов двигателей внутреннего сгорания, работа сжатия газа превышает работу расширения газа. Поэтому для осуществления такого цикла к компрессору необходимо подводить энергию извне. Поршень цилиндра присоединяется, например, к электродвигателю или двигателю внутреннего сгорания. Определим работу, которую необходимо затратить для сжатия газа в цилиндре или, другими словами, определим мощность электродвигателя или ДВС, которым необходимо оснастить компрессор. Работа, затрачиваемая на сжатие газа в процессе 1-2, определяется по формуле:
Работа сжатия Работа, совершаемая над сжатым газом в процессе его вытеснения в резервуар (процесс 2-3), это работа, совершаемая над газом в изобарном процессе:
Поскольку
На индикаторной диаграмме величина В процессе 3-4 работа ни самим рабочим телом, ни над самим рабочим телом не совершается, поскольку в процессе 3-4 отсутствует само рабочее тело:
Поскольку идеально организовать процесс охлаждения рабочего тела в компрессоре не удается, то он никогда не бывает изотермическим. Действительный процесс сжатия рабочего тела протекает по линии, находящейся между изотермой и адиабатой. Лекция №1
1.1 Основные понятия и определения термодинамики
Термодинамика- это наука о закономерностях превращения различных видов энергии. Наиболее часто встречаются в природе такие виды энергии как тепловая и механическая энергии. Объектом изучения термодинамики являются различные термодинамические системы. Термодинамическая система представляет собой тело, способное обмениваться с другими телами энергией и веществом. То, что находится вне термодинамической системы, называется окружающей средой. Например, термодинамическая система- это газ, находящийся в цилиндре двигателя автомобиля, а окружающая среда- это сам цилиндр, поршень, уличный воздух. Вещество (например, вода) обычно пребывает в одном из трёх состояний: - в твердом; - жидком; - или газообразном состоянии. Очевидно, что одно и то же вещество (например, вода) при разных условиях (давление и температура) может находиться в различных состояниях и соответственно свойства вещества будут различными. Свойства термодинамической системы могут быть: - интенсивными; - экстенсивными. Интенсивными называют свойства, не зависящие от количества вещества в термодинамической системе (например, температура). Свойства, зависящие от массы вещества, называют экстенсивными (например, объем). Объем 10кг рабочего тела при одних и тех же условиях будет в 10 раз больше, чем объем 1кг рабочего тела. Интенсивные свойства, определяющие состояние термодинамической системы, называются термодинамическими параметрами состояния системы. Наиболее удобными параметрами состояния являются: - абсолютная температура ( - абсолютное давление ( - плотность (удельный объем) рабочего тела.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-10-24; просмотров: 235; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.105.239 (0.123 с.) |
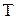 );
);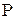 ),(
),(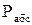 );
);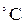 ).
).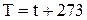
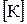 (1.1)
(1.1)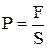
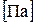
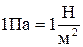 .
.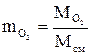 (1.10)
(1.10) (1.11)
(1.11)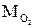 и
и 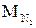 - масса кислорода и масса азота в смеси.
- масса кислорода и масса азота в смеси.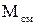 - масса всей смеси.
- масса всей смеси.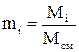 (1.12)
(1.12)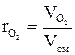 (1.13)
(1.13)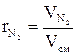 (1.14)
(1.14)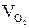 и
и  - объем кислорода и объем азота в смеси.
- объем кислорода и объем азота в смеси.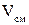 - объем всей смеси.
- объем всей смеси.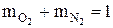
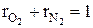
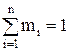
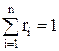
 определяется по формулам:
определяется по формулам: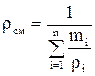 ;
; 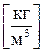
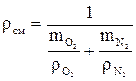 ;
; 
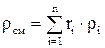 ;
; 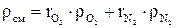
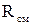 определяется по формулам:
определяется по формулам: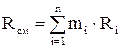 ;
; 
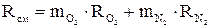
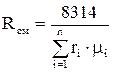 ;
; 
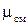 определяется по формулам:
определяется по формулам: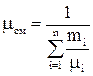 ;
; 
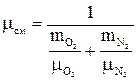
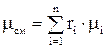 ;
; 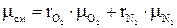
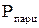 (давление отдельного компонента смеси) определяется по формулам:
(давление отдельного компонента смеси) определяется по формулам: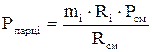 ;
; 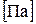

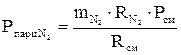
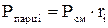 ;
; 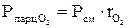
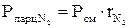
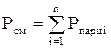 (1.16)
(1.16)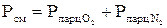

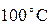 смешивается с 1 литром ртути при температуре
смешивается с 1 литром ртути при температуре 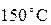 . Мы знаем, что среднее арифметическое
. Мы знаем, что среднее арифметическое 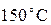 есть
есть 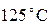 . Мы знаем, что температура, равная
. Мы знаем, что температура, равная 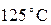 получается при смешении холодной воды при температуре
получается при смешении холодной воды при температуре 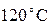 вместо
вместо 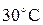 , вода же нагрелась только на
, вода же нагрелась только на 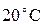 . Ртуть поэтому имеет меньшую емкость для теплоты, чем вода” (рисунок 2.1).
. Ртуть поэтому имеет меньшую емкость для теплоты, чем вода” (рисунок 2.1).
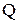 - количество теплоты, подведенной к газу, Дж;
- количество теплоты, подведенной к газу, Дж;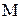 - масса газа, кг;
- масса газа, кг; и
и 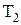 - начальная и конечная температуры газа, К;
- начальная и конечная температуры газа, К;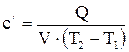
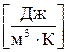 (2.2)
(2.2)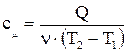
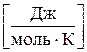 (2.3)
(2.3)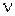 - количество молей газа, моль.
- количество молей газа, моль.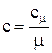 (2.4)
(2.4)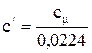 (2.5)
(2.5)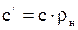 (2.6)
(2.6)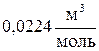 - объем 1 моля идеального газа;
- объем 1 моля идеального газа;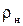 - плотность газа при нормальных условиях,
- плотность газа при нормальных условиях,  .
.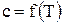 .
.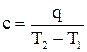 где
где 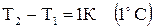 (2.7)
(2.7)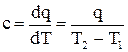 где
где 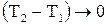 (2.8)
(2.8)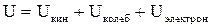 (2.9)
(2.9) , т.е. является функцией давления и объема:
, т.е. является функцией давления и объема: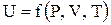 (2.10)
(2.10)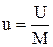 называется удельной внутренней энергией (
называется удельной внутренней энергией (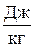 ) и представляет собой внутреннюю энергию 1кг идеального газа.
) и представляет собой внутреннюю энергию 1кг идеального газа.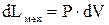
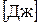 (3.1)
(3.1)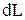 и
и 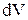 всегда имеют одинаковые знаки:
всегда имеют одинаковые знаки: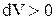 , то и
, то и 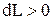 , т.е. при расширении работа тела положительна, при этом рабочее тело само совершает работу;
, т.е. при расширении работа тела положительна, при этом рабочее тело само совершает работу;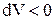 , то и
, то и 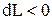 , т. е. при сжатии работа тела отрицательна; это означает, что не рабочее тело совершает работу, а на его сжатие затрачивается работа извне.
, т. е. при сжатии работа тела отрицательна; это означает, что не рабочее тело совершает работу, а на его сжатие затрачивается работа извне.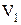 до значения
до значения 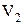 работа, совершаемая системой, будет равняться:
работа, совершаемая системой, будет равняться: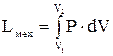 (3.2)
(3.2)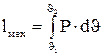 (3.3)
(3.3)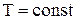 ).
).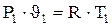 (4.1)
(4.1)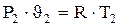 (4.2)
(4.2)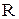 из первого и второго уравнений:
из первого и второго уравнений: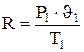 (4.3)
(4.3)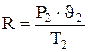 (4.4)
(4.4)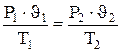 (4.5)
(4.5)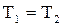 , то зависимость между начальными и конечными параметрами в изотермическом процессе следующая:
, то зависимость между начальными и конечными параметрами в изотермическом процессе следующая: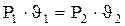 (4.6)
(4.6)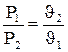 (4.7)
(4.7)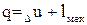 (4.8)
(4.8)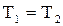 , то изменение внутренней энергии идеального газа равно
, то изменение внутренней энергии идеального газа равно 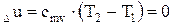 и вся теплота, подводимая к газу, расходуется на совершение работы газом:
и вся теплота, подводимая к газу, расходуется на совершение работы газом: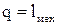 (4.9)
(4.9)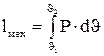 (4.10)
(4.10)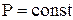 дает следующее выражение для работы:
дает следующее выражение для работы: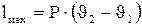 (4.11)
(4.11)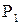 или
или 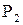 .
.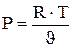 (4.12)
(4.12)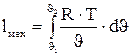 (4.13)
(4.13)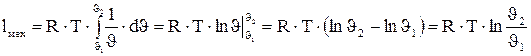 (4.14)
(4.14)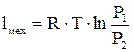 (4.16)
(4.16)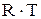 можно заменить на
можно заменить на 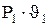 либо
либо 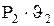 .
.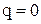 ).
).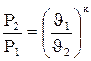 (4.17)
(4.17)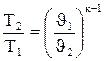 (4.18)
(4.18)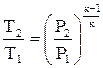 (4.19)
(4.19)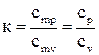 (4.20)
(4.20)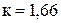
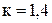
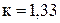
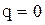 , то первый закон термодинамики для адиабатного процесса имеет следующий вид:
, то первый закон термодинамики для адиабатного процесса имеет следующий вид: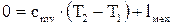 (4.22)
(4.22)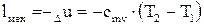 (4.23)
(4.23)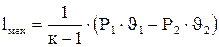 (4.24)
(4.24)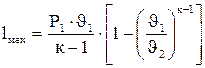 (4.25)
(4.25)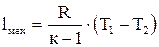 (4.26)
(4.26)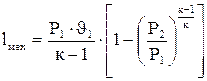 (4.27)
(4.27) ), подведенной к рабочему телу в цикле, превращается в механическую работу (
), подведенной к рабочему телу в цикле, превращается в механическую работу (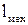 ) и, следовательно, чем меньше передается ее холодному источнику теплоты (окружающей среде), тем, очевидно выше КПД цикла.
) и, следовательно, чем меньше передается ее холодному источнику теплоты (окружающей среде), тем, очевидно выше КПД цикла.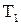 ) и холодного источника (
) и холодного источника (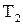 ).
).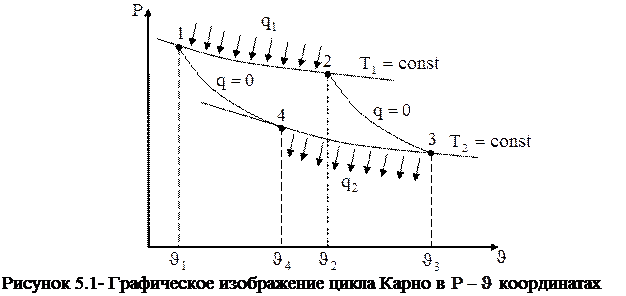
 (5.1)
(5.1) (5.2)
(5.2)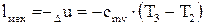 (5.3)
(5.3)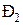 в резервуар, часть сжатого воздуха остается в цилиндре и в процессе 3-4 происходит его расширение в цилиндре.
в резервуар, часть сжатого воздуха остается в цилиндре и в процессе 3-4 происходит его расширение в цилиндре.
 от объема цилиндра.
от объема цилиндра. координатах. Идеализированный цикл в
координатах. Идеализированный цикл в 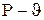 координатах строится для постоянной массы рабочего тела (для 1кг рабочего тела), а индикаторная диаграмма в
координатах строится для постоянной массы рабочего тела (для 1кг рабочего тела), а индикаторная диаграмма в  координатах изображает процессы, протекающие в цилиндре компрессора при изменяющейся массе газа в нем.
координатах изображает процессы, протекающие в цилиндре компрессора при изменяющейся массе газа в нем.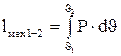 ,
, 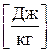 (8.1)
(8.1)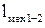 всегда отрицательная, поскольку
всегда отрицательная, поскольку  и, следовательно,
и, следовательно,  . На индикаторной диаграмме величина
. На индикаторной диаграмме величина 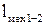 изображается площадью под кривой 1-2.
изображается площадью под кривой 1-2.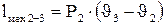 ,
,  (8.2)
(8.2)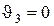 :
: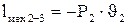 ,
,  (8.3)
(8.3)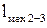 изображается площадью под кривой 2-3.
изображается площадью под кривой 2-3.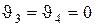 (8.4)
(8.4) ,
, 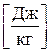 (8.5)
(8.5)


