
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Магний. Оксид и гидроксид магния. Применение солей магния в ветеринарии. Ион магния как биогенный элемент.Содержание книги
Поиск на нашем сайте
Ма́гний — элемент главной подгруппы второй группы, третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 12. Обозначается символом Mg. Простое вещество магний — лёгкий, ковкий металл серебристо-белого цвета. Окси́д ма́гния (жжёная магнезия, периклаз) — химическое соединение с формулой MgO, бесцветные кристаллы, нерастворимые в воде, пожаро- и взрывобезопасен.
Физические свойства
Легкий, рыхлый порошок белого цвета, легко впитывает воду.на этом свойстве основано его применение в спортивной гимнастике.нанесенный на ладони спортсмена порошок предохраняет его от опасности сорваться с гимнастического снаряда. Температура плавления — 2825 °C.температура кипения — 3600 °C.Плотность=3,58 г/см3.
Химические свойства Легко реагирует с разбавленными кислотами и водой с образованием солей и Mg(OH)2: MgO + 2HCl(разб.) → MgCl2 + H2O; MgO + H2O → Mg(OH)2.
Получение Получают обжигом минералов магнезита и доломита. 2Mg + O2 = 2MgO.
Гидрокси́д ма́гния — неорганический гидроксид щелочноземельного металла магния. Относится к классу нерастворимых оснований. При стандартных условиях гидроксид магния представляет собой бесцветные кристаллы с гексагональной решёткой. При температуре выше 350 °C разлагается на оксид магния и воду. Поглощает углекислый газ и воду из воздуха с образованием основного карбоната магния. Гидроксид магния практически нерастворим в воде. Является слабым основанием. Встречается в природе в виде минерала брусита.
Получение
· Взаимодействие растворимых солей магния с щелочами:
· Взаимодействие металлического магния с парами воды:
Химические свойства
· Разложение при нагревании до 350°C:
· Взаимодействие с кислотами с образованием соли и воды (реакция нейтрализации):
· Взаимодействие с кислотными оксидами с образованием соли и воды:
Вопрос№59. Хром. Общая характеристика. Амфотерность гидроксида. Токсичность соединений хрома. Биологическое значение хрома. Общая характеристика Хром относится к побочной подгруппе VI группы Периодической системы. В природе существует в виде смеси 4-х стабильных изотопов, из которых наиболее распространен 52Cr (мольная доля 83,76%). В земной коре массовая доля хрома 8,3 Внешний электронный уровень хрома имеет строение 3s23p63d54s1, характерные степени окисления – от +1 до +6, наиболее устойчивы +2,+3,+6. Соединения хрома (III) Степень окисления +3 для хрома самая устойчивая, в этой степени окисления соединения хрома имеют сходство с соединениями алюминия из-зa близости ионных радиусов: 0,064 нм для хрома +3 и 0,057 нм для алюминия +3. Для оксида и гидроксида хрома (III) характерна амфотерность, например, легко осаждаемый аммиаком из растворов солей хрома (III) гидроксид серо-зеленого цвета: CrCl3 + 3NH3 + 3H2O = Cr(OH)3 + 3NH4Cl Который растворяется как в избытке кислоты: Cr(OH)3 + HCl = CrCl3 + 3H2O Так и в избытке щелочи Cr(OH)3 + 3NaOH = Na3[Cr(OH)6]
|
||||
|
Последнее изменение этой страницы: 2020-10-24; просмотров: 126; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.227.105.110 (0.009 с.) |

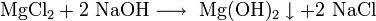
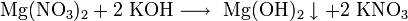
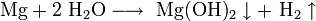
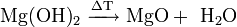
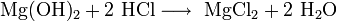
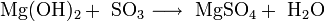
 10-3%, по распространенности хром на 22-м месте. В природе встресается только в виде соединений, наиболее распространенный минерал хрома - хромит FeO
10-3%, по распространенности хром на 22-м месте. В природе встресается только в виде соединений, наиболее распространенный минерал хрома - хромит FeO 


