
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Предмет и методы химии как науки. Химизация сельского хозяйства.Содержание книги
Поиск на нашем сайте
Вопрос№1. Предмет и методы химии как науки. Химизация сельского хозяйства. Химия изучает состав, свойства и превращения веществ, а также явления, которые сопровождают эти превращения. Одно из первых определений химии как науки дал великий русский ученый М.В. Ломоносов: «Химическая наука рассматривает свойства и изменения тел… состав тел… объясняет причину того, что с веществами при химических превращениях происходит». Свое оригинальное и точное определение химии дал другой великий русский химик Д.И. Менделеев в знаменитой книге «Основы химии». По Менделееву, химия – это учение об элементах и их соединениях. Химия относится к естественным наукам, которые изучают окружающий нас мир. Она тесно связана с другими естественными науками: физикой, биологией, геологией. Многие разделы современной науки возникли на стыке этих наук: физическая химия, геохимия, биохимия. Химия тесно связана также с другими отраслями науки и техники. В ней широко применяются математические методы, используются расчеты и моделирование процессов на элекронно-вычислительных машинах. В современной химии выделилось много самостоятельных разделов, наиболее важные из которых, кроме отмеченных выше, неорганическая химия, органическая химия, химия полимеров, аналитическая химия, электрохимия, коллоидная химия и другие. Объектом изучения химии являются вещества. Обычно их подразделяют на смеси и чистые вещества. Среди последних выделяют простые и сложные.
В химии выделяют следующие задачи: · Освоение океанических источников сырья · Проблема продовольственного питания · Создание новых средств борьбы с болезнями растений · Способы регулировки рождаемости · Технология получения пищи из сырья не сельскохозяйственного происхождения · Охрана окружающей среды · Биохимические процессы · Новые источники энергии · Создание новых веществ с заранее заданными свойствами · Теоретические исследования: o Механизм химических реакций o Действие катализаторов o Процесс роста кристаллов o Происхождение солнечной системы и вселенной
Роль химии в сельском хозяйстве. Исключительно большое значение химия имеет в сельском хозяйстве, которое использует минеральные удобрения, средства защиты растений от вредителей, регуляторы роста растений, химические добавки и консерванты к кормам для животных и другие продукты. Использование химических методов в сельском хозяйстве привело к возникновению ряда смежных наук, например, агрохимия и биотехнологии.
Вопрос№2. Закон сохранения массы вещества М.В. Ломоносова. Закон взаимосвязи массы и энергии А. Эйнштейна. Закон постоянства состава. Закон сохранения массы вещества впервые сформулировал М.В. Ломоносов. Позднее он экспериментально обосновал этот закон. Современная формулировка закона такова:
Состав соединений молекулярной структуры, являются постоянным независимо от способа получения. Состав же соединений с немолекулярной структурой не являются постоянным и зависит от условий получения.
Вопрос№3. Вопрос№4. Атом – это электронейтральная частица, состоящая из положительно заряженного атомного ядра и отрицательно заряженных электронов. Относительная атомная масса.
Относительной атомной массой A r химического элемента называется величина, равная отношению средней массы атома естественного изотопического состава элемента к 1/12 массы атома углерода 12С. Относительная атомная масса – одна из основных характеристик химического элемента.
Моль.
Моль – это количество вещества, содержащее столько структурных единиц (молекул, атомов, ионов и других), сколько атомов содержится в 0,012 кг изотопа углерода 12С. Молярная масса. Молярная масса – величина, равная отношению массы вещества к количеству вещества.
Вопрос№5. Вопрос№6. Вопрос№7. Принцип наименьшей энергии. В атоме каждый электрон располагается так, чтобы его энергия была наименьшей. Этот принцип справедлив только для основного состояния атомов. В возбужденном состоянии электроны могут находится на любых орбиталях атомов, если при этом не нарушается принцип Паули.
Принцип Паули. В атоме не может быть 2-ух электронов у которых все 4-е квантовых числа были бы одинаковыми. На каждой орбитали может быть не более 2-ух электронов. Причем они должны иметь противоположные спины.
Правило Хунда (Гунда). Заполнение орбиталей в основном состоянии атома начинается одиночными электронами с одинаковыми спинами, после того, как одиночные электроны займут все орбитали, происходит заполнение вторыми электронами с противоположными спинами.
Вопрос№8. Вопрос№9. Вопрос№10. Вопрос№11. Вопрос№12. Ковалентная связь. Два способа её образования. Свойства ковалентной связи. Направленность и насыщаемость связи. Сигма и Пи связи. Ковалентная связь, один из видов химической связи между двумя атомами, которая осуществляется общей для них электронной парой. Механизм образования ковалентной связи рассмотрим на примере образования молекулы водорода. Ядро свободного атома водорода окружено электронным облаком, образованным 1s-электроном. При взаимодействии атомов происходит частичное перекрывание их электронных облаков (орбиталей). В результате возникает общее электронное облако. Образование химической связи происходит за счет неспаренных электронов каждого атома. Неспаренные электроны связываются в общую пару электронов, которую называют неподеленной парой.
Вопрос№13. Вопрос№14. Вопрос№15. Вопрос№16. Ионная связь. Её образование и свойства. Структура ионных соединений. Вопрос№17. Вопрос№18. Вопрос№19. Вопрос№20. Вопрос№21. Вопрос№22. Вопрос№23. Вопрос№24. Окислительно-восстановительные реакции. Окислители и восстановители, их положение в ПС элементов. Классификация окислительно-восстановительных реакций. Окислительно-восстановительные процессы в живом организме. Вопрос№25. Вопрос№26. Вопрос№27. Константа равновесия. Важнейший параметр, характеризующий обратимую химическую реакцию – константа равновесия К. Если записать для рассмотренной обратимой реакции A + D C + D условие равенства скоростей прямой и обратной реакции в состоянии равновесия – k1[A]равн[B]равн = k2[C]равн[D]равн, откуда [C]равн[D]равн/[A]равн[B]равн = k1/k2 = К, то величина К называется константой равновесия химической реакции.
Итак, при равновесии отношение концентрации продуктов реакции к произведению концентрации реагентов постоянно, если постоянна температура (константы скорости k1 и k2 и, следовательно, константа равновесия К зависят от температуры, но не зависят от концентрации реагентов). Если в реакции участвуют несколько молекул исходных веществ и образуется несколько молекул продукта (или продуктов), концентрации веществ в выражении для константы равновесия возводятся в степени, соответствующие их стехиометрическим коэффициентам. Так для реакции 3H2 + N2 2NH3 выражение для константы равновесия записывается в виде K = [NH3]2 равн/[H2]3равн[N2]равн. Описанный способ вывода константы равновесия, основанный на скоростях прямой и обратной реакций, в общем случае использовать нельзя, так как для сложных реакций зависимость скорости от концентрации обычно не выражается простым уравнением или вообще неизвестна. Тем не менее, в термодинамике доказывается, что конечная формула для константы равновесия оказывается верной.
Для газообразных соединений вместо концентраций при записи константы равновесия можно использовать давление; очевидно, численное значение константы при этом может измениться, если число газообразных молекул в правой и левой частях уравнения не одинаковы. Пинцип Ле Шателье. Вопрос№28. Вопрос№29. Вопрос№30. Вопрос№31. Вопрос№32. Вопрос№33. Вопрос№34. Вопрос №35. Вопрос№36. Вопрос№37. Произведение растворимости. Произведение растворимости, произведение концентраций ионов в насыщенном растворе малорастворимого сильного электролита. Показатели степени для концентраций, входящих в П. р., равны коэффициенту при соответствующем ионе в уравнении диссоциации электролита.
Вопрос№38. Вопрос№39. Вопрос№40. Вопрос№41. Вопрос№42. Вопрос№43. Вопрос№44. Вопрос№45. Вопрос№46. Вопрос№47. Вопрос№48. Аммиак, его свойства, способы получения. Применение аммиака в народном хозяйстве. Гидроокись аммония. Соли аммония, их свойства и применение. Азотные удобрения с аммонийной формой азота. Качественная реакция на ион аммония. Аммиак – бесцветный газ с характерным запахом, почти в два раза легче воздуха. При увеличении давления или охлаждении он легко сжижается в бесцветную жидкость. Аммиак очень хорошо растворяется в воде. Раствор аммиака в воде называется аммиачной водой или нашатырным спиртом. При кипячении растворенный аммиак улетучивается из раствора. Химические свойства. 1. Взаимодействие с кислотами: NH3 + HCl = NH4Cl, NH3 + H3PO4 = NH4H2PO4 2. Взаимодействие с кислородом: 4NH3 + 3O2 = 2N2 + 6H2O 3. Восстановление меди: 3CuO + 2NH3 = 3Cu + N2 + 3H2O Получение. 1. 2NH4Cl + Ca(OH)2 = CaCl2 + 2NH3 + 2H2O 2. N2 + 3H2 = 2NH3 Применение. Жидкий аммиак и его водные растворы применяют как жидкое удобрение. Гидроокись аммония (гидроксид аммония) – NH4OH Соли аммония и их свойства. Соли аммония состоят из катиона аммония и аниона кислоты. По строению они аналогичны соответствующим солям однозарядных ионов металлов. Соли аммония получаются при взаимодействии аммиака или его водных растворов с кислотами. Например: NH3 + HNO3 = NH4NO3 Они проявляют общие свойства солей, т.е. взаимодействуют с растворами щелочей, кислот и других солей: NH4Cl + NaOH = NaCl + H2O + NH3 2NH4Cl + H2SO4 = (NH4)2SO4 + 2HCl (NH4)2SO4 + BaCl2 = BaSO4 + 2NH4Cl Применение. Нитрат аммония (аммиачная селитра) NH4NO3 применяют как азотное удобрение и для изготовления взрывчатых веществ — аммонитов; Сульфат аммония (NH4)2SO4 — как дешёвое азотное удобрение; Гидрокарбонат аммония NH4HCO3 и карбонат аммония (NH4)2CO3 — в пищевой промышленности при производстве мучных кондитерских изделий в качестве химического разрыхлителя, при крашении тканей, в производстве витаминов, в медицине; Хлорид аммония (нашатырь) NH4Cl — в гальванических элементах (сухих батареях), при пайке и лужении, в текстильной промышленности, как удобрение, в ветеринарии. Аммонийные (аммиачные) удобрения содержат азот в виде иона аммония и оказывают на почву подкисляющее воздействие, что приводит к ухудшению ее свойств и к меньшей эффективности удобрений, особенно при регулярном внесении на неизвесткованных малоплодородных почвах. Но у этих удобрений есть и свои преимущества: аммоний в значительно меньшей степени подвержен вымыванию, так как закрепляется почвенными частицами и поглощается микроорганизмами, и, кроме того, в почве с ним происходит процесс нитрофикации, т.е. превращение с помощью микроорганизмов в нитраты. Из аммонийных удобрений наименее пригодной для овощных культур хлористый аммоний как содержащий довольно много хлора. Качественная реакция на ион аммония. Очень важным свойством солей аммония является их взаимодействие с растворами щелочей. Этой реакций обнаруживают соли аммония (ион аммония) по запаху выделяющегося аммиака или по появлению синего окрашивания влажной красной лакмусовой бумажки:
NH4+ + OH- = NH3 + H2O
Вопрос№49. Вопрос№50. Вопрос№51. Вопрос№52. Вопрос№53. Вопрос№54. Вопрос№55. Вопрос№56. Вопрос №57. Подгруппа меди: характеристика. Распространение меди в природе, ее свойства, применение. Оксиды и гидроксиды меди. Соли двухвалентной меди. Комплексные соединения меди. Медь как микроэлемент. Медьсодержащие пестициды. Применение соединений меди в животноводстве. Серебро. Антисептические свойства соединений серебра. Распространение в природе. Среднее содержание М. в земной коре (кларк) 4,7·10-3 % (по массе), в нижней части земной коры, сложенной основными породами, её больше (1·10-2 %), чем в верхней (2·10-3 %), где преобладают граниты и другие кислые изверженные породы. М. энергично мигрирует как в горячих водах глубин, так и в холодных растворах биосферы; сероводород осаждает из природных вод различные сульфиды М., имеющие большое промышленное значение. Среди многочисленных минералов М. преобладают сульфиды, фосфаты, сульфаты, хлориды, известны также самородная М., карбонаты и окислы. М. — важный элемент жизни, она участвует во многих физиологических процессах. Среднее содержание М. в живом веществе 2·10-4 %, известны организмы — концентраторы М. В таёжных и других ландшафтах влажного климата М. сравнительно легко выщелачивается из кислых почв, здесь местами наблюдается дефицит М. и связанные с ним болезни растений и животных (особенно на песках и торфяниках). В степях и пустынях (с характерными для них слабощелочными растворами) М. малоподвижна; на участках месторождений М. наблюдается её избыток в почвах и растениях, отчего болеют домашние животные. В речной воде очень мало М., 1·10-7 %. Приносимая в океан со стоком М. сравнительно быстро переходит в морские илы. Поэтому глины и сланцы несколько обогащены М. (5,7·10-3 %), а морская вода резко недосыщена М. (3·10-7 %). В морях прошлых геологических эпох местами происходило значительное накопление М. в илах, приведшее к образованию месторождений (например, Мансфельд в ГДР). М. энергично мигрирует и в подземных водах биосферы, с этими процессами связано накопление руд М. в песчаниках. Химические свойства Химическая активность небольшая, убывает с увеличением атомного номера. Медь и её соединения Получение 1. Пирометаллургия CuO + C = Cu + CO CuO + CO = Cu + CO2 2. Гидрометаллургия CuO + H2SO4 = CuSO4 + H2O CuSO4 + Fe = FeSO4 + Cu электролиз: 2CuSO4 + 2H2O = 2Cu + O2 + 2H2SO4 Химические свойства Взаимодействует с неметаллами при высоких температурах: 2Cu + O2 = 2CuO Cu + Ci2 = CuCl2 Медь стоит в ряду напряжений правее водорода, поэтому не реагирует с разбавленными соляной и серной кислотами, но растворяется в кислотах – окислителях: 3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO + 2H2O Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2 + 2H2O Cu + 2H2SO4(конц.) = CuSO4 + SO2 +2H2O Применение. Большая роль М. в технике обусловлена рядом её ценных свойств и прежде всего высокой электропроводностью, пластичностью, теплопроводностью. Благодаря этим свойствам М. — основной материал для проводов; свыше 50 % добываемой М. применяют в электротехнической промышленности. Все примеси понижают электропроводность М., а потому в электротехнике используют металл высших сортов, содержащий не менее 99,9 % Cu. Высокие теплопроводность и сопротивление коррозии позволяют изготовлять из М. ответственные детали теплообменников, холодильников, вакуумных аппаратов и т. п. Около 30—40 % М. используют в виде различных сплавов, среди которых наибольшее значение имеют латуни (от 0 до 50 % Zn) и различные виды бронз; оловянистые, алюминиевые, свинцовистые, бериллиевые и т. д. (подробнее см. Медные сплавы). Кроме нужд тяжёлой промышленности, связи, транспорта, некоторое количество М. (главным образом в виде солей) потребляется для приготовления минеральных пигментов, борьбы с вредителями и болезнями растений, в качестве микроудобрений, катализаторов окислительных процессов, а также в кожевенной и меховой промышленности и при производстве искусственного шёлка. Соединения одновалентной меди Встречаются либо в нерастворимых соединениях (Cu2O, Cu2S, CuCl), либо в виде растворимых комплексов (координационное число меди – 2): CuCl + 2NH3 = [Cu(NH3)2]Cl Оксид меди (I) - красного цвета, получают восстановлением соединений меди (II), например, глюкозой в щелочной среде: 2CuSO4 + C6H12O6 + 5NaOH = Cu2O + 2Na2SO4 + C6H11O7Na + 3H2O
Соединения двухвалентной меди Оксид меди (II) - чёрного цвета. Восстанавливается под действием сильных восстановителей (например, CO) до меди. Обладает основным характером, при нагревании растворяется в кислотах: CuO + H2SO4 = CuSO4 + H2O CuO + 2HNO3 = Cu(NO3)2 + H2O Гидроксид меди (II) Cu(OH)2 - нерастворимое в воде вещество светло-голубого цвета. Образуется при действии щелочей на соли меди (II): CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4 При нагревании чернеет, разлагаясь до оксида: Cu(OH)2 = CuO + H2O Типичное основание. Растворяется в кислотах. Cu(OH)2 + 2HCl = CuCl2 + 2H2O Cu(OH)2 + 2H+ = Cu2+ + 2H2O Растворяется в растворе аммиака с образованием комплексного соединения (координационное число меди – 4) василькового цвета (реактив Швейцера, растворяет целлюлозу): Cu(OH)2 + 4NH3 = [Cu(HN3)4](OH)2
Малахит Cu2(OH)2CO3. Искусственно можно получить по реакции: 2CuSO4 + 2Na2CO3 + H2O = Cu2(OH)2CO3 + 2Na2SO4 + CO2 Разложение малахита: Cu2(OH)2CO3 = 2CuO + CO2 + H2O Медь как микроэлемент. Медь присутствует во всех организмах и принадлежит к числу микроэлементов, необходимых для их нормального развития. В растениях и животных содержание меди варьируется от 10–15 до 10–3%. Мышечная ткань человека содержит 1·10–3% меди, костная ткань — (1-26)·10–4 %, в крови присутствует 1,01 мг/л меди. Всего в организме среднего человека (масса тела 70 кг) содержится 72 мг меди. Основная роль меди в тканях растений и животных - участие в ферментативном катализе. Медь служит активатором ряда реакций и входит в состав медьсодержащих ферментов, прежде всего оксидаз, катализирующих реакции биологического окисления. Медьсодержащий белок пластоцианин участвует в процессе фотосинтеза. Другой медьсодержащий белок, гемоцианин, выполняет роль гемоглобина у некоторых беспозвоночных. Так как медь токсична, в животном организме она находится в связанном состоянии. Значительная ее часть входит в состав образующегося в печени белка церулоплазмина, циркулирующего с током крови и деставляющего медь к местам синтеза других медьсодержащих белков. Церулоплазмин обладает также каталитической активностью и участвует в реакциях окисления. Медь необходима для осуществления различных функций организма — дыхания, кроветворения (стимулирует усвоение железа и синтез гемоглобина), обмена углеводов и минеральных веществ. Недостаток меди вызывает болезни как растений, так и животных и человека. С пищей человек ежедневно получает 0,5-6 мг меди. Сульфат меди и другие соединения меди используют в сельском хозяйстве в качестве микроудобрений и для борьбы с различными вредителями растений. Однако при использовании соединений меди, при работах с ними нужно учитывать, что они ядовиты. Попадание солей меди в организм приводит к различным заболеваниям человека. ПДК для аэрозолей меди составляет 1 мг/м3, для питьевой воды содержание меди должно быть не выше 1,0 мг/л.
Вопрос№58. Физические свойства
Легкий, рыхлый порошок белого цвета, легко впитывает воду.на этом свойстве основано его применение в спортивной гимнастике.нанесенный на ладони спортсмена порошок предохраняет его от опасности сорваться с гимнастического снаряда. Температура плавления — 2825 °C.температура кипения — 3600 °C.Плотность=3,58 г/см3.
Химические свойства Легко реагирует с разбавленными кислотами и водой с образованием солей и Mg(OH)2: MgO + 2HCl(разб.) → MgCl2 + H2O; MgO + H2O → Mg(OH)2.
Получение Получают обжигом минералов магнезита и доломита. 2Mg + O2 = 2MgO.
Гидрокси́д ма́гния — неорганический гидроксид щелочноземельного металла магния. Относится к классу нерастворимых оснований. При стандартных условиях гидроксид магния представляет собой бесцветные кристаллы с гексагональной решёткой. При температуре выше 350 °C разлагается на оксид магния и воду. Поглощает углекислый газ и воду из воздуха с образованием основного карбоната магния. Гидроксид магния практически нерастворим в воде. Является слабым основанием. Встречается в природе в виде минерала брусита.
Получение
· Взаимодействие растворимых солей магния с щелочами:
· Взаимодействие металлического магния с парами воды:
Химические свойства
· Разложение при нагревании до 350°C:
· Взаимодействие с кислотами с образованием соли и воды (реакция нейтрализации):
· Взаимодействие с кислотными оксидами с образованием соли и воды:
Вопрос№59. Общая характеристика Хром относится к побочной подгруппе VI группы Периодической системы. В природе существует в виде смеси 4-х стабильных изотопов, из которых наиболее распространен 52Cr (мольная доля 83,76%). В земной коре массовая доля хрома 8,3 Внешний электронный уровень хрома имеет строение 3s23p63d54s1, характерные степени окисления – от +1 до +6, наиболее устойчивы +2,+3,+6. Соединения хрома (III) Степень окисления +3 для хрома самая устойчивая, в этой степени окисления соединения хрома имеют сходство с соединениями алюминия из-зa близости ионных радиусов: 0,064 нм для хрома +3 и 0,057 нм для алюминия +3. Для оксида и гидроксида хрома (III) характерна амфотерность, например, легко осаждаемый аммиаком из растворов солей хрома (III) гидроксид серо-зеленого цвета: CrCl3 + 3NH3 + 3H2O = Cr(OH)3 + 3NH4Cl Который растворяется как в избытке кислоты: Cr(OH)3 + HCl = CrCl3 + 3H2O Так и в избытке щелочи Cr(OH)3 + 3NaOH = Na3[Cr(OH)6] Вопрос№60. Общий обзор Марганец - элемент VIIB подгруппы IV-го периода. Электронное строение атома 1s22s22p63s23p63d54s2, наиболее характерные степени окисления в соединениях - от +2 до +7. Марганец принадлежит к довольно распространенным элементам, составляя 0,1 % (массовая доля) земной коры. В природе встречается тoлько в виде соединений, основные минералы - пиролюзит (диоксид марганца MnO2.), гаусканит Mn3O4 и браунит Mn2O3. Оксиды магранца Марганец образует четыре простых оксида - MnO, Mn2O3, MnO2 и Mn2O7 и смешанный оксид Mn3O4. Первые два оксида обладают основными свойствами, диоксид марганца MnO2 амфотерен, а высший оксид Mn2O7 является ангидридом марганцовой кислоты HMnO4. Известны также производные марганца (IV), но соответствующий оксид MnO3 не получен. Соединения марганца (II) Степени окисления +2 соответствуют оксид марганца (II) MnO, гидроксид марганца Mn(OH) 2 и соли марганца (II). Оксид марганца(II) получается в виде зеленого порошка при восстановлении других оксидов марганца водородом: MnO2 + H2 = MnO + H2O или при термическом разложении оксалата или карбоната марганца без доступа воздуха: MnC2O4 = MnO + CO + CO2 MnCO3 = MnO + CO2 При действии щелочей на растворы солей марганца (II) выпадает белый осадок гидроксидa марганца Mn(OH)2: MnCl2 + NaOH = Mn(OH)2 + 2NaCl На воздухе он быстро темнеет, окисляясь в бурый гидроксид марганца(IV) Mn(OH)4: 2Mn(OH)2 + O2 + 2H2O =2 Mn(OH)4 Оксид и гидроксид марганца (II) проявляют основные свойства, легко растворяются в кислотах: Mn(OH)2 + 2HCl = MnCl2 + 2H2O Соли при марганца (II) образуются при растворении марганца в разбавленных кислотах: Mn + H2SO4 = MnSO4 + H2 - при нагревании или при действии кислот на различные природные соединения марганца, например: MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O В твердом виде соли марганца (II) розового цвета, растворы этих солей почти бесцветны. При взаимодействии с окислителями все соединения марганца (II) проявляют восстановительные свойства. Соединения марганца (IV) Самым устойчивым соединением марганца (IV) является темно-бурый диоксид марганца MnO2. Он легко образуется как при окислении низших, так и при восстановлении высших соединений марганца. MnO2 — амфотерный оксид, но и кислотные, и основные свойства выражены у него очень слабо. В кислой среде диоксид марганца –сильный окислитель. При нагревании сконцентрированными кислотами идут реакции: 2MnO2 + 2H2SO4 = 2MnSO4 + O2 + 2H2O MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O причем на первой стадии во второй реакции сначала образуется неустойчивый хлорид марганца (IV), который затем распадается: MnCl4 = MnCl2 + Cl2 При сплавлении MnO2 со щелочами или основными оксидами получают манганиты, например: MnO2 +2KOH = K2MnO3 + H2O При взаимодействии MnO2 с концентрированной серной кислотой образуется сульфат марганца MnSO4 и выделяется кислород: 2Mn(OH)4 + 2H2SO4 = 2MnSO4 + O2 + 6H2O Взаимодействие MnO2 с более сильными окислителями приводит к образованию соединений марганца (VI) и (VII), например при сплавлении с хлоратом калия образуется манганат калия: 3MnO2 + KClO3 + 6KOH = 3K2MnO4 + KCl + 3H2O а при действии диоксида полония в присутствии азотной кислоты – марганцевая кислота: 2MnO2 + 3PoO2 + 6HNO3 = 2HMnO4 + 3Po(NO3)2 + 2H2O
Перманганат калия KMnO4. Наиболее известная соль марганцовой кислоты. Представляет собой темно-фиолетовые кристаллы, умеренно растворимые в воде.Как и все соединения марганца (VII), перманганат калия — сильный окислитель. Он легко окисляет многие органические вещества, превращает соли железа(II) в соли железа (III), сернистую кислоту окисляет в серную, из соляной кислоты выделяет хлор и т. д. В окислительно-восстановительных реакциях KMnO4 (ион MnO4-)может восстанавливаться в различной степени. В зависимости от рН среды продукт восстановления может представлять собою ион Mn2+ (в кислой среде), MnO2 (в нейтральной или в слабо щелочной среде) или ион MnO42- (в сильно щелочной среде), например: KMnO4 + KNO2 + KOH = K2MnO4 + KNO3 + H2O - в сильнощелочной среде 2KMnO4 + 3KNO2 + H2O = 2MnO2 + 3KNO3 + 2KOH – в нейтральной или слабощелочной 2KMnO4 + 5KNO2 + 3H2SO4 = 2MnSO4 + K2SO4 + 5KNO3 + 3H2O – в кислой среде При нагревании в сухом виде перманганат калия уже при температуре около 200oС разлагается согласно уравнению: 2KMnO4 = K2MnO4 + MnO2 + O2 Соответствующая перманганатам свободная марганцовая кислота HMnO4 в безводном состоянии не получена и известна только в растворе. Концентрацию ее раствора можно довести до 20%. HMnO4 - очень сильная кислота, в водном растворе полностью диссоциированная на ионы. Оксид марганца (VII), или марганцовый ангидрид, Mn2O7 может быть получен действием концентрированной серной кислоты на перманганат калия: 2KMnO4 + H2SO4 = Mn2O7 + K2SO4 + H2O Марганцовый ангидрид — зеленовато-бурая маслянистая жидкость. Очень неустойчив: при нагревании или при соприкосновении с горючими веществами он со взрывом разлагается на диоксид марганца и кислород. Как энергичный окислитель перманганат калия широко применяют в химических лабораториях и производствах, он служит также дезинфицирующим средством, Реакцией термического разложения перманганата калия пользуются в лаборатории для получения кислорода. Значение в организме
Вопрос№61. Химические свойства Чистое металлическое железо устойчиво в воде и в разбавленных растворах щелочей. Железо не растворяется в холодных концентрированных серной и азотной кислотах из-за пассивации поверхности металла прочной оксидной плёнкой. Горячая концентрированная серная кислота, являясь более сильным окислителем, взаимодействует с железом. С соляной и разбавленной (приблизительно 20%-й) серной кислотами железо реагирует с образованием солей железа(II): Fe + 2HCl → FeCl2 + H2↑; Fe + H2SO4 → FeSO4 + H2↑. При взаимодействии железа с приблизительно 70%-й серной кислотой реакция протекает с образованием сульфата железа(III): 2Fe + 6H2SO4 → Fe2(SO4)3 + 3SO2↑ + 6H2O. Оксид железа(II) FeO обладает основными свойствами, ему отвечает основание Fe(OH)2. Оксид железа(III) Fe2O3 слабо амфотерен, ему отвечает ещё более слабое, чем Fe(OH)2, основание Fe(OH)3, которое реагирует с кислотами: 2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O. Гидроксид железа(III) Fe(OH)3 проявляет слабо амфотерные свойства, он способен реагировать только с концентрированными растворами щелочей: Fe(OH)3 + 3КОН → K3[Fe(OH)6]. Образующиеся при этом гидроксокомплексы железа(III) устойчивы в сильно щелочных растворах. При разбавлении растворов водой они разрушаются, причём в осадок выпадает Fe(OH)3. Соединения железа(III) в растворах восстанавливаются металлическим железом: Fe + 2FeCl3 → 3FeCl2. При хранении водных растворов солей железа(II) наблюдается окисление железа(II) до железа(III): 4FeCl2 + O2 + 2H2O → 4Fe(OH)Cl2. Из солей железа(II) в водных растворах устойчива соль Мора — двойной сульфат аммония и железа(II) (NH4)2Fe(SO4)2·6Н2O. Железо(III) способно образовывать двойные сульфаты с однозарядными катионами типа квасцов, например, KFe(SO4)2 — железокалиевые квасцы, (NH4)Fe(SO4)2 — железоаммонийные квасцы и т. д. При действии газообразного хлора или озона на щелочные растворы соединений железа(III) образуются соединения железа(VI) — ферраты, например, феррат(VI) калия K2FeO4. Имеются сообщения о получении под действием сильных окислителей соединений железа(VIII). Для обнаружения в растворе соединений железа(III) используют качественную реакцию ионов Fe3+ с тиоцианат-ионами SCN−. При взаимодействии ионов Fe3+ с анионами SCN− образуется ярко-красный роданид железа Fe(SCN)3. Другим реактивом на ионы Fe3+ служит гексацианоферрат(II) калия K4[Fe(CN)6] (жёлтая кровяная соль). При взаимодействии ионов Fe3+ и [Fe(CN)6]4− выпадает ярко-синий осадок берлинской лазури: 4K4[Fe(CN)6] + 4Fe3+ → 4KFeIII[FeII(CN)6]↓ + 12K+. Реактивом на ионы Fe2+ в растворе может служить гексацианоферрат(III) калия K3[Fe(CN)6] (красная кровяная соль). При взаимодействии ионов Fe2+ и [Fe(CN)6]3− выпадает осадок турнбулевой сини: 3K3[Fe(CN)6] + 3Fe2+ → 3KFeII[FeIII(CN)6]↓ + 6K+. Интересно, что берлинская лазурь и турнбулева синь — две формы одного и того же вещества, так как в растворе устанавливается равновесие: KFeIII[FeII(CN)6] ↔ KFeII[FeIII(CN)6]. Ко́бальт — элемент побочной подгруппы восьмой группы четвёртого периода периодической системы химических элементов Д. И. Менделеева, атомный номер 27. Обозначается символом Co. Простое вещество кобальт — серебристо-белый, слегка желтоватый металл с розоватым или синеватым отливом. Химические свойства Оксиды · На воздухе кобальт окисляется при температуре выше 300 °C. · Устойчивый при комнатной температуре оксид кобальта представляет собой сложный оксид Co3O4, имеющий структуру шпинели, в кристаллической структуре которого одна часть узлов занята ионами Co2+, а другая — ионами Co3+; разлагается с образованием CoO выше 900 °C. · При высоких температурах можно получить α-форму или β-форму оксида CoO. · Все оксиды кобальта восстанавливаются водородом. Со3О4 + 4Н2 → 3Со + 4Н2О. · Оксид кобальт
|
||||
|
Последнее изменение этой страницы: 2020-10-24; просмотров: 109; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.14.26.141 (0.012 с.) |

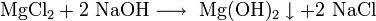
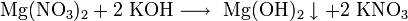
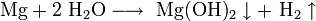
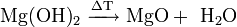
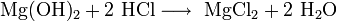
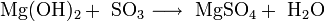
 10-3%, по распространенности хром на 22-м месте. В природе встресается только в виде соединений, наиболее распространенный минерал хрома - хромит FeO
10-3%, по распространенности хром на 22-м месте. В природе встресается только в виде соединений, наиболее распространенный минерал хрома - хромит FeO 


