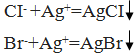Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
ГЛАВА 2. Организация и методы исследования
Организация исследования Исследование проводилось на базе ГУП «Башфармация» аптеки №325-СП ЦРА №322 г. Стерлитамак и в учебной химической лаборатории на базе ГАПОУ РБ «Стерлитамакский медицинский колледж» с ноября 2016 года по май 2017 года. Исследование проводилось в 3 этапа. На первом этапе изучили литературные источники по данной теме. На втором этапе определили методы качественного и количественного анализа, провели исследования в аптеке и химической лаборатории. На третьем этапе обобщили полученные результаты, подвели итоги и сформулировали выводы.
Методы исследования 2.2.1. Теоретические методы: обзор и анализ литературы Анализ литературных источников является одним из основных методов исследования. Он заключается в критическом и объективном рассмотрении различных точек зрения на проблему, выявлении степени их доказательности, рациональности идей, способствующих решению проблемы. К анализу литературных источников обращаются на подготовительном этапе исследования. На этой стадии происходит первичное ознакомление с литературой, с новейшими сведениями, имеющимися в науке и смежными с ней областями. На втором этапе работа с литературой становится более глубокой, она необходима для уточнения, подтверждения, обоснования полученных результатов. В результате анализа выделяются: 1) источники, выполняющие методологическую функцию. Они будут составлять основу исследования; идеи, представленные в них, будут определять сущность и логику исследования; 2) отдельно определяется литература, которая может служить для подтверждения некоторых выдвигаемых в исследовании положений; 3) среди литературы отмечают и такую, в которой содержится интересный материал по методике исследования. 2.2.2 Практические методы: наблюдение, измерение, опыт Наблюдение – целенаправленное восприятие химических объектов (веществ и их свойств) с целью их изучения. Измерение – это процесс, заключающийся в определении количественных значений тех или иных свойств, сторон изучаемого объекта, явления с помощью специальных технических устройств. Опыт – это компонент познавательной деятельности, посредством которого обеспечивается непосредственная связь системы знания с познаваемым объектом.
К методикам контроля качества относятся: для определения подлинности проведение качественных реакций, сопровождающихся характерным аналитическим сигналом, определение рН раствора методом прямой потенциометрии; количественное определение с помощью методов окислительно – восстановительного и осадительного титрования. Качественные реакции - этореакции, позволяющие доказать наличие того или иного вещества (иона) в среде или присутствие функциональной группы в веществе. Анализируемые вещества могут находиться в различных агрегатных состояниях (твёрдом, жидком и газообразном). Окрашивание пламени – основано на термическом разложении солей при внесении их в пламя горелки: при высокой температуре образующиеся ионы восстанавливаются в атомы металлов, пары которых и окрашивают пламя. Соли натрия окрашивают пламя в желтый цвет, калия – в розово – фиолетовый. Данный метод дает хорошие результаты с летучими солямя (хлоридами, карбонатами и нитратами). Нелетучие соли также могут быть исследованы этим методом, но при предварительной обработке концентрированной соляной кислотой для перевода их в летучие хлориды. Для проведения испытания платиновую или нихромовую проволоку, предварительно нагревают в пламени горелки. Затем на проволоку помещают анализируемое вещество, которое вносят в пламя горелки и следят за появлением окраски пламени. Прямая потенциометрия - основана на измерении потенциала индикаторного электрода и расчете концентрации определяемых ионов по уравнению Нернста. Используемый в потенциометрическом определении гальванический элемент включает два электрода, которые погружают в один раствор (гальванический элемент без переноса) или в два различных по составу раствора, соединенных жидкостным контактом (цепь с переносом). Окислительно – восстановительное тритрование (редоксиметрия) – восстановления основаны на окислительно – восстановительных реакциях, происходящих между стандартным раствором и определяемым веществом. Для количественного анализа могут быть использованы окислительно – восстановительные реакции, которые протекают количественно до конца, с достаточной скоростью и обладают постоянным соотношением между вступающими в реакцию окислителем и восстановителем.
Осадительное титрование – метод объединяет титриметрические определения, основанные на реакциях образования осадков малорастворимых соединений. Метод, использующий раствор нитрата серебра, называют аргентометрией. Этим методом определяют содержание ионов CI- и Br- в нейтральных или слабощелочных средах. Он основан на акции осаждения ионов CI- и Br- катионами серебра с образованием малорастворимых галогенидов:
Метод Мора. Сущность данного метода состоит в прямом титровании жидкости раствором нитрата серебра с индикатором хроматом калия до побурения белого осадка. Всегда к анализируемой жидкости приливают раствор нитрата серебра, а не наоборот. Аргентометрию используют только при титровании нейтральных или слабощелочных растворов (pH от 7 до 10). Она удобна при анализе бесцветных растворов, содержащих CI- и Br- ионы. В качестве примера исследования неорганических ЛС элементов VII группы ПС Д.И.Менделеева были использованы: раствор йода спиртовой 5%, порошки калия йодида и натрия бромида, раствор натрия хлорида изотонический 0,9% для инъекций. 2.2.2.1. Качественный и количественный методы анализа раствора йода спиртового Для проведения качественного и количественного анализа неорганических ЛС элементов VII группы ПС Д.И.Менделеева были выбраны следующие ЛП: раствор йода спиртовой 5%, калия йодид, натрия бромид, раствор натрия хлорида изотонический 0,9% для инъекций. Solution Iodi spirituosa 5% Раствор йода спиртовой 5% Tinctura Iodi 5% Настойка йодная 5% Состав.Йода………………………………………………...50г Калия йодида……………………………………....20г Воды и спирта 95% поровну……………………..до 1л Описание. Прозрачная жидкость красно – бурого цвета с характерным запахом. Подлинность. 1 каплю препарата разводят 10мл воды и прибавляют 1мл раствора крахмала; появляется сине – голубое окрашивание. Количественное определение. 2мл препарата помещают в коническую колбу емкостью 200 мл с притертой пробкой и титруют 0,1н раствором тиосульфата натрия до обесцвечивания (без индикатора). 1мл 0,1н раствора тиосульфата натрия соответствует 0,01269г I, которого в препарате должно быть 4,9 – 5,2%. К полученному раствору прибавляют 25 мл воды, 2 мл разведенной уксусной кислоты, 5 капель эозината натрия и титруют 0,1н раствором нитрата серебра до перехода окраски осадка от желтой к розовой. Разность между количеством мл нитрата серебра и количеством мл тиосульфата натрия рассчитывают на йодид калия. 1мл 0,1н раствора нитрата серебра соответствует 0,01660г KI, которого в препарате должно быть 1,9 – 2,1%. 2.2.2.2. Качественный и количественный методы анализа порошка калия йодида Kalii iodidum Калия йодид Kalium iodatum KI М.в.166, 01 Описание. Белый кристаллический порошок без запаха, солено – горького вкуса. Во влажном воздухе сыреет. Подлинность. Реакции на калий. А. К 2мл раствора соли калия (0,005-0,01г иона калия), предварительно прокаленной для удаления солей аммония, прибавляют 0,5мл уксусной кислоты и 0,5мл раствора кобальтинитрита натрия; образуется желтый кристаллический осадок.
Б. Соль калия, внесенная в бесцветное пламя, окрашивает его в фиолетовый цвет или при рассматривании через синее стекло - пурпурно – красный. Реакции на йодиды. К 2мл раствора йодида (0,002-0,01г иона йодида) прибавляют 0,5 мл азотной кислоты и 0,5 мл раствора нитрата серебра; образуется желтый творожистый осадок, нерастворимый в растворе аммиака. Количественное определение. Около 0,3г препарата (точная навеска), предварительно высушенного при 110о в течение 4 часов, растворяют в 30мл воды, прибавляют 1,5мл разведенной уксусной кислоты, 5 капель 0,1% раствора эозината натрия и титруют 0,1н раствором нитрата серебра до перехода окраски осадка от желтой до розовой. 1мл 0,1н раствора нитрата серебра соответствует 0,01660г KI, которого в высушенном препарате должно быть не менее 99,5%[4]. 2.2.2.3. Качественный и количественный методы анализа порошка натрия бромида Natrii bromidum Натрия бромид Natrium bromatum NaBr М.в.102, 90 Описание. Белый кристаллический порошок без запаха, соленого вкуса. Гигроскопичен. Подлинность. Характерные реакции на натрий. Соль натрия, внесенная в бесцветное пламя, окрашивает его в желтый цвет. Количественное определение. Около 0,2г препарата (точная навеска), предварительно высушенного при 110о в течение 4 часов, растворяют в 20мл воды и титруют 0,1н раствором нитрата серебра до оранжево – желтого окрашивания (индикатор – хромат калия). 1мл 0,1н раствора нитрата серебра соответствует 0,01029г NaBr, которого в высушенном препарате должно быть не менее 99,0% и не более 100,6%. 2.2.2.4. Качественный и количественный методы анализа раствора натрия хлорида изотонического 0,9% для инъекций Solution Natrii chloridi isotonica 0,9% pro injectionibus Раствор натрия хлорида изотонический 0,9% для инъекций Состав. Натрия хлорида……………………………..9г Воды для инъекций………………………….до 1л Описание. Бесцветная прозрачная жидкость соленого вкуса. Подлинность. 5мл препарата, упаренные до 1мл, дают характерную реакцию на натрий. pH 5,0 – 7,0 (потенциометрически). Количественное определение. 10мл препарата титруют 0,1н раствором нитрата серебра до оранжево – желтого окрашивания (индикатор – хромат калия). 1 мл 0,1н раствора нитрата серебра соответствуюет 0,005844г NaCI, которого в 1мл препарата должно быть 0,0087 – 0,0093г[5].
|
|||||||
|
Последнее изменение этой страницы: 2019-11-02; просмотров: 128; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.221.165.246 (0.012 с.) |