
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Строение слоистых силикатов группы смектитов. Монтмориллонит.
Смектиты представляют из себя наиболее интересную группу глинистых минералов, благодаря их способности к адсорбции и внешнекристаллическому набуханию. Минералы группы смектитов относятся к слоистым силикатам с трехслойными пакетами и обладают диоктаэдрическим (монтмориллонит, бейделит, волконскоит, нонтронит), триоктаэдрическим (гекторит, соконит, сапонит и др.) и промежуточным ди-триоктаэдрическим строением (множество минералов монтмориллонитовой группы, встречающихся под разными названиями). Самым распространенным минералом этой группы является монтмориллонит – главный породообразующий минерал т.н. бентонитовых глин. Идеальным трехслойным пакетом, в слоях которого отсутствуют изоморфные замещения, обладает пирофиллит, имеющий химическую формулу (Al2)[Si4]O10(OH)2. Благодаря наличию межпакетных пустот в решетке пирофиллита легко протекают различные замещения, приводящие к возникновению заряда. При заряде пакета 0,33 свойства пирофиллита сильно изменяются, и продукты подобных замещений выделяются в отдельную минеральную группу смектитов. Типичный состав монтмориллонита выражается формулой (1/2Ca, 1/2Mg, Na, K)0,33(Al1,77Mg0,33)[Si4]O10(OH)2 [1]. Предельным случаем изоморфного замещения является вышеупомянутый минерал мусковит, у которого заряд одного пакета составляет 1. Промежуточное положение, между мусковитом и смектитами занимают минералы, относящиеся к группе гидрослюд, в которых заряд несколько меньше единицы, и в межпакетных пустотах имеется некоторое количество молекул воды. Однако ни пирофиллит, ни иллит не способны к набуханию. Напротив, расстояние между слоями в смектитах может намного превышать толщину самого пакета. Характерными для смектитов величинами является базальное расстояние d, т.е. расстояние между кремнекислородными сетками соседних слоев и межслоевое расстояние Dd (рис. 1.1.)
Фактически заряд формульной единицы смектитов колеблется от 0,2 до 0,6, а емкость катионного обмена составляет от 0,7 до 1,3 мг-экв/г. Кроме того, в случае природных образцов смектитов можно говорить только о преимущественном характере изоморфных замещений. Например, в различных монтмориллонитах отношение ионов Mg к ионам Al в октаэдрических сетках может варьироваться от 1:4 до 1:5, а отношение ионов Al к ионам Si в тетраэдрах может колебаться от 1:15 до 1:20.
Возможность удаления друг от друга двух соседних слоев глинистого минерала при набухании определяется главным образом двумя факторами – положением центра отрицательного заряда, плотностью отрицательного заряда и природой межслоевого катиона. В случае незаряженных или слабозаряженных силикатов взаимодействие между слоями происходит за счет сил Ван-дер-Ваальса. Притяжение между соседними слоями, несущими отрицательный заряд осуществляется, кроме того, через притяжение каждого из соседних слоев к межслоевому катиону. Энергия притяжения слоя к межслоевому катиону определяется выражением:
где s - плотность слоевого заряда – если площадь половины элементарной ячейки монтмориллонита составляет 0,465 нм2, то s - единица заряда на эту площадь, z – валентность межслоевого противоиона, е – заряд электрона, e - диэлектрическая постоянная, R – расстояние между центром катиона и центром тяжести электрического заряда микроаниона. Уравнение 1.1 показывает, что крупные и полизарядные катионы удерживаются на поверхности и удерживают соседние слои значительно сильнее, чем ионы Li и Na. Кроме того, последние сильнее взаимодействуют с водой, что приводит к дополнительному увеличению расстояния между слоями. С другой стороны, энергия взаимодействия зависит от расстояния между зарядами и от их плотности. Поэтому вермикулиты и гидрослюды неспособны к неограниченному набуханию, так как, в отличие от смектитов, они обладают более высокой плотностью заряда, а центр отрицательного заряда располагается ближе к поверхности индивидуального пакета (изоморфные замещения в тетраэдрической сетке). В случае однозарядных межслоевых катионов Ван-дер-Ваальсовы и электростатические силы притяжения между слоями становятся меньше, по сравнению с полизарядными катионами, поскольку каждый из обменных катионов компенсирует дефицит положительных зарядов только в одном слое. Гидратированный катион с увеличенными размерами не допускает сближения слоев до «контактного расстояния», на котором в достаточной мере проявляются межмолекулярные силы притяжения. Только при температуре выше 300°С слои сближаются и монтмориллонит теряет способность к набуханию [ 2 ].
|
|||||
|
Последнее изменение этой страницы: 2019-05-20; просмотров: 323; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.12.240 (0.006 с.) |

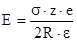 (1.1.),
(1.1.),


