
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Центральный постулат молекулярной биологии. Молекулярная биология и другие науки. Геномика и протеомика.Стр 1 из 13Следующая ⇒
Центральный постулат молекулярной биологии. Молекулярная биология и другие науки. Геномика и протеомика. Главный постулат мол.биол.: ДНК—РНК—белок. Физико-химическая биология объединяет биофизику, биохимию, биоорганическую химию, молекул.генетику. Связующее звено – молекулярная биология. В 80-е гг. возникла биоинформатика на стыке мол.биологии и информатики. Созданы банки нуклеотидных послед-тей. Основная цель исследований – выявление закономерностей между структурой и функцией генов. Развивались представления об эволюции генов. Геномика – изучение генов на разных стадиях онтогенеза для обеспечения функционирования организма как единого целого. Протеомика – полные наборы белков, обеспечивающих метаболизм клетки на различных этапах развития организма. Белковая инженерия – возможность синтеза белков с определенной последовательностью аминокислот, выявлением взаимосвязи между первичной и другими структурами белков. Моделирование пространственной структуры белков.
Научно-практические задачи и достижения молекулярной биологии. К концу 20 в. были расшифрованы геномы бактерий, дрожжей, нематод, дрозофилы, почти геном человека. Накапливается банк экспериментальных данных. Поднимаются новые проблемы, рождаются новые идеи. Ученые занялись теоретическим осмыслением накопленных знаний и попытки выявить закономерности функционирования живых систем. Разработка проблем онкогенеза, преодоление и лечение генетических болезней, долголетие, клонирование. Создание новых биотехнологий в промышленности и с/х, создание новых форм организмов. Задачи: расшифровка геномов, создание банков генов, геномная дактилоскопия, молекулярные основы эволюции, развитие и старение, диагностика и лечение генетических болезней, новые биотехнологии производства продуктов питания. Затрагиваемые вопросы: строение белков, аминокислот, строение и действие ферментов, упаковка генетического материала, синтез, строение, созревание и распад РНК, митотический цикл и распад ДНК, рекомбинация и репликация ДНК,трансляция, фолдинг и рекомбинация белков, исследование мембран и межклеточных взаимодействий, апоптоз, генная инженерия, клонирование.
Аминокислоты в свете проблем молекулярной биологии. Кислотно-основные и оптические свойства. Функциональные группы. Мономерная единица белка – аминокислота (белковые, небелковые; гидрофильные, гидрофобные; циклические, нециклические; заменимые, незаменимые; по числу функциональных групп) Имеются карбоксильные и аминогруппы, сульфгидрильная, гидроксильная, имидазольная у гистидина. Ионогенные группы аминокислот в составе белковых молекул участвуют в образовании водородных и ионных связей, как внутри белка, так и образуя комплексы. Дисульфидные мостики обеспечивают жесткость пространственной структуры. Молекулы белков могут присоединять ионы металлов, неметаллов, коферментов, хромофорные группы. Химический синтез: получают при обработке аммиака альфа-галоидпроизводных аминокислот. В результате получают рацемические смеси, которые с помощью ферментов преобразовывают в Л-формы. Ферментативный синтез: проведение ферментативных реакций. Использование рацемаз для преобразования Д-формы в Л-форму или лиаз (фенилаланин-аммиак-лиазы) для синтеза фенилаланина из коричной кислоты и аммиака. Микробиологический синтез: осущ-ют штаммы микроорганизмов из отходов сахарной промышленности, крахмала, ацетона. У них часто утрачен ряд ферментов, нарушаются метаболические пути и аминокислоты выбрасываются наружу. Этот метод наиболее рационален.
Природные пептиды Пептиды состоят из альфа-аминокислот, связанных пептидными связями в единое целое. Это гормоны, антибиотики, токсины, глутатион. Пептид начинается с аминокислоты, у которой свободна альфа-аминогруппа, и заканчивается аминокислотой со свободной карбоксильной группой. Все другие связи участвуют в образовании пептидной связи. В химических реакциях участвуют свободные амино-и карбоксильные группы, наличие общего заряда и кислотности. Качественная реакция – биуретовая.
Химический синтез пептидов: используют твердофазный метод синтеза. С-концевую аминокислоту присоединяют к полимерной матрице и строят пептид с другого конца (последняя аминокислота будет иметь свободную амино-группу.)Далее через раствор пропускают следующей с конца аминокислоты. Производят при отсутствии воды. Производят защиту активных групп (вначале аминогруппу, затем карбоксильную) Для каждого пептида своя стратегия синтеза. Если активируется карбоксильная группа, то смесь может оказаться рацемической. На концах фрагментов часто глицин (оптически не активен). Цене метод Меррифилда (повторяющиеся циклы присоединения необходимой аминокислоты с защищенной аминогруппой с последующим отщеплением защитной группы). Для выделения пептидов используют жидкостную хроматографию. Сочетание этих двух методов позволят получать пептиды из 15-20 аминокислот.
Ферментативный синтез пептидов: на стадиях используют ферменты. Так получают аспартам. Для смещения равновесия ферментативных реакций, их проводят в среде органических растворителей. Также заменяют одну аминокислоту на другую. Превращают свиной инсулин в человеческий. Биологический синтез пептидов: Отщепление путем ограниченного протеолиза пептида от синтезированного матричным способом белка специфическими протеиназами (пептидные гормоны гипофиза – вазопрессин, окситоцин; энкефалины из адреналина). Из одного белка предшественника могут получить группу пептидов. Биосинтез при помощи ферментных систем (глутатион и антибиотики пептидной природы – грамицидин S) Биосинтез при участии тРНК (аминоацил-тРНК-протеин-трансфераз), при котором аминокислоты присоединяются с аминоконца, синтезированного матричным способом пептида) Молекулярно-биолгическое изучение структуры пептидов позволяет создавать синтетические аналоги, создаются лекарства.
Иммуноглобулины. · Синтезируются в организме позвоночных · Характеризуются чрезвычайным разнообразием · Способны распознавать и специфически связывать чужеродные молекулы – антигены, а также включать механизмы их уничтожения, выполняя защитную функцию антител. · Случаи образования прочных комплексов с участием белковых молекул широко известны. Напр., связывание авидином (белком куриного яйца) витамина биотина, или ферментами – специфических ингибиторов и т.п.Многообразие иммуноглобулинов: Различают 5 классов – IgA, IgD, IgG, IgE, IgM • Каждый включает ряд подклассов • Каждый иммуноглобулин содержит лёгкие и тяжелые цепи • Примерная молекулярная масса цепей – 15-70 кДа • Для каждой цепи характерна доменная организацияСтруктура иммуноглобулина G: Четвертичная структура молекулы образована двумя тяжёлыми (Н) и двумя лёгкими (L) цепями (субъединицами), что можно выразить формулой (Н 2 L 2). Целостность структуры поддерживается нековалентными взаимодействиями и межсубъединичными дисульфидными мостиками • В пространственной структуре обеих цепей иммуноглобулинов часто выделяются домены. • Лёгкие цепи содержат по два домена, а тяжёлые – по четыре. • Первичные структуры NH2–концевых доменов цепей обоих видов очень разнообразны. Их называют вариабельными – V L и V H. • Остальные домены являются константными – С (СL, CH1, CH2, CH3 – номера возрастают к карбоксильному концу полипептида). Доменная структура делает молекулу иммуноглобулина весьма подвижной. Вариабельные домены VL и VH, взаимодействуя между собой, формируют единый центр связывания антигена.
Два сдвоенных домена (VL + VH) и (СL + CH1) образуют общую структуру, называемую Fab-фрагментом (Fragment antibody binding) – связывающий антигены. • Fab -фрагменты обладают значительной гибкостью, и угол между ними может достигать 180 град. Это обеспечивается шарнирным участком, богатым остатками пролина. • Некоторые патогенные микроорганизмы способны разрушать этот участок с помощью протеолитических ферментов, что может привести к разделению Fab- и Fc-фрагментов и, в отдельных случаях, - к инактивации, напр., иммуноглобулина А. «Хвостовая» часть представлена доменами (CH2 + CH3) и обозначается как Fc-фрагмент (crystallizable – кристаллизующийся). Этот участок отвечает за взаимодействие со специфическими рецепторами иммуноглобулинов и необходим для запуска цепи реакций, направленных на уничтожение связанного антигена. l Гены, кодирующие как лёгкие, так и тяжёлые цепи, собираются из меньших по размеру генов. l Их рекомбинации с другими генами дают огромное разнообразие синтезируемых иммуноглобулинов. l Возможное количество вариаций превышает 10 млн. Таким образом, доменный принцип организации и сложный характер формирования активных генов иммуноглобулинов позволяет создавать огромное разнообразие антигенсвязывающих белков. Абзимы – антитела, специфические образующие структуры, химически эквивалентные переходному состоянию фермент-субстратного комплекса, наблюдаемому в ходе ферментативной реакции. Антитела – это ферменты с низкой каталитической активностью. Проблемы направленного синтеза ряда ферментов являются трудноразрешимыми или слишком дорогими. Поиск эффективных антител и способов их интенсивного накопления – важное направление молекулярной биологии. Изучение иммуноглобулинов позволяет глубже проникнуть в понимание ферментативного катализа. Это открывает возможность создания биологических катализаторов нового типа.
ФЕРМЕНТЫ Главная функци я ферментов состоит в ускорении биохимических реакций, поэтому молекулярных биологов интересуют механизмы ферментативного катализа. Особенности ферментативного катализа характеризуются протеканием: при низких температурах, При рН – часто близких к нейтральному значению, При нормальном атмосферном давлении, С высокой специфичностью, С отсутствием побочных продуктов реакции. В целом ферментативная реакция может быть записана следующим образом:
E + S ßè ES ßè ES* ßè EP ßè E + P Специфичность действия ферментов – это способность фермента осуществлять выбор субстрата строго определённой химической структуры из большой совокупности близких по строению веществ. Она является абсолютно необходимой, т.к. позволяет упорядочить метаболизм клетки и избежать образования ненужных побочных продуктов Специфичность действия определяется структурой активного центра Для ферментов с групповой специфичностью проводят исследования с группой субстратов, а для ферментов с абсолютной специфичностью проводят эксперименты, как с определённым субстратом, так и с его аналогами (в т. ч. – конкурентными ингибиторами). Специфичность рассматривается в виде поэтапного процесса: Специфичность образования фермент-субстратного комплекса (ФСК) Для большинства ферментов для образования ФСК необходимы гидрофобные взаимодействия, которые позволяют выделить субстрат из окружающей полярной (водной) среды. Первичная стадия «экстракции» субстрата производится активным центром. Затем подключаются водородные связи, электростатическое взаимодействие и т. д Показано, что переход молекулы субстрата из воды в окружение активного центра можно уподобить её переходу в неводный растворитель. При этом рассматриваются две модели: экстракционная, экстракционно-конформационная. Мембранно-связанные белки. o Характеризуются многообразием (напр., в плазмолемме эритроцитов ок. 100 различных белков). o Классификация по структуре – отсутствует o Классификация по функциональной роли – сложна, из-за полифункциональности многих белков Классификация по функциональности 1. Структурные белки 2. Транспортные белки 3. Белки межклеточных взаимодействий 4. Белки, участвующие в передаче сигналов: n Рецепторные белки, Белки передающего устройства,Ферменты G -БЕЛКИ: n Этой группе белков принадлежит особо важная роль в передаче сигналов в клетку и внутри клетки. n Белки характеризуются тем, что в своей структуре содержат GTP или продукт его гидролиза – GDP. Присутствие в окружающей среде GTP обеспечивает превращение одной формы и конформации белка – в другую:G-белок-GDP + GTP = G-белок-GTP* + GDP. Т.к. G-белок обладает собственной GTP-азной активностью, комплекс G-белок-GTP* существует определённое время. • Такой комплекс вступает во взаимодействие со специальным белком, что вызывает изменение конформации и активности G -белка: G- белок -GTP* + Prot à Prot-G- белок -GTP. • Конечный комплекс взаимодействует с рецепторами, обеспечивая дальнейший каскад ответных ферментативных реакций Далее такой сигнал приводит к временной активации ферментных систем, В результате их действия активируются другие ферменты и процессы, важные для перехода клетки в новое физиологическое состояние. После гидролиза GTP:комплекс распадается, сигнал исчезает, перестают выполняться все физиологические процессы, зависимые от этого рецептора.
Нормальный ген с-Н-ras кодирует белок с молекулярной массой в 21 кДа (р21). Он находится в цитоплазматической мембране и является предшественником онкобелка. Его функция в нормальной клетке связана с восприятием внешнего сигнала, стимулирующего рост и деление клетки. Механизм действия р21: l Накопление в клетке GTP приводит к образованию комплекса р21- GTP, l Его время полужизни составляет примерно 1 час, т.к. р21 расщепляет связанный GTP. l Появление в клетке специального белка GAP (GTP - ase activating protein) приводит к образованию комплекса вида GAP - p 21- GTP. l Известно, что белок GAP взаимодействует с рецептором фактора роста и, возможно, делает его восприимчивым к другим сигналам (веществам). • Тройной комплекс GAP - p 21- GTP значительно усиливает восприимчивость рецепторов. o Мутации гена c-H-ras: приводят к тому, что даже присоединение белка GAP к комплексу p 21- GTP не увеличивает скорости гидролиза GTP. o В результате стабильность комплекса GAP - p 21- GTP значительно возрастает, что увеличивает время восприимчивости клеток к факторам роста. o Таким образом, нормальные клетки превращаются в опухолевые, а мутантный ген c-H-ras становится онкогеном.
Строение хромосом. Типы хромосом по положению центромеры: Метацентрические, Субметацентрические, Акроцентрические. Центромеры хромосом по обеим сторонам содержат богатые сателлитными последовательностями участки ДНК и могут иметь значительнольное количество конститутивного хроматина. Кончные участки хромосом – теломеры – последовательности, придающие ДНК стабильность. Состоят из длинных серий коротких, повторяющихся последовательностей. Есть ряд одноцепочечных разрывов, структура которых препятствует их сшиванию лигазой. У эукариот хроматин имеет нитевидную структуру Виды хроматина: Эухроматин - составляет часть генома, которая экспрессируется, что обеспечивает ж/д клетки. Гетерохроматин – участки хромосом, всегда находящиеся в спирализованной форме, инертны. Конститутивный (никогда не экспрессируется) Факультативный (молчит некоторое время, в т.ч. Х-половая хромосома)
Строение ДНК. У всех живых существ молекулы ДНК построены по одному и тому же типу. Они состоят из двух полинуклеотидных цепочек. Объединяются две цепи в единую полимерную молекулу ДНК водородными связями между азотистыми основаниями нуклеотидов. При этом аденин (А) соединяется только с тимином Т, а гуанин (Г) — с цитозином (Ц). Данные нуклеотиды в молекуле ДНК всегда располагаются друг против друга. Полиморфизм двойной спирали: правозакрученные спирали – А- и В-семейства. Первое содержит углеводную часть в виде С3’ – эндо-конформации, второе – в виде С2’ – эндо-конформации. Левозакрученная форма – Z-форма. А-форма существует при влажности 75% и нуждается в присутствии катионов одновалентных щелочных металлов.Диаметр спирали 2,3 нм, пар на виток – 11. В форме А молекулы ДНК в 10 раз устойчивее к ультрафиолету. Форма В (низкая концентрация соли, 92% влажности) – модель Уотсона и Крика.Шаг спирали 3,4 нм, пар оснований на виток – 10, Диаметр – 1,9 нм. С, D, Е,Z – отражают динамеческие возможности структуры ДНК. Форма – Z – существует при стабилизирующих факторах. Суперспирализация – отрицательные левозакрученные супервитки. Уровни упаковки хроматина: 1 уровень: сформирован из доменов, имеющих одинаковый тип организации. Последовательность ДНК в 140 пар нуклеотидов, которая закручена вокруг белковых частиц. ДНК – на поверхности, белки – внутри. 2 уровень: закручивание серий бус в специальную структуру с образованием волокон размером 30 нм. Плотность упаковки = 40. 3 уровень: более 1000.
Клеточный цикл.
Типы клеток: Митотические – постоянно делящиеся: Клетки базального эпителия Гемопоэтические клетки Сперматогонии и т.п. Условно митотические. Не делящиеся, но могут перейти к делению при необходимости (регенерация ткани): Клетки печени Стволовые клетки Постмитотические – не способны делиться: Клетки эпидермиса кожи Нервные клетки Клетки сердечной мышцы Стадии митоза: S – удвоение ДНК и хромосомных белков, удвоение центриолей. G2 – синтез белков для митоза, тубулина. М – митоз, G1 – восстановление содержания цитоплазматических белков и увеличение дочерних клеток до размера материнской. G0 – у вышедшей из дифференцировки клетки. Запускает процесс белок – интегрин, взаимодействуя с фактором роста.Выход из цикла в процессе дифференцировки. Выход из митотического цикла (фаза G0): M à G1 ß à G0 ß à G0 (D1) à G 0 (D 2) à... à гибель клетки
Репликация ДНК (5 ’ -3 ’). Особенности репликации ДНК: Осуществляется ферментным комплексом, В виде отдельных отрезков – репликонов, Новые ДНК укорочены с 5’-концов. Инициация синтеза ДНК начинается с образования точки роста (наличие суперспирали, нуклеотидные посл-ти) под действием праймосомы – топоизомераза, ДНК-связывающий, ДНК – раскручивающий белки, ДНК – полимеразный комплекс, ДНК-зависимую РНК-полимеразу. ДНК-праймаза синтезирует начальный фрагмент РНК-праймер, который присоединяется к локусу начала синтеза ДНК, после чего рост продолжается с участием дезоксирибонуклеотидов. Синтез цепей ДНК в репликативной вилке. Направление репликации 5`3`. Одна цепь (лидирующая) синтезируется как единое целое от 5’ к 3’, участвует ДНК-полимераза-III, а другая (отстающая) – короткими участками, от 3’ к 5’ концу. Наличие РНК-полимеразы в праймазе обеспечивает синтез РНК-праймера. ДНК-полимераза-III удлиняет праймер в направлении 5’-3’, образуя «фрагменты Оказаки», которые впоследствии сшиваются в единую цепь.
Структура теломер Более высокие уровни организации – за счёт взаимодействия с белками (гетерохроматин) Белок Rap1 – у дрожжей и TRF1 – у млекопитающих Обеспечивают защиту ДНК от ДНК-метилаз и эндонуклеаз Теломеры могут образовывать нуклеосомную структуру Функции теломер Механические Связь с ядерным матриксом для правильной ориентации в ядре и при мейозе Обеспечение сцепления сестринских хроматид Стабилизационная Предохранение от недорепликации значимых участков Стабилизируют концы разорванных хромосом Влияние на экспрессию генов (в онтогенезе) Отсчёт числа делений клетки.
Лимит Хейфлика 1881 г. А.Вейсман – способность клеток к делению ограничена А. Каррель исследовал деление клеток в кусочках ткани куриного сердца в питательной среде Культивацию проводили в 1912-1946 гг. Вывод: старение присуще только сложному организму К 60-м гг. ХХ в. изменилась техника культивирования клеток. Л.Хейфлик и П.Мурхед работали с культурой клеток – фибробластов человека Когда на дне сосуда заканчивалось место наблюдалось контактное торможение. Лимит Хейфлика – 50 делений Вывод: старение – это свойство клеток, которое запрограммировано генетически Доказательства ограниченности числа делений клетки: 1. Исходные клетки-фибробласты зародыша человека делятся 50 раз. Клетки взрослого – менее 50: чем старше донор – тем меньше число делений 2. Клетки запоминают предыдущее число делений (опыты с замороженными клетками) 3. Лимит Хейфлика для разных животных 4. За несколько делений до остановки размножения рост популяции клеток замедляется и меняется их морфология: они становятся более крупными и расплываются. Меняются биохимические характеристики – активность ферментов, интенсивность синтетических процессов и т.п. Теломерная теория старения. Теломерная теория старения опирается на 2 главных факта: 1. Предельное число делений клетки – около 50, укорочение теломер; 2. Длинные теломеры тормозят функционирование генов, ограничивающих число делений клетки. При укорочении теломер меняется положение этих генов в хромосомах, они активируются, клетки теряют способность к делениям. Активация гена p53, его продукт останавливает деление клеток. Не согласующиеся с теорией данные: l Потенциал клеток к делению не исчерпан даже у 90-летних (ещё 30 делений клеток в культуре) l Через 50 делений теломеры будут короче на 2-3 тнп при длине 10-15 тнп l Заражённые вирусом SV40 клетки человека делятся ещё 20-60 раз l Введение гена теломеразы увеличивало число делений до 70 l В ряде клеток введение гена теломеразы увеличивало длину, но число делений было равно 50 l У ряда видов – длинные теломеры (100-120 тнп) плюс активная теломераза – мышь – число делений равно 20 Защитные системы организма. Защитные системы организма на внутриклеточном уровне: l Система репарации ДНК l Система теломер и теломеразы l Антиоксидантная система (ферменты, витамины, пигменты и др.) l Система шаперонов (БТШ) l Система метилирования ДНК СТАРЕНИЕ ОРГАНИЗМА ВЫЗВАНО ПОСТЕПЕННЫМ ОСЛАБЛЕНИЕМ ДЕЯТЕЛЬНОСТИ СИСТЕМ ЗАЩИТЫ ОРГАНИЗМА В ОНТОГЕНЕЗЕ. Снижается активность фермента теломеразы. В онтогенезе происходит: o Накопление разрывов в ДНК o Ослабление индукции БТШ o Снижение активности ДНК-метилазы o Уменьшение количества 5-метил-цитозина в ДНК o МЕХАНИЗМ СВЯЗАН С ЭФФЕКТОМ ПОЛОЖЕНИЯ ГЕНОВ В ОНТОГЕНЕЗЕ n Половые клетки: Хромосомы проходят «капитальный ремонт» в профазу I мейоза (диакинез – конъюгация и кроссинговер), в результате чего они «омолаживаются» n Это обеспечивает максимальное восстановление нормальной структуры генома будущих половых клеток и, следовательно, ПОКОЛЕНИЙ!
Теломераза и онкогенез Иммортализованные (бессмертные) клетки линии HeLa. 1952 г. Причины онкогенеза. Мутации 3-7 генов под действием разных факторов. Экспериментально – с помощью ДНК-содержащего вируса SV40. Первая стадия трансформации клеток: Меняется морфология, совершается дополнительно 20-60 делений. Дальнейшее укорочение теломер. Из-за максимального укорочения теломер наступает кризис (под микроскопом наблюдают слипание концов хромосом из-за их нестабильности). Прекращается рост популяции. Большая часть клеток – гибнет. Во вторую стадию переходит 10-5 -10-9 клеток (становятся бессмертными.) В клетках преодолевших кризис: Появляется активность теломеразы (обратной транскриптазы). Увеличивается длина теломер. Клетки приобретают свойство постоянного деления. Доказательства значения теломеразы: Ингибитор обратных транскриптаз вызывает остановку деления и гибель таких клеток. У гибридов нормальных и раковых клеток активность теломеразы блокирована репрессором(ами). Превращение клетки в раковую – процесс многосторонний: Удлинение теломер. Уменьшение или исчезновение белков регуляции клеточного цикла (р53 и pRb). Снижение активности ферментов репарации ДНКи пр. Клетка НЕ становится молодой, а переходит в ИНОЕ физиологическое состояние (качество). Частота обнаружения теломеразы: В злокачественных образованиях – 85%, В доброкачественных и нормальных тканях – 27%. Таким образом, уменьшение теломер может активировать теломеразу и перерождение клеток в опухолевые.
Понятие гена и цистрона. Число типов клеток у человека – более 200, но все содержат один и тот же геном Ген – это участок ДНК, кодирующий один белок Цистрон – участок ДНК, кодирующий одну полипептидную цепь Для одноцепочечных белков понятия – однозначны
В молекуле ДНК различают: Смысловую (кодирующую или Ц-цепь): (5’)-ЦТААЦЦ-…ЦТААЦЦ-…-ГГТТАГ-…ГГТТАГ-(3’) и Матричную (противоположную или Г-цепь) (3’)-ГАТТГГ-…ГАТТГГ-…-ЦЦААТЦ-…ЦЦААТЦ-(5’). Большинство генов закодировано на первой, некоторые – на второй
Регуляция активности постоянно работающих генов: Посредством изменения концентрации: Субстрата реакции, Продукта реакции. С последующим подключением гормонов, специализированных белков и т.д.
ИНТРОНЫ – вставочные элементы, выполняющие регуляторную функцию в синтезе иРНК и белков. В одном гене – от двух до нескольких десятков. Могут занимать до 90% общей длины гена. ЭКЗОНЫ – кодирующие участки ДНК. СПЕЙСЕРЫ – некодирующие участки ДНК между генами. Функции: Участие в правильной укладке хроматина, В прикреплении хромосом к нитям веретена деления, Связывают гены разных белков, Участвуют в обеспечении регуляции активности генов (у бактерий – операторы), Содержат сигналы терминации транскрипции РНК. Разнообразие генов: Уникальные, Малокопийные (от нескольких штук до нескольких десятков), Многократно повторяющиеся. 4
• Гены гамма, дельта и бета объединены в кластер, повторяющийся в хромосоме несколько раз
Ген бета имеет сложное строение Ген альфа находится в другой хромосоме
Организация генетического материала бактерий: Гены ферментов, катализирующих ряд последовательных реакций часто образуют одну структурно-функциональную единицу – оперон
1. Индуцибельные опероны: регулятор – исходный субстрат цепи контролируемых реакций. Накопление их ведет к связыванию с белком-репрессором. В результате происходит уключение гена. 2. Репресибельные опероны: регулятор – конечный продукт цепи реакций. Комплекс с белком-репрессором присоединяется к регуляторной части и выключает работу гена.
РНК. иРНК Особенности строения: на 5’ –конце есть «кэп» из 1-4 модифицированных нуклеотидов, первый – 7-метилгуанозин-трифосфат. Следующие нуклеотиды м.б. метилированы. Такая структура защищает конец от внутриклеточных экзонуклеаз. За кэпом нетранслируемый 5’- участок, важный для первичного связвания с рибосомой. Далее инициаторный кодон – АУГ – метионин. Кодирующая часть, содержит информацию о первичной структуре белка. 60-70% нуклеотидной последовательности. В конце терминирующий кодон – УАА, УАГ, УГА. Далее 3’- некодируемый участок. Далее poly (A) – хвост. Последние два участка отвечают за продолжительность жизни иРНК. Для транспорта к месту синтеза полипептидной цепи и увеличения продолжительности жизни иРНК образуют комплекс с белками с М.м. 52 кДа и 78 кДа. Такие комплексы называют РНП-частицами.
ТРНК и рРНК Гены тРНК организованы в кластеры и расположены в разных хромосомах. Все пре-тРНК содержат последовательности с формой кленового листа. В структуре есть штриховые участки, где нет минорных нуклеотидов и последовательности ЦЦА в акцепторной цепи для присоединения амкт, антикодон не занимает правильное положение. В ходе созревания приобретает свойства: присоединение нуклеотидов ЦЦА к акцепторной ветви, восстановление некоторых остатков уридина, изомеризация некоторых уридинов, метилирование некоторых уридинов. Вторичная структура складывается в третичную: буква Г. У крупных рРНК во вторичной структуре содержится 4 основных домена: центральный, 3/-главный, 5/- и 3/-минорный. 18 S – РНКобразует комплекс с 30 разными белками, в результате образуется малая субъединица рибосомы. 5,8 – S, 28 S – рРНК комплекс с 60 белками, и формирует большую субъединицу. Ядерные (эукариотические)80 S = 60 S + 40 S. Цитоплазматические и бактериальные (прокариотические)70 S = 50 S + 30 S. 30S-субчастица обладает вытянутой и асимметричной формой с уплощенной областью и с щелью, отделяющей головку от тела. 50S-субчастица имеет весьма компактное тело, из которого выпячиваются протуберанец и тело. Образование 70S-рибосом происходит путём ассоциации между несколькими отдельными участками двух субчастиц Транскрипция. Механизм транскрипции: Инициация состоит в связывании РНК-полимеразы с промотором на участке ДНК с определённой последовательностью нуклеотидов (бокс Прибнова) (5’)-TATAAT-(3’). В его узнавании участвует специальный белок сигма-фактор и другие белки. У эукариот – комплекс белков. Связывание РНК-полимеразы приводит к разделению цепей ДНК на примерно 15 нуклеотидных пар и образуется транскрипционный «глазок».Первым в синтезируемую цепь РНК включается пуриновый нуклеотид – АТФ или ГТФ, Затем образуется 5’ 3’-фосфатная связь со вторым нуклеотидом. Отщепляется сигма-фактор. Элонгация. Далее субъединицы РНК-полимеразы (кор-фермент) перемещаются по ДНК. «Глазок» увеличивается, и РНК образуется со скоростью примерно 30 нуклеотидов в сек. С частотой примерно 1 на 20 тысяч включаются ошибочные нуклеотиды, т.е. точность процесса сравнительно невелика (вспомним, что ошибки при репликации ДНК составляют 10–8 – 10–10). Учитывая вырожденность генетического кода, примерно две трети ошибок этого рода не имеют значения. Терминация. Сигналом для окончания транскрипции РНК служат специальные ГЦ-богатые участки в конце каждого гена. В РНК тоже синтезируется такой участок, который образует «шпильку», облегчающую отсоединение образованной РНК от ДНК-матрицы. У бактерий этому помогает специальный r-фактор. С одного гена одновременно может синтезироваться несколько РНК. В результате образуются предшественники всех видов РНК, которые образуют так называемую гетерогенную ядерную РНК (гяРНК).
Созревание (процессинг) РНК. рРНК - разделение единого транскрипта на типы РНК, 18, 5,8, 28 – S рРНК, метилирование рибозных остатков. У крупных рРНК во вторичной структуре содержится 4 основных домена: центральный, 3/-главный, 5/- и 3/-минорный. 18 S – РНКобразует комплекс с 30 разными белками, в результате образуется малая субъединица рибосомы. 5,8 – S, 28 S – рРНК комплекс с 60 белками, и формирует большую субъединицу. тРНК: В ходе созревания приобретает свойства: присоединение нуклеотидов ЦЦА к акцепторной ветви, восстановление некоторых остатков уридина, изомеризация некоторых уридинов, метилирование некоторых уридинов. Вторичная структура складывается в третичную: буква Г. иРНК: Отщепление «лишних» нуклеотидов с обоих концов цепи РНК. Разрезание кластерных РНК на отдельные РНК.Вырезание интронов. Два последних процесса обеспечиваются механизмом сплайсинга – точного отрезания и соединения нуклеотидных последовательностей. В этом процессе принимают участие специальные РНП-комплексы – сплайсосомы. Далее происходит присоединение «кэпа» с 5’-конца и poly(A)-хвоста. Все эти процессы происходят в ядре, В результате образуются зрелые РНК. РАСПАД иРНК: Происходит в цитоплазме. У бактерий РНК могут разрушаться с того же конца, с которого и синтезируются, т.е. с 5’ (5’-РНКазами). У эукариот иРНК разрушаются с 3’-конца 3’-РНКазами и эндонуклеазами. По мере прохождения рибосомы при завершении синтеза белковой цепи она ударяется о конец шпильки и «отламывает» кусочек «хвоста». Следующая рибосома отламывает ещё кусочек. В конце концов водородные связи в петле «хвоста» не выдерживают напряжения, петля разрывается и 3’-конец становится доступным для действия 3’-РНКазы, разрушающей иРНК. Регуляция распада иРНК может осуществляться. Наличием в цитоплазме белков-продуктов синтеза с этой РНК, накоплением метаболитов, ионов и т.д. Время полужизни иРНК составляет от нескольких минут до нескольких суток (если они находятся в составе РНП-частиц и расходуются постепенно).
Трансляция. В рибосоме различают 4 основных центра связывания и протекания реакции: 1. Центр связывания иРНК, образованный участком 18S рРНК (малой субъединицы). 2. Пептидильный центр (Р), где связывается первая метионил-тРНК и куда перемещается в ходе реакции пептидил-тРНК. 3. А-центр – место связывания очередной аминоацил-тРНК. 4. Пептидилтрансферазный центр, обеспечивающий перенос пептидильного остатка на аминогруппу очередной аминоацил-тРНК. ИНИЦИАЦИя Инициация включает события, предшествующие образованию первой пептидной связи. Для этого необходимо образование комплекса из рибосомы, мРНК и аминоацил-тРНК. Инициация трансляции начинается со связывания иРНК 5’-нетранслируемым участком с малой субъединицей рибосомы. Инициаторный кодон АУГ оказывается на уровне пептидильного (Р)-участка. Далее связывается инициирующая формил-метионил-тРНК, которая взаимодействует с таким же участком на большой субъединице рибосомы, чем вызывает её присоединение и формирование полной рибосомы.В целом рибосому можно рассматривать как суперфермент, который обеспечивает правильную ориентацию участников процесса и катализирует реакции между ними. В инициации также принимает участие ГТФ и белковые факторы IF-1, IF-2, IF-3, которые обеспечивают правильную сборку всего комплекса. Таким образом формируется активная транслирующая рибосома.У эукариот процесс инициации обеспечивают, по крайней мере, девять белковых факторов. ЭЛОНГАЦИЯ Фактор элонгации образует тройной комплекс с ГТФ и аминоацил-тРНК, который связывается с А-участком рибосомы (при соответствии кодона иРНК и антикодона аминоацил-тРНК), после чего ГТФ гидролизуется с образованием ГДФ. Таким образом, элонгация складывается из следующих стадий:
|
|||||||||
|
Последнее изменение этой страницы: 2019-05-19; просмотров: 239; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.44.223 (0.174 с.) |

 Организация генетического материала бактерий: Гены ферментов, катализирующих ряд последовательных реакций часто образуют одну структурно-функциональную единицу – оперон
Организация генетического материала бактерий: Гены ферментов, катализирующих ряд последовательных реакций часто образуют одну структурно-функциональную единицу – оперон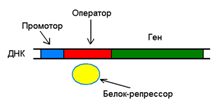 Схематическое строение гена прокариот:
Схематическое строение гена прокариот: вида гемоглобина (Hb) человека. В гемоглобине F гамма-цепи бывают двух видов – A и G. Т.о., белковую часть Hb кодируют 6 генов.
вида гемоглобина (Hb) человека. В гемоглобине F гамма-цепи бывают двух видов – A и G. Т.о., белковую часть Hb кодируют 6 генов.
 Регуляция активности постоянно работающих генов: Посредством изменения концентрации: Субстрата реакции, Продукта реакции. С последующим подключением гормонов, специализированных белков и т.д.
Регуляция активности постоянно работающих генов: Посредством изменения концентрации: Субстрата реакции, Продукта реакции. С последующим подключением гормонов, специализированных белков и т.д.


