
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Хімічний склад свердловинної продукціїСодержание книги
Поиск на нашем сайте
Природні гази, які видобувають із газових, газоконденсатних і нафтогазоконденсатних родовищ складаються, в основному, із вуглеводнів гомологічного ряду метану ( Метан СН Пропан С Нормальний пентан nС5 Н12, ізопентан іС Вони входять в склад бензинової фракції. Вуглеводні починаючи з С В багатьох випадках склад природних вуглеводневих газів визначають не повністю, а до пентану (nС5 Н12) або гексану С6 Н14 включно, а решта компонентів об’єднують в залишок (або псевдокомпонент) С5+В або С6+В. Молекулярну масу залишку можна визначити за компонентним складом, якщо він відомий, або кріоскопічним методом. Фізико-хімічні властивості вуглеводневих компонентів природних газів наведені у таблиці 1.2. Деякі фізико-хімічні властивості невуглеводневих компонентів природних, які входять в склад природних газів, наведені в таблиці 1.3.
Таблиця 1.2 – Фізико-хімічні властивості вуглеводневих компонентів природних газів
Таблиця 1.3 – Фізико - хімічні властивості невуглеводневих газів
Спосіб вираження складу фаз Продукція газоконденсатних родовищ складається із газу і конденсату, а газових родовищ з нафтовими облямівками - із газу і нафти. Суміш вуглеводневих компонентів в газоподібному і рідкому станах називають системою. Стан і властивості системи визначається впливом різних параметрів, які впливають на зміну системи. До таких параметрів відносять: тиск, температуру, об'єм, концентрацію компонентів або густину. Система знаходиться у рівновазі, коли всі її параметри залишаються незмінними. При такому стані в системі не відбувається явно видних якісних і кількісних змін. Систему називають гомогенною, якщо вона має однакові фізичні і хімічні властивості за об'ємом, наприклад, якщо окремо взяти газ, нафту, вуглеводневий конденсат, пластову воду. Систему називають гетерогенною, якщо вона має не однакові фізичні і хімічні властивості, тобто складається з речовин, які знаходяться в різних агрегатних станах. Говорять, що двохфазні газоконденсатні і газонафтові системи - гетерогенні. Під фазою розуміють відповідну гомогенну частину гетерогенної системи, яка має границю розділу з другими фазами. Таким чином, вуглеводневі системи можуть бути одно-, двох-, трьох- і багатофазними („газ - пластова вода", „газ - пластова вода - вуглеводневий конденсат", „газ – нафта – вода - солі” і другі домішки). Газові суміші (природні гази) характеризують двома складами масовими і молярними (об'ємними) концентраціями вуглеводневих компонентів, виражених в частках одиниць або у відсотках. Об'ємні концентрації приблизно співпадають з молярними так як, згідно закону Авогадро, об’єм 1 кмоля ідеальних газів при однакових фізичних умовах (Рат = 0,1013 МПа і Тст = 293 К) складає 22,41 м3. Концентрацію вуглеводневих компонентів газової (парової) фази будемо позначати через yi, а рідкої фази xi, де і = 1, 2, 3.... Наприклад, якщо склад газової фази заданий масовими концентрація компонентів, тоді Відповідно позначаються молярні (об'ємні) концентрації компонентів Рідкі суміші вуглеводнів характеризуються трьома складами: масовими, молярними і об'ємними, наприклад, Молекулярна маса вуглеводневого компоненту дорівнює сумі мас атомів, які утворюють молекулу. Наприклад, молекулярна маса пентану При відомому молярному складі газу середню молекулярну масу газу визначають за формулою
де:
Якщо заданий масовий склад газу в %, то середню молекулярну масу визначають за формулою
де: За відомою відносною густиною газу і невідомому складі газу середню молекулярну масу визначають за формулою
де: 28,98 - молекулярна маса повітря, безрозмірна величина; Використовуючи властивість адитивності, молекулярну масу вуглеводневої суміші можна визначити як суму добутків відповідних молекулярних мас компонентів Mi на їх мольні концентрації
При відомій молекулярній масі густину газу вираховують за формулами: а) при нормальних умовах (Рат = 0,1013 МПа, Тн = 273 К)
б) при стандартних умовах (Рат = 0,113 МПа, Тст = 293 К)
де: 22,41- об'єм
в) при тиску і температурі відмінний від стандартних умов
де: Р і РАТ - відповідно тиск, при якому визначають густину газу і атмосферний тиск, МПа; Т і Т ст - відповідно температура, при якій визначають густину газу і стандартна температура, К; Z (Р, Т) - коефіцієнт - стисливості газу при Р і Т. Перерахунок масових концентрацій компонентів газової суміші в об'ємні (молярні) і навпаки здійснюють за наступними формулами
де:
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-07; просмотров: 367; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.41 (0.009 с.) |

 ).
). , етан С2 Н
, етан С2 Н  при стандартних умовах (Р АТ = 0,1013 МПа і Т СТ = 293 К) - гази.
при стандартних умовах (Р АТ = 0,1013 МПа і Т СТ = 293 К) - гази. Н
Н  , нормальний бутан nС4 Н
, нормальний бутан nС4 Н  і ізобутан iС
і ізобутан iС  переходять у рідини.
переходять у рідини. Н
Н  і вищі вуглеводні до С17 Н36 при нормальних атмосферних умовах - рідини.
і вищі вуглеводні до С17 Н36 при нормальних атмосферних умовах - рідини. Н
Н  і до вище знаходяться у твердому стані.
і до вище знаходяться у твердому стані.



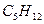

 ,
При постійн. об’ємі C V
,
При постійн. об’ємі C V
 кг/кг
кг/кг





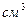 /мол
/мол 

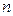 є номер вуглеводневого компоненту.
є номер вуглеводневого компоненту.
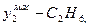

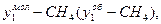
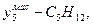

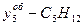
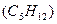 дорівнює М5 = 12,01115·5 + +1,00797·12 = 72,151 де С = 12,01115 - атомна маса вуглецю, Н = 1,00797 - атомна маса водню.
дорівнює М5 = 12,01115·5 + +1,00797·12 = 72,151 де С = 12,01115 - атомна маса вуглецю, Н = 1,00797 - атомна маса водню.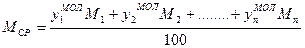
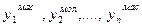 - молярні долі компонентів, %;
- молярні долі компонентів, %;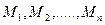 - молекулярні маси компонентів.
- молекулярні маси компонентів. , (1.2)
, (1.2)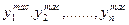 - масові долі компонентів, %.
- масові долі компонентів, %.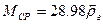 (1. 3)
(1. 3)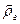 - відносна густина газу до повітря.
- відносна густина газу до повітря.
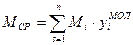 (1.4)
(1.4)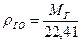 (1.5)
(1.5) (1.6)
(1.6)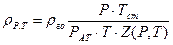 (1.7)
(1.7) (1.8)
(1.8) 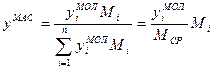 (1.9)
(1.9) ,
, 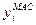 - відповідно молярні і масові концентрації компонентів газової суміші;
- відповідно молярні і масові концентрації компонентів газової суміші; 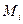 ,
, 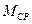 - відповідно молекулярні маси компонентів і середня молекулярна маса газової суміші.
- відповідно молекулярні маси компонентів і середня молекулярна маса газової суміші.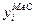 в молярні
в молярні 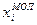 і навпаки здійснюють аналогічно, як для газових сумішей:
і навпаки здійснюють аналогічно, як для газових сумішей: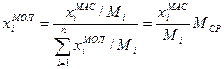 (1.10)
(1.10) (1.11)
(1.11)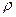
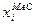 об'ємні де
об'ємні де  і навпаки відрізняються від попередніх тим, що замість молекулярних мас компонентів використовують відносні густини рідких компонентів ρ і середню густину суміші
і навпаки відрізняються від попередніх тим, що замість молекулярних мас компонентів використовують відносні густини рідких компонентів ρ і середню густину суміші 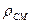 до води
до води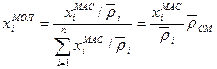 (1.12)
(1.12) (1.13)
(1.13)


