Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Лекция 1. Основные теоретические положения органической химии.Содержание книги
Поиск на нашем сайте
Лекция 1. Основные теоретические положения органической химии.
Учебные вопросы: 1. Общие представления, область применения; 2. Теория химического строения, взаимное влияние атомов, электронное строение органических соединений; 3. Изомерия органических соединений; 4. Поляризация химических связей, индукционный эффект и типы заместителей; 5. Классификация органических реакций.
Общие представления По способности атомов соединяться друг с другом в длинные цепи углерод занимает особое положение в периодической системе. Углерод может соединяться почти со всеми химическими элементами с образованием молекул цепной и циклической (кольчатой) структуры самых различных размеров. В состав цепей и циклов молекул органических соединений, кроме атомов С, могут входить Н, О, S, N, P, As, Si, Ge, Sn, Pb, B, Ti и другие элементы. Органическая химия – это химия соединений углерода, атомы которого связаны с атомами других элементов ковалентными, преимущественно мало поляризованными связями. Органические соединения, или соединения углерода, отличаются от неорганических многочисленностью и многообразием превращений. Если неорганических соединений насчитывается порядка 200 тысяч, то органических соединений известно свыше 2 миллионов. Законы химии управляют поведением как неорганических, так и органических веществ. Однако органические соединения имеют ряд отличительных особенностей. Так, большинство неорганических соединений – тугоплавкие вещества, а для органических соединений характерно состояние газов, жидкостей и низкоплавких твердых тел; большинство неорганических соединений не горючи, органические легче окисляются и горят, чем неорганические. К низкомолекулярным относят органические соединения с длиной цепи от 2 до 50 углеродных атомов, к высокомолекулярным – с длиной цепи порядка 200-200000 углеродных атомов и молекулярным весом порядка 104-106 у.е. Органические соединения при длине цепи порядка 200 атомов углерода обладают уже смолоподобными и каучукоподобными свойствами. Если цепи атомов кислорода, азота, фосфора, серы, бора и других элементов мало устойчивы, то длинные цепи атомов углерода в силу большой энергии С-С - связи (339 КДж) - весьма устойчивы.
Области применения Высокомолекулярные органические соединения: синтетические смолы и органическое стекло; пластические массы (пластмассы) и синтетические волокна; синтетический каучук. Лекарственные вещества. Красящие вещества (красители). Гербициды (вещества, уничтожающие сорняки). Инсектициды и фунгициды (вещества, уничтожающие, соответственно насекомых и грибы). Дефолианты (вещества, ускоряющие опадение листьев; применение их укоряет созревание хлопчатника и облегчает машинную уборку). Десиканты (соединения, способствующие высушиванию растений на корню). Витамины (сложные физиологически активные органические вещества, отсутствие которых в пище человека или животных ведет к нарушению нормальных функций организма). Ферменты (сложные органические соединения, являющиеся биологическими катализаторами, вызывающими процессы брожения, расщепления жиров, белков и т.п.) Консерванты (органические вещества, предохраняющие от закисания и порчи вина, соки, варенья, маринады и другие пищевые продукты). Органическая химия достигла огромных успехов в изучении состава и переработке каменного угля, нефти и природного газа; таким образом, она тесно связана с угольной, нефтяной и газовой отраслями промышленности, обеспечивающими с одной стороны, получение различных видов топлива, с другой – сырьем различные производства. Так, каменный уголь используют не только как топливо, путем переработки из него добывают необходимый для металлургии кокс, а так же светильный газ и каменноугольный деготь. Последний, свою очередь служит источником для получения многочисленных органических соединений, необходимых для синтеза ВМС, красителей, лекарственных и взрывчатых веществ и т.п. Из нефти путем её перегонки получают различные виды горючего, смазочные материалы и другие ценные продукты. Природный газ, особенно попутный нефтяной газ, также представляет собой ценное химическое сырье и топливо, используемое как в промышленности, так и в быту.
Теория химического строения Создана в 1858-1861 г.г. в русским химиком А. М. Бутлеровым. Основные положения теории химического строения: 1. Молекулы веществ - представляют собой реально существующие материальные частицы, обладающие определенным химическим строением. Т.е. атомы, образующие их, соединяются друг с другом в определенной, характерной для каждого вещества последовательности и взаимно влияют друг на друга. 2. Строение молекул вещества познаваемо и может быть установлено путем изучения свойств вещества, продуктов его превращений, а также путем его разложения и синтеза. 3. Свойства вещества определяются его качественным и количественным составом и химическим строением его молекул. Вещества, имеющие одинаковые состав и молекулярный вес, но различное строение, отличаются по своим свойствам; в этом заключается явление изомерии. 4. Взаимное влияние атомов, образующих молекулу, определяет реакционную способность каждого из них; химический характер одних и тех же атомов в различных молекулах зависит от того, с какими атомами они связаны в данной молекуле. 5. Углерод в органических соединениях, как правило, четырехвалентен; атомы его способны соединяться не только с другими атомами, но и друг с другом, образуя цепи; последние могут замыкаться с образованием циклов. Это свойство углерода и явление изомерии и обуславливают многообразие органических веществ. В развитии и обосновании теории химического строения большую роль сыграли русские химики – ученики и последователи А.М. Бутлерова: В.В. Марковников, А.М. Зайцев, Е.Е. Вагнер, Н.Д. Зелинский, М.И. Коновалов, А.Е. Фаворский и др.
Изомерия Еще в 1814 г. французский ученый Гей-Люссак установил, что некоторые вещества при одном и том же качественном и количественном составе обладают различными физическими и химическими свойствами. Например, состав C2H6O и, соответственно, молекулярный вес 46,07 имеют два различных изомерных органических вещества: этиловый спирт – жидкость, кипящая при 78,4 оС, смешивающаяся с водой в любых соотношениях, и диметиловый эфир – газ, почти не растворимый в воде и существенно отличающийся от этилового спирта по химически свойствам. Это явление, заключающееся в существовании нескольких химических соединений с одинаковым качественным и количественным составом, но отличных по физическим и химическим свойствам, было названо изомерией. Указанные соединения получили название изомеров. Сущность явления изомерии была раскрыта в теории Бутлерова. Выяснилось, что изомерия обусловлена различным химическим строением, т.е. различием в порядке соединения атомов в молекулах при одном и том же составе и молекулярном весе веществ. Для каждого из трех простейших углеводородов (метана, этана и пропана) возможно по одной структурной формуле: H H H H H H ï ï ï ï ï ï H¾C¾H; H¾C¾C¾H; H¾C¾C¾C¾H. ï ï ï ï ï ï H H H H H H В молекуле пропана четвертый углеродный атом может быть присоединен либо к одному из двух крайних углеродных атомов, либо к среднему. Цепь из четырех атомов углерода, как видим, дает начало двум изомерным молекулам состава C4H10 с различными углеродными скелетами: H H H H H H H ï ï ï ï ï ï ï H¾C¾C¾C¾C¾H (1), H¾C¾¾C¾¾C¾H (2) ï ï ï ï ï ï ï H H H H H H¾C¾H H ï H изображаемым сокращенно: CH3—CH2—CH2—CH3 (1), CH3—CH—CH3 (2). ï CH3 Первый изомер углеводорода бутана C4H10 имеет прямую (нормальную) цепь. Второй изомер – изобутан – разветвленную цепь атомов углерода. Для углеводорода пентана C5H12 различия в последовательности связи углеводородных атомов приводят к образованию трех изомеров: нормальный пентан изопентан СН3—СН2—СН2—СН2—СН3 СН3—СН—СН2—СН3 СН3 ½ ½ СН3 тетраметилметан СН3—С—СН3 ½ СН3 С увеличением числа атомов углерода в молекуле резко возрастает число изомеров. Известны все 9 структурных изомерных гептанов C7H16, предсказанных теорией химического строения. Для углеводородов C10H22 возможно 75 структурных изомеров, для C11H24 159 изомеров, для C12H26 802 изомера, для C14H30 1858 изомеров, для – C20H42 366319 изомеров. Явление изомерии – одна из важнейших причин существования большого числа органических соединений. Свойства органических соединений зависят от присутствия – функциональных групп (—ОН у спиртов; >С=О у альдегидов и кетонов; —СООН у карбоновых кислот; —NH2 у аминосоединений; F, Cl, Br, J у галогенпроизводных и так далее). Функциональные группы обуславливают важнейшие свойства и прежде всего химическое поведение молекул. Изучение спектров молекул показало, что функциональные группы имеют характеристические частоты, мало отличающиеся для отдельных представителей каждого класса органических соединений. Изомерия характерна не только для линейных, но и для циклических молекул: СН3
СН2 СН2—СН2 Структурная изомерия может иметь место и при одинаковом углеродном скелете, если функциональные группы занимают различное положение в молекуле. Порядок связи атомов в молекуле пропана выражается одной структурной формулой: CH3—CH2—CH3. Замещение одного из атомов водорода пропана гидроксильной группой приводит к получению двух изомерных спиртов: CH3—CH2—CH2OH (1) CH3—CHOH—CH3 (2) пропиловый спирт изопропиловый спирт Эти структурные изомеры отличаются положением в молекуле функциональной гидроксильной группы, характерной для класса спиртов. Взаимное влияние атомов Химическое поведение – реакционная способность одного и того же атома, изменяющаяся в различных молекулах под влиянием непосредственно связанных с ним атомов, а также под влиянием отдаленных атомов и атомных групп.
Влияние атомов кремния и углерода в молекулах тетрахлоридов- кремния SiCl4 и углерода CCl4 проявляется в различном химическом поведении в этих соединениях атомов хлора. Так, при действии воды в молекуле SiCl4 атомы хлора очень легко замещаются на гидроксильные группы, тогда как в молекуле ССl4 обмена атомов хлора на гидроксильные группы не происходит. Атом каждого элемента влияет определенным образом на химическое поведение других атомов, составляющих молекулу, и вместе с тем, сам подвергается влиянию всей молекулы в целом. Теория химического строения не только раскрыла единство части и целого в молекуле и в химическом взаимодействии непосредственно связанных друг с другом атомов, но и указала на существование в молекулах химического влияния атомов, непосредственно не связанных друг с другом. Например, в молекулах хлорэтана (хлористого этила) CH3—CH2—Cl и хлорэтилена (хлористого винила) CH2=CH—Cl различное влияние на атом хлора этильной (CH3—CH2—) и винильной (CH2=CH—) групп обуславливает и различную его реакционную способность. Если в хлорэтане атом хлора весьма подвижен и обладает высокой реакционной способностью, то в молекуле хлорэтилена атом хлора инертен. Структурные формулы выявляют главные, непосредственные связи и сильные химические взаимодействия атомов в молекуле, характеризуя основные особенности ее химического строения и реакционной способности.
Таутомерия Бутлеров рассматривал химическую связь как особый вид движения атомов. Он полагал, что молекулы находятся в постоянном движении и превращении, подвергаясь многообразным внутренним перестройкам. В свете теории Бутлерова представления об устойчивости и неустойчивости изомерных форм молекул являлся чисто формальным, т.к. в некоторых случаях изомерные молекулы настолько легко переходят друг в друга, что оба изомера находятся в состоянии подвижного равновесия СН3—С—СН2—СООС2Н5 <=> СН3—С=СН—СООС2Н5, ½½ ½ О ОН кетонная форма енольная форма ацетоуксусный эфир а в других, наоборот, равновесие между изомерами сильно или почти полностью сдвинуто в сторону одного из них
СH ¾¾¾¾® СBr ½ ½ СН2Br СН3. Взаимные превращения изомеров могут осуществляться без какого-либо внешнего воздействия, и, наоборот, иногда требуются интенсивные внешние воздействия (катализаторы) для того, чтобы вызвать обратимые переходы изомеров друг в друга. Распространенное в органической химии явление, заключающееся в существовании двух или нескольких изомерных форм молекул, находящихся в состоянии динамического равновесия, называется таутомерией. В настоящее время установлено, что между явлениями изомерии и таутомерии нет резкой границы. Исследования показали, что при одних внешних воздействиях вещества могут быть вполне устойчивыми изомерами, тогда как при других – таутомерами. Поляризация связей Когда ковалентной связью соединяются одинаковые атомы, обобщенная электронная пара в равной степени принадлежит им обоим. Иначе обстоит дело, если ковалентной связью соединены атомы различных элементов,
Рис. 8 Энантиомеры молочной кислоты.
обладающие различной электроотрицательностью (ЭО) (т.е. способностью притягивать обобщенные электроны, образующие ковалентную связь). В этом случае обобщенная электронная пара оказывается в той или иной мере смещенной (оттянутой) сторону более ЭО- атома. В результате у этого атома возникает некоторый (избыточный или частичный) отрицательный заряд, а у атома, от которого электронная пара оттянута, - равный по величине положительный заряд. Связь между такими атомами является поляризованной связью. Так, например, в молекуле хлора обобщенная электронная пара в одинаковой мере принадлежит обоим атомам, в молекуле же органического вещества – хлористого метила CH3Cl пара электронов, осуществляющая связь между хлором и углеродом, смещена в сторону несколько более электроотрицательного хлора (и условно может быть изображена d+ и d-): Cl: Cl H3Cd+: Cld- H3Cd+ ® Cld- I II III У хлора возникает некоторый отрицательный заряд, у углерода – положительный, ковалентная связь между этими атомами в хлористом метиле поляризована. Как показано в формуле II, частичные заряды атомов, соединенных поляризованной связью, принято обозначать греческой буквой d (дельта) со знаком плюс и знаком минус соответственно. Смещение электронной пары в поляризованной простой ковалентной связи обычно обозначают стрелкой на середине черточки, выражающей эту связь, как представлено в формуле III. Чем более поляризована связь, т.е. чем больше осуществляющая ее пара смещена к одному из атомов, тем больше эта связь по своему характеру приближается к ионной связи и тем выше реакционная способность соединенных такой связью атомов. Степень поляризации связи между двумя атомами, а следовательно, и ее прочность, зависят от влияния других соединенных с ними атомов или атомных групп. В частности, связь С—С между двумя формально одинаковыми углеродными атомами, может быть поляризованной, если каждый из них в свою очередь соединен с различными атомами или группами. Особенно склонны к поляризации двойные и тройные связи. В молекулах с двойными связями p-электроны, образующие p-связь, смещены в направлении более электроотрицательного атома:
R2C=O, R2C=CH2, R3C—N=O.
Изогнутая стрелка указывает направление смещения p-связей. Взаимодействие электронов p-связей с электронами остальных участков ненасыщенной молекулы вызывает ее электрическую асимметрию. В молекулах соединений с кратными связями p-связи значительно легче поляризуются, чем s-связи. В результате поляризации атомы, связанные двойной связью, приобретают частичные (неполные) электрические заряды:
R2Cd+=Od- R2Cd+=CH2d- R3C—Nd+=Od-
Молекулы, содержащие две или несколько чередующихся двойных связей, разделенных s-связью, называются сопряженными системами:
>C=C—C=C< >C=C—C=O>C=C—N=O ú ú ú ú ú
В сопряженных системах электроны p-связей находятся в поле всех углеродных ядер и поэтому изменение распределения электронов в одной части молекулы вызывает перегруппировки электронов во всех других ее частях, как в едином целом.. Такой тип взаимодействия атомов называют сопряжением связей. Органические молекулы с достаточно хорошо развитой системой сопряженных связей проявляют полупроводниковые свойства. Лекция 1. Основные теоретические положения органической химии.
Учебные вопросы: 1. Общие представления, область применения; 2. Теория химического строения, взаимное влияние атомов, электронное строение органических соединений; 3. Изомерия органических соединений; 4. Поляризация химических связей, индукционный эффект и типы заместителей; 5. Классификация органических реакций.
Общие представления По способности атомов соединяться друг с другом в длинные цепи углерод занимает особое положение в периодической системе. Углерод может соединяться почти со всеми химическими элементами с образованием молекул цепной и циклической (кольчатой) структуры самых различных размеров. В состав цепей и циклов молекул органических соединений, кроме атомов С, могут входить Н, О, S, N, P, As, Si, Ge, Sn, Pb, B, Ti и другие элементы. Органическая химия – это химия соединений углерода, атомы которого связаны с атомами других элементов ковалентными, преимущественно мало поляризованными связями. Органические соединения, или соединения углерода, отличаются от неорганических многочисленностью и многообразием превращений. Если неорганических соединений насчитывается порядка 200 тысяч, то органических соединений известно свыше 2 миллионов. Законы химии управляют поведением как неорганических, так и органических веществ. Однако органические соединения имеют ряд отличительных особенностей. Так, большинство неорганических соединений – тугоплавкие вещества, а для органических соединений характерно состояние газов, жидкостей и низкоплавких твердых тел; большинство неорганических соединений не горючи, органические легче окисляются и горят, чем неорганические. К низкомолекулярным относят органические соединения с длиной цепи от 2 до 50 углеродных атомов, к высокомолекулярным – с длиной цепи порядка 200-200000 углеродных атомов и молекулярным весом порядка 104-106 у.е. Органические соединения при длине цепи порядка 200 атомов углерода обладают уже смолоподобными и каучукоподобными свойствами. Если цепи атомов кислорода, азота, фосфора, серы, бора и других элементов мало устойчивы, то длинные цепи атомов углерода в силу большой энергии С-С - связи (339 КДж) - весьма устойчивы.
Области применения Высокомолекулярные органические соединения: синтетические смолы и органическое стекло; пластические массы (пластмассы) и синтетические волокна; синтетический каучук. Лекарственные вещества. Красящие вещества (красители). Гербициды (вещества, уничтожающие сорняки). Инсектициды и фунгициды (вещества, уничтожающие, соответственно насекомых и грибы). Дефолианты (вещества, ускоряющие опадение листьев; применение их укоряет созревание хлопчатника и облегчает машинную уборку). Десиканты (соединения, способствующие высушиванию растений на корню). Витамины (сложные физиологически активные органические вещества, отсутствие которых в пище человека или животных ведет к нарушению нормальных функций организма). Ферменты (сложные органические соединения, являющиеся биологическими катализаторами, вызывающими процессы брожения, расщепления жиров, белков и т.п.) Консерванты (органические вещества, предохраняющие от закисания и порчи вина, соки, варенья, маринады и другие пищевые продукты). Органическая химия достигла огромных успехов в изучении состава и переработке каменного угля, нефти и природного газа; таким образом, она тесно связана с угольной, нефтяной и газовой отраслями промышленности, обеспечивающими с одной стороны, получение различных видов топлива, с другой – сырьем различные производства. Так, каменный уголь используют не только как топливо, путем переработки из него добывают необходимый для металлургии кокс, а так же светильный газ и каменноугольный деготь. Последний, свою очередь служит источником для получения многочисленных органических соединений, необходимых для синтеза ВМС, красителей, лекарственных и взрывчатых веществ и т.п. Из нефти путем её перегонки получают различные виды горючего, смазочные материалы и другие ценные продукты. Природный газ, особенно попутный нефтяной газ, также представляет собой ценное химическое сырье и топливо, используемое как в промышленности, так и в быту.
Теория химического строения Создана в 1858-1861 г.г. в русским химиком А. М. Бутлеровым. Основные положения теории химического строения: 1. Молекулы веществ - представляют собой реально существующие материальные частицы, обладающие определенным химическим строением. Т.е. атомы, образующие их, соединяются друг с другом в определенной, характерной для каждого вещества последовательности и взаимно влияют друг на друга. 2. Строение молекул вещества познаваемо и может быть установлено путем изучения свойств вещества, продуктов его превращений, а также путем его разложения и синтеза. 3. Свойства вещества определяются его качественным и количественным составом и химическим строением его молекул. Вещества, имеющие одинаковые состав и молекулярный вес, но различное строение, отличаются по своим свойствам; в этом заключается явление изомерии. 4. Взаимное влияние атомов, образующих молекулу, определяет реакционную способность каждого из них; химический характер одних и тех же атомов в различных молекулах зависит от того, с какими атомами они связаны в данной молекуле. 5. Углерод в органических соединениях, как правило, четырехвалентен; атомы его способны соединяться не только с другими атомами, но и друг с другом, образуя цепи; последние могут замыкаться с образованием циклов. Это свойство углерода и явление изомерии и обуславливают многообразие органических веществ. В развитии и обосновании теории химического строения большую роль сыграли русские химики – ученики и последователи А.М. Бутлерова: В.В. Марковников, А.М. Зайцев, Е.Е. Вагнер, Н.Д. Зелинский, М.И. Коновалов, А.Е. Фаворский и др.
|
|||||||
|
Последнее изменение этой страницы: 2017-02-22; просмотров: 195; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.133.214 (0.009 с.) |

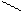
 Циклогексан СН2 метилциклопентан ½
Циклогексан СН2 метилциклопентан ½


 СН2 СН2 СН
СН2 СН2 СН
 СН2 СН2
СН2 СН2
 СН2 СН2
СН2 СН2 
 Так, например, атом водорода в соединении с хлором, кислородом и азотом (H—Cl, H—O—H, N—) проявляет различные свойства. Водород соляной кислоты сильно поляризован (протонирован) и легко замещается металлами, водород воды менее сильно поляризован и поэтому замещается только активными металлами и, наконец, водород аммиака очень слабо протонирован и может быть замещен лишь самыми активными металлами. Различное влияние атомов Cl, O и N на процесс протонизации – причина различной активности атомов водорода в этих молекулах.
Так, например, атом водорода в соединении с хлором, кислородом и азотом (H—Cl, H—O—H, N—) проявляет различные свойства. Водород соляной кислоты сильно поляризован (протонирован) и легко замещается металлами, водород воды менее сильно поляризован и поэтому замещается только активными металлами и, наконец, водород аммиака очень слабо протонирован и может быть замещен лишь самыми активными металлами. Различное влияние атомов Cl, O и N на процесс протонизации – причина различной активности атомов водорода в этих молекулах.
 СН3 СН3
СН3 СН3