
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Побочная подгруппа II группы.Содержание книги Поиск на нашем сайте
I. Качественные реакции на катион серебра: 1. С соляной кислотой и ее солями выпадает белый осадок хлорида серебра, растворимый в гидроксиде аммония:
AgNO3 + HCl à AgCl ↓ + HNO3 белый
AgCl + 2 NH4OH à [Ag(NH3)2]Cl + 2 H2O диамминсеребра (+1) хлорид
Хлорид серебра легко разлагается на свету и темнеет: свет 2AgCl à 2 Ag ↓ + Cl2
2. Реакция «серебряного зеркала» основана на окислительных свойствах оксида серебра, который получается при действии на соли серебра избытка гидроксида аммония:
2AgNO3 + 2NH 4OH = Ag2O ↓+ 2NH 4NO3 + H2O
оксид серебра растворяется в избытке реактива: Ag2O + 4NH4OH = 2[Ag(NH3)2]OH + 3H2O реактив Толленса или диамминсеребра (+1) гидроксид
Этот раствор реактива Толленса нагревают с раствором альдегида и на стенках пробирки образуется блестящий налет – «серебряное зеркало»:
H ONH4 мурав. альдегид формиат аммония
3. Реакция с тиосульфатом натрия (см. качественные реакции на тиосульфат-анион):
Na2S2O3 + 2 AgNO3 à 2 NaNO3 + Ag2S2O3↓ тиосульфат серебра (белый)
Ag2S2O3 + H2O à Ag2S ↓ + H2SO4 сульфид серебра (черный)
4. Экспресс-метод – реакцией с амидопириновой бумажкой: при нанесении капли раствора соли на амидопириновую бумажку появляется сначала фиолетовое пятно за счет окисления амидопирина, которое затем чернеет, так как образуется свободное серебро. Реакция основана на окислительных свойствах серебра:
Ag+ + 1 e à Ag0 восстановление, окислитель
II. Качественные реакции на катион меди (+2): Катион Сu2+ способен к комплексообразованию: а) CuSO4 + 4 NH4OH à [Cu(NH3)4] SO4 + 4H2O ярко-синий р-р тетраамминмеди (+2) сульфата б) Сu(OH)2 + 4 NH4OH à [Cu(NH3)4] (OH)2 + 4H2 р-р темно-синего цвета тетраамминмеди (+2) гидроксида в)Сu(OH)2 + NaOH à Na2[Cu(OH)4] cине-фиолетовый р-р натрия тетрагидроксокупрата (+2) III. Качественные реакции на катион цинка: 1. С сульфидам натрия образует белый осадок сульфида цинка: ZnSO4 + Na2S à ZnS ↓ + Na2SO4 сульфид цинка (белый) 2.С гексацианоферратом (II) калия – выпадает белый студенистый осадок гексацианоферрата (II) калия цинка ( дикалия трицинка – уточнение для запоминания): 3ZnSO4 + 2K4[Fe(CN)6] à K2Zn3[Fe(CN)6]2↓ + 3 K2SO4 белый IV. Качественные реакции на катион ртути (+2): 1. При действии на соли ртути гидроксида натрия образуется желтый осадок оксида ртути (+2):
Hg(NO3)2 + 2 NaOH à HgO + 2 NaNO3 + H2O
2. При действии иодида калия на соли ртути выпадает ярко-красный осадок йодида ртути (+2), растворимый в избытке реактива с образованием бесцветного комплексного соединения тетрайодомеркуриата (+2) калия:
HgCl2 + 2 KI à HgI2 ↓ + 2 KCl Красный
HgI2 + 2 KI à K2 [HgI4] бесцв. раствор.тетрайодомеркуриата (+2) калия
3.Под действием соляной кислоты и гидроксида аммония выпадает белый осадок амидохлорида ртути:
Hg(NO3)2 + 2 HСl à HgCl2 + 2HNO3
HgCl2 + 2 NH 4OH à HgNH2Cl ↓ + NH4Cl + H2O белый Тема календарно-тематического плана 2.3. d-Элементы.
|
|||||
|
Последнее изменение этой страницы: 2017-02-19; просмотров: 187; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.186.109 (0.008 с.) |

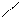




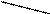

 H C + 2[Ag(NH3)2]OH à H C + 2Ag ↓ + H2O + 3 NH3↑
H C + 2[Ag(NH3)2]OH à H C + 2Ag ↓ + H2O + 3 NH3↑


