Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Главная подгруппа III группы.
I. Качественные реакции на борат-ион (BO33-) и на тетраборат-анион (B4O72-): Тетрабораты переводят в борную кислоту действием на них сильных минеральных кислот, а далее: 1) горение борноэтилового эфира: Борную кислоту растворяют в спирте и поджигают. Полученный эфир горит зеленым пламенем:
OH HO—C2H5 -3H2O O—C2H5 борноэтиловый эфир 2) Реакция с куркумовой бумажкой. Куркумовую бумажку (желтого цвета) смачивают раствором соляной кислоты и борной кислоты и высушивают. Бумажка окрашивается в розовый цвет. Затем на нее наносят каплю раствора NH4OH (гидроксида аммония) – бумажка окрашивается в грязно-зеленый цвет. II. Качественная реакция на катион алюминия: При изучении неорганической химии пользуемся только химическим свойством гидроксида алюминия – амфотерностью:
- проводим реакцию с недостатком щелочи (прибавление по каплям): Аl2(SO4)3 + 6 NaOH à 2 Al(OH)3↓ + 3Na2SO4 белый студенистый осадок
- делим суспензию на две пробирки а) добавляем в одну из них кислоту: Al(OH)3 + 3HCl à AlCl3 + 3 H2O (осадок растворился) б) добавляем во вторую пробирку избыток щелочи Al(OH)3 + NaOH à NaAlO2 + 2 H2O(осадок растворился) cоль метаалюминиевой к-ты - метаалюминат натрия Гидроксид алюминия можно рассматривать как основание и как кислоту:
↨ H+ +AlO2- + H2O oртоалюминиевая кислота метаалюминиевая кислота ▪ Реакцию б) можно представить в виде:
Al(OH)3 + NaOH à Na[Al(OН)4] (образуется комплексное соединение тетрагидроксоалюминат +3 натрия)
Тема календарно-тематического плана 2.2 s-элементы Главная подгруппа II группы I. Качественная реакция на катион магния: с гидрофосфатом натрия в среде аммиачного буфера образуется белый мелкокристаллический осадок фосфата магния аммония, растворимый в минеральных кислотах (смотри качественные реакции на фосфат-анион): NH4Cl Na2HPO4 + MgSO4 + NH4OH → MgNH4PO4 ↓ + Na2SO4 + H2O белый
II. Качественные реакции на катион кальция: 1. С оксалатом аммония образуется белый кристаллический осадок оксалата кальция, растворимый в минеральных кислотах: CaCl2 + (NH4)2 C2O4 →CaC2O4 ↓ + 2 NH4Cl белый 2. Сухим путем: растворимые соли кальция окрашивают пламя горелки в кирпично - красный цвет.
III. Качественные реакции на катион бария: 1. BaCl2 + H2SO4 →BaSO4 ↓ + 2 HCl белый С серной кислотой и ее солями образует нерастворимый в воде, щелочах и кислотах мелкокристаллический осадок сульфата бария белого цвета, мелкокристаллический. 2. С хроматом калия образует желтый кристаллический осадок хромата бария, растворимый в соляной и азотной кислотах и нерастворимый в уксусной кислоте. BaCl2 + K 2CrO4 → BaCrO4 ↓ + 2 KCl желтый 3. Сухим путем: окрашивает пламя горелки в желто-зеленый цвет.
Тема календарно-тематического плана 2.2 s-элементы Главная подгруппа I группы
I. Качественные реакции на катион калия:
1. Сухим путем: окрашивает бесцветное пламя горелки в фиолетовый Цвет. 2.С винно-каменной кислотой, в присутствии этанола и ацетата натрия, образуется белый мелкокристаллический осадок гидротартрата калия, растворимый в щелочах (б) и минеральных кислотах (в):
KCl + H2C4H4O6 à KHC4H4O6 ↓ + HCl (а) гидротартрат калия KHC4H4O6 ↓ + NaOH à KNaC4H4O6 + H2O (б) гидротартрат калия, натрия (сегнетова соль) KHC4H4O6 ↓ + HCl à KCl + H2C4H4O6 (в)
HCl + CH3COONa à CH3COOH + NaCl (г) ацетет натрия Чтобы реакция (а) не пошла обратно и осадок выпал необходимо связать катионы водорода (Н+) в слабый электролит, например ацетатом натрия в слабую органическую уксусную кислоту (г). Этиловый спирт используется как осадитель, так как в нем гидротартрат калия растворяется хуже, чем в воде.
3. C гексанитрокобальтатом (Ш) натрия – образуется желтый осадок калия натрия гексанитирокобальтат (Ш):
KCl + Na3[Co(NO2)6] à K2Na[Co(NO2)6] ↓ + 2 NaCl желтый
II. Качественные реакции на катион натрия:
1. Сухим путем: соли натрия окрашивают пламя горелки в желтый цвет. 2.С цинкуранилацетатом в уксуснокислой среде. Образуется желтый кристаллический осадок натрий - цинкуранилацетата: NaCl +Zn(UO2)3(CH3COO)8 +CH3COOH + 9H2Oà NaZn(UO2 (CH3COO)9 ∙ 9 H2O↓ + HCl
NO2 NO2 пикриновая кислота пикрат натрия (желтый)↓ 4. С гексагидроксостибиатом (+5) калия образуется белый кристаллический осадок гексагидроксостибиат (+5) натрия. Реакцию проводят в нейтральном или слабо-щелочном растворе (кислоты разлагают реагент, а щелочи растворяют осадок): NaCl + K[Sb(OH)6] à K[Sb(OH)6] ↓ + КCl белый
Тема календарно-тематического плана 2.3. d-Элементы.
|
|||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-19; просмотров: 189; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.19.31.73 (0.011 с.) |

 OH HO—C2H5 O—C2H5
OH HO—C2H5 O—C2H5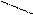


 B OH + HO—C2H5 à B O—C2H5
B OH + HO—C2H5 à B O—C2H5
 Al3+ +3OH- ßà Al(OH)3 == H3AlO3 ßà HAlO2 +H2O
Al3+ +3OH- ßà Al(OH)3 == H3AlO3 ßà HAlO2 +H2O

 3.Микрокристаллоскопическая реакция: с пикриновой кислотой: образуются желтые кристаллы пикрата натрия, характерной формы - игольчатые, выходящие из одной точки (из пучка):
3.Микрокристаллоскопическая реакция: с пикриновой кислотой: образуются желтые кристаллы пикрата натрия, характерной формы - игольчатые, выходящие из одной точки (из пучка):
 OH ONa
OH ONa







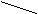


 O2N NO2 O2N NO2
O2N NO2 O2N NO2