
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Інтегральний метод встановлення порядку реакцій ⇐ ПредыдущаяСтр 8 из 8
Розв’язання зворотних задач кінетики розглянемо на прикладі встановлення формального порядку реакцій і розрахунків констант швидкості. На практиці задача ставиться таким чином: за наявними даними із залежності ступеню перетворення або концентрації від часу визначити порядок реакції і константи швидкості. Коли концентрації усіх реагентів одинакові, це зводиться до оцінки параметрів k та n диференціального рівняння (14.35):
У прикладі 14.3 було розглянуто лдержання порядку реакції на основі диференуціювання кінетичних кривих з подальшим знаходженням степеневого рівняння швидкості (у логарифмічній формі). Такий метод носить назву диференціального методу або методу Вант-Гоффа). Його недоліком є необхідність проведення чисельного диференціювання експериментальних даних. Ця процедура, як відомо, може мати значну й непередбачену обчислювальну погрішність. З використанням комп’ютерів цю задачу доцільно розв’язувати інтегральним методом, що не вимагає процедури диференціювання. Проінтегруємо рівняння (14.35) для n ¹ 1 при початкової умові: С(0) = С0:
Для n = 1 інтегрування (14.35) приводить до рівняння:
Для подальшого рішення можна виразити С через відомі величини С0 і t і невідомі параметри n і k і знайти оцінку параметрів методом найменших квадратів за критерієм суми квадратів відхилень між експериментальними і розрахованими значеннями k. Але при цьому виникає проблема, що для різних ділянок необхідно використовувати два рівняння (одне – з (14.36), інше – з (14.37)). Задачу можна спростити, якщо обирати значення n і розраховувати для цих величин серію констант швидкості у кожній з m експериментальних точок за рівняннями (14.36) і (14.37) і для кожного з наборів розраховувати середнє значення константи:
Виходячи з цього, можна сформулювати оптимізаційну задачу: знайти таке значення n, при яких функціонал (14.39) буде приймати мінімальне значення.
Такий вид функціоналу обумовлений тим, що для різних порядків константи швидкості мають різні розмірності, і якщо обирати за функціонал просту суму квадратів різниць констант і середньої константи, то одержані величини для різних n не можна порівняти одне з іншим. Ділення на середнє значення приводить до безрозмірного функціоналу. Це дає можливість обирати оптимальну величину n.
На практиці формальний порядок може мінятися в максимальних межах від -4 до 4 (із запасом), достатня точність визначення порідку: 0,05. Це надає можливості розраховувати функціонал при 0,99 < n < 1,01 за рівнянням (14.36), а у противному випадку – за рівнянням (14.37), користуючись стратегією одного з методів одновимірної оптимізації, наприклад параболічного пошуку. При використанні Excel для виконання розрахунків можна використовувати надбудову «Поиск решения», але в рамках цій програми неможливо проводити розрахунки за двома рівняннями. На практиці можна на першому етапі перевірити наявність першого порядку. Для цього приводимо рівняння (14.37) до виду:
lnC = lnC0 – kt. (14.40)
З (14.40) випливає, що в разі наявності першого порядку повинна спостерігатися лінійна залежність між логарифмом концентрації і часом. Якщо експериментальні точки добре групуються навколо прямої – можна вважати, що реакція підпорядковується першому порядку і подальші розрахунки не мають сенсу. У противному випадку треба проводити розрахунок порядку. Розглянутий метод можна використовувати, як «скорочений» метод розрахунку порядку і константи швидкості. Але слабким місцем методу є те, що відбвауться порівняння між собою величин, що одержані шляхом розрахунків. Більш природнім є розробка такого методу, у якому розрахункова величина порівнюється з такою, що визначається в експерименті, наприклад з концентрацією. У цьому випадку можна використати наступний варіант інтегрального методу. З рівняння (14.36) виразимо концентрацію:
Тоді для розрахунків порядку реакції та константи швидкості можна використати метод найменших квадратів і побудувати наступний функціонал для мінімізації:
При этом, в качестве начального приближения можно использовать значения порядка и константы скорости, полученные по алгоритму (14.39) Приклад 14.4 Розрахувати порядок реакції взаємодії лауринової кислоти і лаурилового спирту користуючись даними залежності ступеню перетворення від часу (табл. 14.2).
Розв’язання На першому етапі перевіряємо, чі можна описати експериментальну залежність кінетичним рівнянням 1-го порядку. Дл цього за експериментальними даними будуємо залежність логарифма залишкової концентрації реагенту від часу.
Таблиця 14.2 - Залежність від часу ступеню перетворення (р, %) в реакції 0,2 кмоль/м лауринової кислоти з 0,2 кмоль/м3 лаурилового спирту у середовищі лауриллаурату при 195оС
Оскільки задано ступінь перетворення у %, шукану концентрацію розраховуємо за формулою:
З рис. 14.5 випливає, що залежність логарифму концентрації від часу не є лінійною. Це вказує, що порядок реакції, шо вивчена, відрізняється від першого. На другому етапи будемо розвязувати основну задачу.
Рисунок 14.5 – Залежність логарифма концентрації лаурілового спирту й лаурілової кислоти від часу
На другому етапі укладаємо скрипт Scilab для розвязання задачі (14.39) (листінг 14.4.1) Листінг 14.4.1 //Вхідні дані t=[15 30 60 120 180 240 300 360 420 480 555 600 660 780 900 1080 1320 1620]; p=[6.2 8.5 18.5 33.1 40.7 44.7 49.7 53.6 57 59.7 61.6 62.9 64.6 66.9 69.2 71.6 74.1 76.6]; //Перерахунок у концентрації C0=0.2; x=C0*(100-p)/100; m=size(t,2) n0=2//Початкове наближення function k=rate_k(n)// розрахунок констант швидкості k=(1/x(i)^(n-1)-1/C0^(n-1))/(n-1)/t(i) endfunction function f=kser(n)// розрахунок функціоналу kk=zeros(m,1) for i=1:m kk(i)=rate_k(n) end kz=mean(kk) f=0 for i=1:m f=f+((kk(i)-kz)/kz)^2 end endfunction function [f,g,ind]=cost(n,ind)//функція цілі для оптимізації f=kser(n) g=numdiff(kser,n) endfunction //begin [fmin, nmin]=optim(cost,n0)//nmin – шуканий порядок k=zeros(m,1);//масив констант for i=1:m k(i)=rate_k(nmin); end ks=mean(k)// середнє значення dk=st_deviation(k)//стандартне відхилення [t',k]//друк результатів
Результати розрахунків наведені у протоколі 14.4.1
Протокол 14.4.1 nmin = 2.7509262 fmin = 0.1115690 ks = 0.0731172 dk = 0.0059233 ans = 15. 0.0756018 30. 0.0536415 60. 0.0686478 120. 0.0813989 180. 0.0795126 240. 0.0725735 300. 0.0742913 360. 0.0753378 420. 0.0770242 480. 0.0778956 555. 0.0748340 600. 0.0745147 660. 0.0747790 780. 0.0727029 900. 0.0729052 1080. 0.0713786 1320. 0.0698942 1620. 0.0691761
Як випливає з наведених даних, порядок реакції є близьким до 2,8, а константа швидкості 0 до 0,073. Одержані результати використовуємо за початкове наближення до розвязання задачі (14.42) Для цього створили скрипт (листінг 14.4.2) Листінг 14.4.2 t=[0 15 30 60 120 180 240 300 360 420 480 555 600 660 780 900 1080 1320 1620]; p=[0 6.2 8.5 18.5 33.1 40.7 44.7 49.7 53.6 57 59.7 61.6 62.9 64.6 66.9 69.2 71.6 74.1 76.6]; C0=0.2; x=C0*(100-p)/100; m=size(t,2) z0=[2.8,0.073] function y=fi(z)//одиничний розрахунок n=z(1) k=z(2) y=C0/(k*t(i)*(n-1)*C0^(n-1)+1)^(1/(n-1)) endfunction function f=sumkw(z)//сума квадратів f=0 for i=1:m f=f+(fi(z)-x(i))^2 end endfunction function [ff,gg,ind]=cost(z,ind) ff=sumkw(z) gg=numdiff(sumkw,z) endfunction [fmin,zmin]=optim(cost,z0) for i=1:m y(i)=fi(zmin); end
В результате расчетов получили: n = 2,79»2,80, k = 0,081, сума квадратів відхилень: 0.0000681. Подібним чином можна розраховувати порядок реакції і набор констан швидкості, наприклад, в разі розрахунків енергії активації і логарифму передекспоненти. Наприклад, якщо наявні експериментальні дані з r серій експериментів по m(і) експериментів у кожній серії (і = 1,2,…,r), те функціонал для мінімізації буде мати вигляд:
Це дозволяє розрахувати набір констант того ж самого порядку при різних температурах і далі, користуючись МНК, розрахувати енергію активації, як це описано у прикладі (14.3)
Контрольні запитання 1 Чим розрізняються поняття фізичної та хімічної кінетики? 2 Зміст понять макро- й мікрорівнів розгляду процесів. Для чого потрібні такі поняття? 3 Зміст поняття швидкість хімічної реакції 4 Що таке кінетична крива? Який вигляд мають кінетичні криві для вхідних, кінцевих й проміжних продуктів? 5 Рівняння швидкості реакції. Які головні фактори впливають на швидкість? 6 Які особливості має вплив концентрації реагентів в гетерогенних реакціях? 7 Типи складних реакцій 8 Чим характеризуються оборотні реакції? Який критерій для них існує? 9 Чим характеризуються послідовні реакції? Що називається стадією хімічної реакції? 10 Як дізнатися, чи є речовина проміжним продуктом реакції? 11 У чому полягають особливості паралельних реакцій? 12 У чому полягає зміст поняття механізму реакції? 13 Зміст закону діючих мас у кінетиці. 14 У яких одиницях вимірюється швидкість реакції? 15 Яку розмірність має константа швидкості k-го порядку? 16 Чи обов’язково порядок реакції є цілим числом? 17 Як впливає температура на швидкість хімічних реакцій? 18 Записати рівняння Ареніуса. Як його привести до лінійного виду? 19 Фізичний зміст поняття енергії активації 20 Загальний механізм каталітичних реакцій. Чи впливає каталізатор на ентальпію реакції? 21 Зміст прямої ті зворотної задач кінетики 22 Алгоритм побудови кінетичних рівнянь складних реакцій, виходячи з механізму 23 Правила запису рівнянь швидкості елементарних реакцій 24 Яким чином, виходячи з системи рівнянь кінетики, побудувати кінетичні криві компонентів процесу? 25 У чому полягає сутність методу А.А.Баландіна? 26 Як можна записати стехіометричну матрицю системи реакцій? 27 Як укладається матриця концентрацій? 28 Як укладається матриця констант швидкості? 29 Алгоритм методу Баландіна 30 Як ставиться задача розрахунку порядку реакції з експериментальних даних? 31 Алгоритм встановлення порядку реакції інтегральним методом
Завдання для самостійної роботи Завдання 14.1. За схемою механізма реакцій, енаведених у таблиці варіантів (табл. 14.3), користуючись методом Баландіна, укласти кінетичні рівняння, При Користуючись програмою електронного Задачника (Завдання до лекції 14), генерувати кінетичні дані, розрахувати порядок реакції, константі швидкості, енергію активації
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-10; просмотров: 149; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.14.85.76 (0.039 с.) |
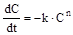 . (14.35)
. (14.35) . (14.36)
. (14.36) . (14.37)
. (14.37) . (14.38)
. (14.38) . (14.39)
. (14.39) (14.41)
(14.41)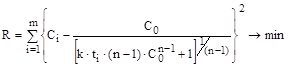 . (14.42)
. (14.42) (14.43
(14.43
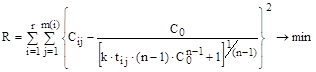 (14.44)
(14.44)


