
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Рівняння Клапейрона-Клаузіуса
Фазові переходи (ФП) відбуваються в системі при підведенні певної кількості теплоти. При описі ФП пов’язують між собою p, T, V і кількість підведеної (поглинутої) теплоти. Рівняння Клапейрона-Клаузіуса визначає нахил кривої фазової рівноваги р (Т). Воно пов’язує Для виведення формули, що зв’язує кількісно нахил кривої р (Т) фазової рівноваги з теплотою переходу та зміною об’єму при переході, припустимо, що з деякою кількістю речовини здійснюється “вузький” цикл Карно. Ізотермічними при цьому є процеси переходу речовини із фази 2 в фазу 1 при певному тиску р і зворотній перехід із фази 1 в фазу 2 при тиску p + dp. Тоді оскільки:
з одного боку
де dT - різниця температур на обох ізотермах. З іншого боку:
де Q 12 - теплота переходу із фази1 в фазу 2. Значить:
або
Звернемо увагу на те, що похідна 18.3 Поверхневий натяг. Формула Лапласа. Надплинність
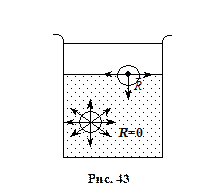
В рідинах молекули всередині розташовані таким чином, що рівнодійна всіх сил дорівнює нулю. На поверхні рідин ця рівнодійна відмінна від нуля (див. рис. 43). Для рідин характерним є те, що вони не мають своєї форми, а приймають форму посудини, в якій знаходяться, мають великий коефіцієнт поверхневого натягу та мало стискаються в порівнянні з газами.
Молекули на поверхні рідини мають енергію, яка перевищує енергію тих, що в об’ємі. Звідси поверхневий шар рідини має більшу потенціальну енергію молекул, ніж будь-який інший шар. Різниця між енергією всіх молекул поблизу поверхні тіла, і тою, що ці молекули мали б, якщо б знаходились в середині тіла, називається поверхневою енергією. Поверхнева енергія
При Сила, віднесена до одиниці довжини контуру, направлена перпендикулярно до цієї лінії, по дотичній до поверхні, називається коефіцієнтом поверхневого натягу a, [ a ]=Н/м=Дж/м2. Специфіка поверхневого шару: крім появи поверхневого натягу є викривлення поверхні внаслідок взаємодії молекул поверхні з молекулами стінок посудини, в якій знаходиться рідина.
Викривлення поверхні рідини приводить до появи додаткового тиску Dр, поскільки при цьому рідина прагне скоротитись. Вигнуті поверхні рідини, що змочують стінки посудини, називаються менісками. Якщо поверхня опукла, то Dр >0 і навпаки для вгнутої поверхні Dр <0.
формула Лапласа, де: a - коефіціент поверхневого натягу; R 1 та R 2 - радіуси кривизни поверхні в двох взаємноперпендикулярних перерізах, що проходять через цю поверхню. Для сферичної поверхні
Задача: Яку силу треба прикласти, щоб відірвати (без зсуву) одну від другої дві змочені фотопластинки розміром 9х12 см? Вважати, що змочування є повним, товщину водяного прошарку вважати рівною 50 мкм.
Розв’язок: Поверхня рідини, що змочує фотопластинки, має циліндричну форму із радіусом кривизни R = d /2, де d – відстань між пластинками (рис. 45). Додатковий тиск Dр, під циліндричною вгнутою поверхнею є від’ємним і рівним
Явище відсутності в’язкості в рідині називається надплинністю. Воно не пояснюється класичною фізикою. Спостерігається в рідкому гелії-2, який є так званою “квантовою рідиною”. Із надплинністю гелію-2 пов’язане його швидке перетікання з однієї посудини в іншу, коли посудини розділені перегородкою.
Дальній та ближній порядок
Кожний агрегатний стан характеризується своїм порядком в розташуванні атомів. Кристали відрізняються від інших тіл дальнім порядком в розташуванні атомів і анізотропією. При дальному порядку велика кількість атомів розташована впорядковано навколо будь-якого вибраного нами атома.
Дальній порядок означає, що кристал можна побудувати шляхом переміщення (трансляції) найменшої або елементарної одиниці, яка називається елементарною коміркою. Для рідкого стану характерним є ближній порядок розташування атомів. При цьому відносно невелика кількість атомів навколо будь-якого розташована впорядковано. Найважливішою властивістю рідини є також плинність. Для газів характерним є хаотичне розташування атомів. Існують рідини, які мають дальній порядок розташування атомів. До того ж молекули певним чином орієнтовані в таких рідинах. Тому такі рідини називаються рідкими кристалами. Для рідких кристалів характерною особливістю є також анізотропія властивостей до них відносяться деякі органічні сполуки, а також декілька тисяч неорганічних сполук. Застосовуються в електроніці, медицині, системах відтворення інформації.
|
||||||||||
|
Последнее изменение этой страницы: 2017-02-09; просмотров: 476; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.139.90.131 (0.013 с.) |
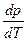 , кількість підведеної теплоти Q 12, температуру фазового переходу T і об’єм при рідкому V 2 і твердому V 1 агрегатних станах.
, кількість підведеної теплоти Q 12, температуру фазового переходу T і об’єм при рідкому V 2 і твердому V 1 агрегатних станах.
 ,
,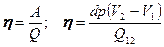 ,
, ,
, .
.
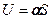 , де a - коефіцієнт поверхневого натягу. Він залежить від природи і стану рідини. По загальних правилах механіки похідна від поверхневої енергії по кординаті х вздовж напрямку дії сили є силою поверхневого натягу.
, де a - коефіцієнт поверхневого натягу. Він залежить від природи і стану рідини. По загальних правилах механіки похідна від поверхневої енергії по кординаті х вздовж напрямку дії сили є силою поверхневого натягу. .
. ,
,  , де l - довжина контуру.
, де l - довжина контуру.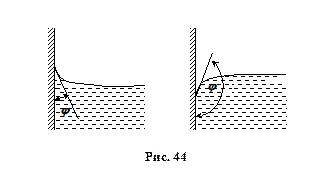
 -
- , тому
, тому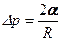 .
.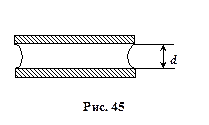
 . В нашому випадку, для циліндричної поверхні, R 1 =¥, R 2 = d /2,. Dр – надлишок зовнішнього тиску. Звідси сила, яку треба прикласти, щоб відірвати пластинки,
. В нашому випадку, для циліндричної поверхні, R 1 =¥, R 2 = d /2,. Dр – надлишок зовнішнього тиску. Звідси сила, яку треба прикласти, щоб відірвати пластинки, .
.


