
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Перший закон (начало) термодинаміки. Вічний двигун першого роду
Перший закон (начало) термодинаміки формулюється так:
Рівняння, що описують перший закон:
де dQ -елементарна кількість теплоти, dU -приріст внутрішньої енергії, dA -елементарна робота.
тобто dU -повний диференціал системи. Внутрішня енергія не залежить від шляху переходу системи із одного стану в інший. Перший закон термодинаміки стверджує, що не можна виконати більше роботи, ніж підведена теплота або енергія. По-іншому це означає, що не можливий вічний двигун першого роду, тобто двигун, який би виконував більшу роботу, ніж підведена до нього теплота (надана йому енергія).
Елементарна теорія теплоємності ідеального газу
Внутрішня енергія газу, масою m, дорівнює внутрішній енергії 1 кмоля, помноженій на кількість кіломолей, тому:
Із І-го закону термодинаміки після підстановок отримаємо зв’язок сp і cV
Для
Відношення
g - показник адіабати. Теплоємність при сталому тиску більша, ніж теплоємність при сталому об’ємі, тому що при нагріванні на один Кельвін при сталому тиску частина теплоти йде на виконання тілом роботи, а при сталому об’ємі вся теплота йде на збільшення внутрішньої енергії газу. Теплоємність є сталою величиною лише в певному інтервалі температур, тому що молекули газу мають крім кінетичної енергії поступального руху енергію обертового руху і енергію коливального руху, які приймають дискретний ряд значень. Енергія, пов’язана з цими видами руху, може змінюватись тільки скачками. Зрозуміло, що це впливає на температурну залежність теплоємності.
Робота при ізопроцесах
Процес - перехід системи із одного стану в інший. Він зображується графічно у вигляді залежності, наприклад, p (V) або р (Т). Залежності p (V), р (Т) - різні для різних процесів. Відповідно і робота для різних ізопроцесів в газах виражається різними формулами. Дійсно, в загальному випадку:
тому маємо: 1) Ізобарний процес:
2) Ізохорний процес:
3) Ізотермічний процес:
(вираз для p отримано із рівняння стану ідеального газу). Ще одна формула роботи при ізотермічному процесі:
4) Адіабатний процес:
(із означення адіабатного процесу та першого закону термодинаміки).
(для кінцевих значень приросту температури). Підсумки: 1) Теплоємність ідеального газу залежить від процесу, при якому вона визначається. 2) Передача теплоти тілу може здійснюватися шляхом виконання тілом роботи, або шляхом теплопередачі. 3) Робота залежить від характеру процесу, який при цьому виконується, від умов протікання процесу.
Розподіл молекул Максвела
Середня швидкість молекул є деякою усередненою характеристикою теплового руху цих частинок. В дійсності різні молекули рухаються із різними швидкостями. Кількість молекул, швидкості яких лежать в інтервалі [ J, J + DJ ] виражається формулою:
Звідси:
функція розподілу молекул по швидкостях в інтервалі [ J, J + DJ ]. На основі принципу еквівалентності всіх напрямків руху, розглядаючи рівноважний стан газу, Максвелл встановив, що:
де А = const (для даної температури і сорту молекул); J - швидкість молекул; m - маса молекул; k - стала Больцмана; T - абсолютна температура. Ця функція дорівнює відносній кількості молекул, що припадає на одиничний інтервал швидкостей при заданій швидкості.
Графік функції f (J) представлений на рис. 33. Характерними для розподілу молекул є:
Із формул випливає, що при збільшенні температури, або зменшенні мас молекул максимум кривої зміщується вправо, і стає нижчим, причому площа, що охоплюється кривою, залишається сталою. Підтвердженням правильності розподілу молекул по швидкостях були досліди Штерна (1920 р.) та Ламмерта (1929 р.). Для кімнатної температури типове значення середньої швидкості молекул ~ 400-600 м/с.
|
|||||||
|
Последнее изменение этой страницы: 2017-02-09; просмотров: 307; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.6.77 (0.048 с.) |
 Кількість теплоти, шо надана системі, йде на приріст внутрішньої енергії і виконання системою роботи над зовнішніми тілами.
Кількість теплоти, шо надана системі, йде на приріст внутрішньої енергії і виконання системою роботи над зовнішніми тілами.
 ,
,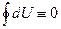 -
- .
. .
.
 *
*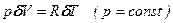




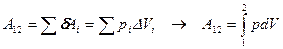
 .
. .
.



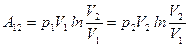 .
.
 ,
,
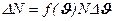 .
. -
- ,
,
 - найбільш ймовірна щвидкість;
- найбільш ймовірна щвидкість; або
або  - середня швидкість (середньоарифметична);
- середня швидкість (середньоарифметична); - середня квадратична швидкість (відповідає середній енергії молекул).
- середня квадратична швидкість (відповідає середній енергії молекул).


