
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ентропія та вільна енергія як однозначні функції стану системи
Ентропія S, як і внутрішня енергія U, вільна енергія F та ентальпія H є однозначними функціями стану системи. Це означає, що для 1) 2) 3) 4) Ентропія характеризує міру безпорядку в системі. Безпорядок в системі залежить від кількості частинок, що входять в систему і збільшується зі зростанням хаотичного руху. По принципу Больцмана
де k – стала Больцмана; w - термодинамічна ймовірність, яка визначає кількість мікроспособів, якими можна реалізувати даний макростан системи. Термодинамічна ймовірність (або по-іншому, статистична вага) є пропорційною звичайній ймовірності того, що система перебуває в даному макростані. Макростан тіла задають за допомогою макроскопічних параметрів, що характеризують тіло в цілому (тиск, об’єм, температура, внутрішня енергія і т.п.). Якщо стан макроскопічного тіла заданий так детально, що задані стани всіх молекул, які входять в його склад, то це – мікроскопічний стан. Чим більший ступінь безпорядку в координатах і швидкостях частинок системи, тим вище ймовірність того, що система буде знаходитись в стані безпорядку. У відповідності до поняття ймовірності система в стані з більшою йомвірністю буде перебувати частіше, чим із меншою. Значить, якщо система спочатку знаходилась у стані з меншою ймовірністю, то вона буде намагатися перейти в стан з більшою ймовірністю. На це і вказує зв’язок Із означення як функції стану термодинамічної системи зміна ентропії
де: dQ - елементарна кількість теплоти, що підводиться до системи при рівноважному оборотному процесі; T - температура системи.
Введення поняття ентропії дозволяє теоретично передбачити напрямок протікання процесу. Знаючи, як змінюється кількість підведеної теплоти і температура системи, можна, встановити чи є процес, що вивчається, оборотнім, чи є система замкненою, яка ефективність використання енергії, що підводиться до системи. Можна показати, що при збільшенні ентропії замкнутої системи, яка складається із тіл з різними температурами, збільшення dS супроводжується втратами механічної енергії в кількості, що дорівнює величині dS, помноженій на температуру найбільш холодного тіла. 1. Ентропія ізольованої системи при протіканні необоротного процеса зростає. (Поскільки ізольована система представлена сама собі, то вона переходить із менш ймовірного стану в більш ймовірний, а за означенням ентропії цьому відповідає її збільшення).
2. Ентропія системи в стані рівноваги є максимальною. 3. Ентропія будь-якого тіла прямує до нуля, коли температура прямує до нуля (теореми Нернста). Знайдемо зв’язок між ентропією, внутрішньою енергією, та вільною енергією. 1) 2) 3) 4) Поскільки 5) 6) Звідси 7) де F вільна енергія, яка визначає частину внутрішньої енергії, що може бути перетворена в роботу при ізотермічному процесі; TS - частина внутрішньої енергії U, яка розсіюється в системі. В цілому
Задача: Знайти зміну ентропії при перетворенні 10 г льоду, що має температуру -20°С, в пару при 100°С. Розв’язок: 1) Зміна ентропії
S 1, S 2 – відповідно ентропії першому та другому станах. Загальна зміна ентропії складається із зміни ентропії в окремих процесах. 1) Нагрівання льоду масою m від Т 1 до Т 2. При цьому
с 1 – питома теплоємність льоду. 2) Плавлення льоду при сталій температурі Т 2. Поскільки при цьому підведена сумарна теплота
l - питома теплота плавлення. 3) Нагрівання води від Т 2 до температури кипіння Т 3. Зміна ентропії
(аналогічно до формули (б)), с 2 – питома теплоємність води. 4) Випаровування води масою m при сталій температурі Т 3
(аналогічно до формули (в)), r – питома теплота пароутворення. Загальна зміна ентропії
Підставляючи, отримуємо DS =88 Дж/К.
|
|||||
|
Последнее изменение этой страницы: 2017-02-09; просмотров: 421; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.149.254.35 (0.01 с.) |
 ;
; ;
; ;
; .
.
 .
. ,
, .
. (перший закон термодинаміки);
(перший закон термодинаміки); ;
; (із попередініх співвідношень);
(із попередініх співвідношень); ; після підстановки, для (dT =0), тобто коли процес – ізотермічний;
; після підстановки, для (dT =0), тобто коли процес – ізотермічний; ;
; ;
; ;
; .
.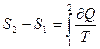 , (а)
, (а) , а по формулі (а)
, а по формулі (а) , (б)
, (б) , то згідно (а)
, то згідно (а) , (в)
, (в)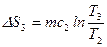

 .
.


