
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Диаграмма состояния железоуглеродистых сплавовСодержание книги
Поиск на нашем сайте
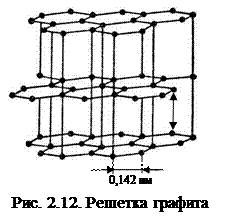
Компоненты и фазы. Железо – металл серебристо-белого цвета. Температура плавления – 1539 °С, плотность – 7,87 г/см3. Атомный радиус – 0,127 нм, ионный Fe2+ – 0,078 нм, Fe3+ – 0,064 нм. Имеет две полиморфные модификации: a-железо (Fea) с ОЦК решеткой до 911 °С и выше 1392 °С g-железо (Feg) с ГЦК решеткой, существующее в интервале 911-1392 °С. Период решетки a-железа – 0,286 нм, g-железа – 0,365 нм. До температуры 768 °С (точка Кюри) железо ферромагнитное.Железо со многими элементами образует твердые растворы: с металлами – замещения, с углеродом, азотом и водородом – внедрения. Углерод – неметалл. Атомный радиус 0,077 нм; ковалентные радиусы: 0,077, 0,067 и 0,060 нм в одинарной, двойной и тройной связях; ионный радиус С4+ – 0,015 нм. Имеет модификации: графит –со слоистой решеткой, алмаз – с кубической решеткой и фуллерен. Плотность графита – 1,5-2,2 г/см3, температура возгонки – 3500 °С. У гексагонального α- графита атомы каждого слоя располагаются над и под центрами шестиугольников (рис. 2.12). Положение слоев повторяется через один. Каждый слой сдвинут относительно другого в горизонтальном направлении на 0,142 нм. У ромбоэдрического β- графита каждый четвертый слой повторяет первый; в чистом виде не встречается. Метод синтеза алмазов – взрыв графита со скоростью детонации 7-8 км/с, при давлении 20-30 ГПа (1 ГПа = 104 атм.), температура – около 4000 °С.
Цементит (Ц) – химическое соединение железа с углеродом (карбид железа Fe3C) содержит 6,69 % углерода. Решетка состоит из октаэдров (рис. 2.13,в), оси которых наклонены друг к другу. Температура плавления 1252 °С, точка Кюри – 210 °С, плотность – 7,82 г/см3. Цементит – метастабильная фаза: при нагревании разлагается на железо и углерод. Твердость – 800 НВ. Цементит первичный (ЦI) выделяется из жидкой фазы в виде крупных пластинчатых кристаллов, вторичный (ЦII) – из аустенита в виде сетки вокруг зерен аустенита (при дальнейшем охлаждении вокруг зерен перлита), третичный (ЦIII) – из феррита в виде мелких включений, но их химические и физические свойства одинаковы. Превращения в сплавах системы Fe – C. Сплавы железа, содержащие более 6,69 % углерода, не имеют практического применения. Рассматривается только левая часть диаграммы (рис. 2.14). Линия АСD – ликвидус системы, линия AECF – солидус. На линии АС начинается, а на линии АЕ заканчивается кристаллизация аустенита. На линии СD начинается кристаллизация цементита первичного. На линии ECF при постоянной температуре 1147 °С идет эвтектическое превращение: расплав с содержанием 4,3 % углерода превращается в эвтектическую смесь аустенита и цементита первичного: Ж®А+ЦI – ледебурит (Л4,3). На линии GS начинается, на линии PG заканчивается превращение аустенита в феррит, обусловленное полиморфным превращением Feγ®Fea. На линии ES начинается выделение ЦII из аустенита, обусловленное снижением предельной растворимости углерода в Feγ. На линии PSK при температуре 727 °С идет эвтектоидное превращение. Аустенит с 0,8 % углерода превращается в эвтектоидную смесь феррита и цементита вторичного: А0,8®Ф+ЦII – перлит (П0,8). Полированный, протравленный шлиф имеет перламутровый блеск.
Температуры, при которых происходят фазовые и структурные превращения в сплавах системы железо–цементит (критические точки), обозначают буквой А (от французского arret – остановка): А 1 – линия PSK (727 °С) – превращение П «А; A 2 – линия, соответствующая точке Кюри (768 °С); A 3 – линия GS (переменная температура, зависящая от содержания углерода в сплаве) – превращение Ф«А; Acm – линия SE – переменная температура, зависящая от содержания углерода в сплаве, – начало выделения ЦII (иногда обозначается A 3). При нагреве и охлаждении превращения совершаются при различных температурах. Для обозначения процесса нагревания добавляют букву (с) – Аc 1, охлаждения – букву (r) – А r 1. Структуры железоуглеродистых сплавов. Сплавы системы железо-цементит по содержанию углерода делятся на техническое железо, стали и чугуны. 1. Железо с содержанием углерода до 0,02 % называют техническим. Микроструктура сплава содержит зерна феррита при содержании углерода до 0,006 % (рис. 2.15,а). При увеличении углерода до 0,02 % по границам и внутри зерен феррита расположены зерна ЦIII.
3. Сплавы с содержанием углерода от 2,14 до 6,69 % кристаллизуются с образованием легкоплавкой эвтектики (ледебурита) и называются белыми чугунами. Они имеют высокую твердость и хрупкость, излом серебристо-белый. По количеству углерода и структуре белые чугуны (рис. 2.16) делятся на: доэвтектические, структура – П+Л+ЦII; эвтектические – Л; заэвтектические – Л+ЦI. Фазовый состав сталей и чугунов при нормальных температурах одинаков: феррит и цементит. Однако свойства сталей и белых чугунов значительно отличаются.
Углеродистые стали
Влияние примесей 1. Постоянные примеси: марганец, алюминий, кремний, сера, фосфор. Марганец, кремний и алюминий добавляют в сталь для раскисления при выплавке, они являются технологическими примесями. Содержание марганца и алюминия не превышает 0,5-0,8 %. Марганец повышает прочность. Алюминий дегазирует металл и повышает плотность слитка. Содержание кремния не превышает 0,4 %. Кремний растворяется в феррите и увеличивает предел текучести и предел прочности. Фосфор попадает в сталь при ее выплавке из чугуна. Содержание фосфора в сталях – 0,025-0,045 %. Растворяясь в феррите, он искажает кристаллическую решетку и увеличивает предел прочности, но снижает пластичность и вязкость; повышает температуру перехода стали в хрупкое состояние (20-25 °С на 0,01 % Р) – явление хладноломкости. Сера также попадает в сталь при ее выплавке из чугуна. Содержание серы в сталях – 0,025-0,06 %. Сера с железом образует сульфид FeS, который, в свою очередь, образует с железом (с аустенитом) легкоплавкую эвтектику (988 °С). При нагреве эвтектика плавится, нарушаются связи между зернами. При деформации в местах расположения эвтектики возникают надрывы и трещины, заготовка разрушается – явление красноломкости. Сера снижает ударную вязкость и пластичность, ухудшает свариваемость и коррозионную стойкость. 2. Скрытые примеси – газы (азот, кислород, водород) попадают в сталь при выплавке и находятся в раковинах и трещинах. Водород приводит к образованию флокенов – тонких трещин округлой формы серебристого цвета. Азот и кислород входят в виде неметаллических включений нитридов (Fe2N) и окислов (FeO, SiO2, Al2O3), которые являются концентраторами напряжений и снижают предел выносливости и вязкость; в виде твердых растворов, которые повышают порог хладоломкости и снижают сопротивление хрупкому разрушению. 3. Случайные примеси: хром, никель, вольфрам и др. попадают в сталь из металлического лома (скрапа) при выплавке.
|
||
|
Последнее изменение этой страницы: 2017-02-08; просмотров: 707; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.009 с.) |

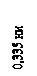
 Феррит (Ф) – твердый раствор внедрения углерода в a-железе (рис. 2.13,а). Минимальная растворимость углерода при комнатной температуре – 0,006% (точка Q на рис. 2.14), максимальная – 0,02 % при 727 °С (точка P). Выше 1392 °С существует высокотемпературный феррит с растворимостью углерода 0,1 % при 1499 °С. Свойства феррита близки к свойствам железа. Обладает малой твердостью (130 НВ), высокой пластичностью (d = 30 %), магнитен до температуры 768 °С.
Феррит (Ф) – твердый раствор внедрения углерода в a-железе (рис. 2.13,а). Минимальная растворимость углерода при комнатной температуре – 0,006% (точка Q на рис. 2.14), максимальная – 0,02 % при 727 °С (точка P). Выше 1392 °С существует высокотемпературный феррит с растворимостью углерода 0,1 % при 1499 °С. Свойства феррита близки к свойствам железа. Обладает малой твердостью (130 НВ), высокой пластичностью (d = 30 %), магнитен до температуры 768 °С. Аустенит (А) – твердый раствор углерода в g-железе (рис. 2.13,б) имеет минимальную растворимость углерода 0,8 % при 727 °С (точка S на рис. 2.14), максимальную – 2,14 % при 1147°С (точка Е). Аустенит прочнее феррита (твердость 250 НВ), парамагнитен.
Аустенит (А) – твердый раствор углерода в g-железе (рис. 2.13,б) имеет минимальную растворимость углерода 0,8 % при 727 °С (точка S на рис. 2.14), максимальную – 2,14 % при 1147°С (точка Е). Аустенит прочнее феррита (твердость 250 НВ), парамагнитен. На линии PQ начинается выделение ЦIII из феррита, т. к. уменьшается растворимость углерода в Fea при снижении температуры.
На линии PQ начинается выделение ЦIII из феррита, т. к. уменьшается растворимость углерода в Fea при снижении температуры. 2. Стали – сплавы железа с содержанием углерода 0,02-2,14 %. Они кристаллизуются с образованием аустенита. Микроструктура сталей формируется при перекристаллизации аустенита. По содержанию углерода и структуре стали делятся на: доэвтектоидные, структура – Ф+П (рис. 2.15, б); эвтектоидные, структура – П (рис. 2.15, в); заэвтектоидные, структура – П+ЦII, цементит располагается в виде сетки вокруг зерен перлита (рис. 2.15, г).
2. Стали – сплавы железа с содержанием углерода 0,02-2,14 %. Они кристаллизуются с образованием аустенита. Микроструктура сталей формируется при перекристаллизации аустенита. По содержанию углерода и структуре стали делятся на: доэвтектоидные, структура – Ф+П (рис. 2.15, б); эвтектоидные, структура – П (рис. 2.15, в); заэвтектоидные, структура – П+ЦII, цементит располагается в виде сетки вокруг зерен перлита (рис. 2.15, г).
 Углеродистые стали – сплавы железа с углеродом (стали) с общим содержанием остальных примесей не более 1 %. Свойства сталей определяются количеством углерода (рис. 2.17) и содержанием примесей, которые взаимодействуют с железом и углеродом. С ростом содержания углерода количество цементита увеличивается, феррита – уменьшается. Прочность сталей повышается до содержания углерода около 1 %, затем уменьшается, так как в структуре образуется грубая сетка цементита. Увеличение содержания углерода повышает порог хладноломкости, снижает ударную вязкость, ухудшает обрабатываемость давлением. Низкоуглеродистые стали при обработке резанием дают невысокое качество поверхности, но хорошо свариваются и штампуются в холодном состоянии.
Углеродистые стали – сплавы железа с углеродом (стали) с общим содержанием остальных примесей не более 1 %. Свойства сталей определяются количеством углерода (рис. 2.17) и содержанием примесей, которые взаимодействуют с железом и углеродом. С ростом содержания углерода количество цементита увеличивается, феррита – уменьшается. Прочность сталей повышается до содержания углерода около 1 %, затем уменьшается, так как в структуре образуется грубая сетка цементита. Увеличение содержания углерода повышает порог хладноломкости, снижает ударную вязкость, ухудшает обрабатываемость давлением. Низкоуглеродистые стали при обработке резанием дают невысокое качество поверхности, но хорошо свариваются и штампуются в холодном состоянии.


