
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основы теории двойных сплавовСодержание книги
Поиск на нашем сайте
В металловедении системами являются чистые металлы и металлические сплавы. Сплавы – твердые вещества, которые получают сплавлением двух или более веществ (компонентов). Возможны другие способы изготовления сплавов: спекание, электролиз, возгонка. Такие сплавы называют псевдосплавами. Структура сплава (микроструктура) – строение металлографического шлифа сплава, наблюдаемое при помощи микроскопа. Образец сплава шлифуется и полируется, затем поверхность шлифа обрабатывается (протравливается) раствором кислоты (для растворения границ раздела фаз и отдельных зерен). Ямки травления хорошо рассеивают свет и видны в металлографический оптический микроскоп в виде участков темного цвета.
Строение сплавов
Механические смеси образуются, если компоненты не вступают в химические реакции и не растворяются друг в друге в твердом состоянии. Механическая смесь (рис. 2.1) состоит из зерен компонентов А и В, имеющих собственные кристаллические решетки. Примеры таких сплавов: Be–Al, Si–Al, Pb–Sb.
Твердые растворы внедрения (рис. 2.2,а) образуются, когда атомы (ионы) растворенного вещества внедряются в междоузельные позиции решетки растворителя. Растворимость ограничена размерами промежутков между атомами решетки растворителя. Растворы внедрения образуются при сплавлении металлов с неметаллами, имеющими малый атомный (ионный) радиус (C, N, B, H). Если размеры атомов превышают размеры межатомных промежутков, то это вызывает искажение решетки и возникновение механических напряжений. Предельная концентрация таких растворов – не более 2-2,5 %. Твердые растворы замещения (см. рис. 2.2,б) образуются в том случае, когда размеры атомов (ионов) компонентов отличаются не более чем на 15 %. Атомы растворенного вещества замещают атомы растворителя в узлах кристаллической решетки. Если замещение осуществляется в случайных местах, то растворы называют неупорядоченными. Если размеры атомов растворенного элемента больше размеров растворителя, то решетка растягивается, если меньше – сжимается. В первом приближении изменение параметров решетки пропорционально концентрации растворенного компонента и определяет изменение механических свойств твердых растворов замещения. Уменьшение параметра решетки ведет к большему упрочнению, чем увеличение. Твердые растворы замещения бывают ограниченными и неограниченными. В последнем случае, компоненты должны иметь близкие атомные радиусы и одинаковый тип решетки. Неограниченная растворимость в твердом состоянии наблюдается в сплавах: Cu–Ni, Cu–Au, Si–Ge. Твердые растворы вычитания образуются в химических соединениях компонентов, в которых узлы кристаллической решетки не заняты полностью, то есть часть атомов как бы вычтена из кристаллической решетки и образуются вакансии. Появление вакансий связано, как правило, с присутствием ионов переменной валентности (Fe, Mn). Химические соединения компонентов – сплав, в котором сохраняется определенное соотношение атомов элементов, кристаллическая решетка, свойства сплава резко отличаются от строения и свойств чистых компонентов. Состав выражается формулой AnBm, где А и В – компоненты, n и m – целые числа. Химические соединения типа металл - неметалл. К ним относятся фазы с ионным типом связи и фазы внедрения. В первом случае в структуре сплава образуются неметаллические включения сульфидов, оксидов, фосфидов (FeS, MnO, Fe3P и т. д.). Фазы внедрения образуются как при сплавлении металлов с неметаллами, имеющими малый атомный радиус. В этом случае образуются карбиды, нитриды, бориды. Химические соединения металл - металл. Электронные соединения образуют одновалентные металлы (Cu, Na, Li) с металлами переходной группы (Fe, Mn, Co) и с металлами с валентностью от 2 до 5 (Al, Mg, Zn). Электронные соединения – фазы переменного состава, в которых отношение числа валентных электронов к числу атомов различно: 3/2 – b-фазы; 21/13 – g-фазы; 7/4 – e-фазы. Эти соединения характерны для сплавов на медной основе (латунь, бронза), где являются фазами упрочнителями. Фазы Лавеса имеют формулу АВ 2и образуются при соотношении радиусов атомов компонентов от 1,1 до 1,6 (обычно 1,2).
|
||||
|
Последнее изменение этой страницы: 2017-02-08; просмотров: 570; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.58.77.244 (0.01 с.) |

 Строение сплава, структура и окончательные свойства зависят от вида взаимодействия компонентов сплава при кристаллизации. Металлы в жидком состоянии хорошо растворяются друг в друге, в твердом могут образовать механические смеси, твердые растворы, химические соединения.
Строение сплава, структура и окончательные свойства зависят от вида взаимодействия компонентов сплава при кристаллизации. Металлы в жидком состоянии хорошо растворяются друг в друге, в твердом могут образовать механические смеси, твердые растворы, химические соединения.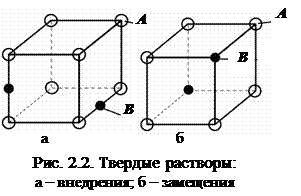 Твердые растворы образуются, когда компоненты частично или полностью растворяются друг в друге (рис. 2.2). Первый компонент (А) образует собственную кристаллическую решетку, а второй (В) – присутствует в виде отдельных атомов и собственной решетки не имеет.
Твердые растворы образуются, когда компоненты частично или полностью растворяются друг в друге (рис. 2.2). Первый компонент (А) образует собственную кристаллическую решетку, а второй (В) – присутствует в виде отдельных атомов и собственной решетки не имеет.


