
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Строение и свойства материаловСтр 1 из 17Следующая ⇒
Классификация материалов Материал – вещество (совокупность веществ), из которого изготовлено техническое изделие, имеющее функциональное значение. Конструкционные материалы – материалы, из которых изготовляются детали машин, конструкций, работающих под нагрузкой. Эти материалы классифицируются: по природе – на металлические, неметаллические и композиционные и др.; по технологическому признаку – на деформируемые, литые, спекаемые, свариваемые и др.; по условиям работы – на работающие при низких температурах, жаропрочные, коррозионностойкие, износостойкие и др.; по прочности – на материалы малой, средней и высокой прочности. Металлические материалы классифицируются: по системам сплавов – на алюминиевые, медные, никелевые сплавы, сплавы на железной основе и др.; по типу упрочнения – на закаливаемые, цементуемые, азотируемые и др.; по структурному составу – на однофазные, двухфазные, многофазные. Черные металлы – железо и сплавы (стали, чугуны) с содержанием железа не менее 50 %. Цветные – металлы и их сплавы, имеющие естественную окраску (медь, алюминий, титан и др.). Благородные – золото, серебро, платина и др. Редкоземельные – лантан, неодим, празеодим и др. Неметаллические материалы подразделяют по изомерному составу и технологическому исполнению (прессованные, тканые, намотанные, формованные и др.), по типам наполнителей (армирующих элементов) и характеру их размещения и ориентации. Пластмассы – материалы на основе высокомолекулярных соединений – полимеров, чаще всего с добавками. Керамические материалы (керамики) – порошки тугоплавких соединений: карбиды, окислы, нитриды, бориды. Керамико-металлические – керамики с добавлением металлической связки. Стекла – окислы различных элементов. Резина – материал на основе каучука – углеродно-водородного полимера с добавлением серы и других элементов. Древесина – органическая ткань древесных растений. Композиционные материалы состоят из металлической или неметаллической матрицы (основы) с заданным распределением в ней упрочнителей (волокон, дисперсных частиц и др.). Подразделяются на: дисперсноупрочненные, полученные введением в металлическую матрицу дисперсных частиц упрочнителей; волокнистые, упрочненные непрерывными волокнами и нитевидными кристаллами; слоистые, созданные путем прессования, прокатки разнородных материалов.
Рождение материала происходит в направлении усложнения структуры (рис. 1.1) и отражает определенные уровни его строения. Вещества состоят из атомов и молекул. Атом состоит из ядра и электронов. Силы, связывающие электроны и атомные ядра в атомах, атомы в молекулах, имеют электромагнитную природу. Движущими силами объединения частиц вещества (твердого, жидкого, газообразного) являются силы взаимного притяжения и отталкивания. Процесс рождения материала осуществляется в направлении плазма ® газ ® жидкость ® твердое тело (атом ® молекула ® вещество) на каждом этапе сопровождается уменьшением энергии системы, и поэтому развивается самопроизвольно. Наибольшим запасом энергии вещество обладает в состоянии плазмы. При разрушении (диспергировании) вещества процесс идет в обратном направлении и сопровождается поглощением энергии.
Система – группа тел, выделяемых для наблюдения и изучения. Компоненты – минимальное число химически различимых веществ, образующих систему (чистые вещества и химические соединения). Фаза –совокупностьоднородных частей системы, отделенных от других частей поверхностью раздела, при переходе через которую свойства, структура и химический состав резко изменяются. Твердое тело является одним из агрегатных состояний вещества. Оно отличается от других агрегатных состояний (жидкости, газов, плазмы) стабильностью формы. Твердые тела могут бытьаморфными и кристаллическими. Аморфное твердое тело можно рассматривать как жидкость с очень большой вязкостью. У кристаллических тел, в отличие от аморфных, присутствует дальний порядок в расположении атомов. Классификация твердых тел по типу связи. Химическая связь образуется за счет электростатического взаимодействия между заряженными частицами: катионами и анионами, ядрами и электронами. Энергия химической связи неодинакова для разных твердых тел. Химические связи в кристаллах подразделяются на ковалентные, ионные, металлические и молекулярные. Ионная связь возникает в результате полного или частичного обмена валентными электронами, ковалентная – при частичном обмене. Металлическая связь по природе ковалентная, но обобществляется множество электронов. Силы Ван-дер-Ваальса возникают без обмена зарядами.
Ковалентная (гомеополярная) связь возникает между нейтральными соседними атомами за счет перекрытия их электронных облаков. Обычно она осуществляется двумя электронами с противоположно направленными спинами. В пространстве между ядрами атомов электроны создают состояния с повышенной электронной плотностью. Образовавшийся отрицательный заряд между ядрами стремится приблизить их. Если электронная плотность расположена симметрично между атомами, то ковалентная связь называется неполярной. Если электронная плотность смещена в сторону одного из атомов, то ковалентная связь называется полярной. Одно из существенных свойств ковалентной связи – насыщаемость. При ограниченном числе внешних электронов между ядрами образуется ограниченное число электронных пар вблизи каждого атома (ограниченное число химических связей). Другое важное свойство ковалентной связи – направленность в пространстве. Это проявляется в примерно одинаковом геометрическом строении близких по составу химических частиц. Особенность ковалентной связи – поляризуемость. Энергия ковалентной связи – сотни килоджоулей на моль. Ковалентные кристаллы – в основном полупроводники и диэлектрики. Ионная связь образуется за счет кулоновского (электростатического) взаимодействия противоположно заряженных ионов. Такую связь называют ионной или гетерополярной. Взаимодействие между катионами и анионами не зависит от направления. Об ионной связи говорят как о ненаправленной. Каждый катион может притягивать любое число анионов, и наоборот. Ионная связь является ненасыщенной. Число взаимодействий между ионами в твердом состоянии ограничивается лишь размерами кристалла. В ионных кристаллах не существует отдельных молекул. «Молекулой» ионного соединения следует считать весь кристалл. Например, в кристалле поваренной соли NaCl каждый положительно (отрицательно) заряженный ион натрия (хлора) окружен соответствующим числом отрицательно (положительно) заряженных ионов хлора (натрия). Ионная связь – сильная связь с энергией от сотен до десятков тысяч килоджоулей на моль. Поэтому твердые тела с ионной связью имеют высокие температуры плавления. Ионные кристаллы – в основном диэлектрики, прозрачны в широком диапазоне частот. Идеальной ионной связи практически не существует. Даже в тех соединениях, которые относят к ионным, не происходит полного перехода электронов от одного атома к другому и электроны частично остаются в общем пользовании. Так, связь в кристалле фторида лития LiF на 80 % ионная, на 20 % – ковалентная. Поэтому правильнее говорить о степени ионности (полярности) ковалентной химической связи. Металлическая связь. Атомы металлов отличаются от атомов других элементов тем, что слабо удерживают свои внешние электроны. В кристаллической решетке металла эти электроны покидают свои атомы, превращая их в положительно заряженные ионы. Связь возникает вследствие взаимодействия положительных ионов решетки с электронным газом: электроны, находящиеся между ионами стремятся приблизить их друг к другу, уравновешивая силы отталкивания. Межатомные расстояния в металлах больше, чем в их соединениях с ковалентной связью. Энергия металлической связи сравнима с энергией ковалентной связи. Благодаря наличию свободных, не связанных с определенными атомами электронов, металлы хорошо проводят электрический ток и тепло. При нагревании металла колебания катионов усиливаются. Электронам труднее продвигаться между ними, поэтому электрическое сопротивление металла увеличивается.
Металлическая связь существует не только в твердых кристаллах металлов, но и расплавах и аморфном состоянии. Металлическая связь имеет признаки, характерные как для ковалентной, так и для ионной связи. В кристаллах металлов атомы ионизированы не полностью, часть валентных электронов остается связанной. В результате возможно появление ковалентных связей между соседними атомами. Вклады ионной и ковалентной составляющей обнаружены во многих металлах. Молекулярная связь. Взаимодействие молекул между собой не приводит к разрыву или образованию новых химических связей. В их основе также лежат электрические взаимодействия. В узлах кристаллической решетки находятся определенным образом ориентированные нейтральные молекулы. Они связаны слабыми ван-дер-ваальсовыми силами, которые включают все виды межмолекулярного притяжения и отталкивания. Полярные молекулы, в которых центры тяжести положительного и отрицательного зарядов не совпадают (HCl, H2O, NH3), ориентируются так, чтобы рядом находились концы с противоположными зарядами. Между ними возникает ориентационное взаимодействие – притяжение. Индукционное взаимодействие возникает между полярными и неполярными молекулами. Неполярная молекула становится полярной (поляризуется), молекулы начинают притягиваться друг к другу, только слабее, чем в случае полярных молекул. Дисперсионное взаимодействи е возникает между неполярными молекулами. Находясь в постоянном движении, электроны создают состояния с повышенной электронной плотностью с одной стороны молекулы, т. е. неполярная молекула станет полярной. Это вызывает перераспределение зарядов в соседних молекулах, между ними устанавливаются кратковременные связи. Если бы молекулы только притягивались друг к другу, то это привело бы к их слиянию. Но на очень малых расстояниях их электронные оболочки начинают отталкиваться – межмолекулярное отталкивание.
Типичные кристаллы с молекулярной связью – O2, N2, CO2, H2O в твердом состоянии (при низких температурах). В электрическом отношении молекулярные кристаллы являются диэлектриками.
Кристаллическое строение Материалов
Кристаллы – твердые тела, обладающие трехмерной периодической атомной (молекулярной) структурой и имеющие форму правильных симметричных многогранников (рис. 1.2).
В металлах отсутствуют направленные связи, т. к. валентные электроны принадлежат всему кристаллу. Это и определяет высокую симметрию и компактность структур большинства металлических кристаллов. Наиболее распространены следующие кристаллические структуры. Гранецентрированная кубическая решетка. Атомы находятся в вершинах куба и центре каждой грани. Решетку имеют: Feg, Cu, Al, Ni. Объемноцентрированная кубическая решетка. Атомы находятся в вершинах и центре куба – на пересечении его главных диагоналей. Такую решетку имеют: Fea, Cr, W, V, Mo. Гексагональная плотноупакованная решетка. Атомы находятся в вершинах и центрах шестиугольников; центрах боковых граней, чередуясь через грань. Такую решетку имеют: Zn, Mg, Cd, Be. Тетрагональная решетка бывает объемно- и гранецентрированной. Такую решетку имеют: In, b-Sn, B. У некоторых металлов (Fe, Ti и др.) кристаллическая структура при изменении температуры может изменяться – явление полиморфизма. Кристаллографические плоскости и направления. Плотность упаковки атомов в разных плоскостях и по разным направлениям неодинаковая. Поэтому свойства кристалла в разных направлениях неодинаковы – явление анизотропии. Чтобы понять явление анизотропии, необходимо обозначить плоскости и направления в кристалле. Плоскости или прямые, проведенные в кристаллической решетке через ее узлы (атомы), называются кристаллографическими плоскостями или направлениями.
Для обозначения кристаллографических плоскостей и направлений пользуются индексами Миллера. Чтобы установить индексы Миллера, элементарную ячейку кристалла вписывают в пространственную систему координат (рис. 1.4). Оси координат x, y, z называются кристаллографическими осями. За единицу измерения вдоль каждой оси принимается период решетки, т. е. длина ребер элементарной ячейки.
Пример 1. Плоскость отсекает на осях координат (x, y, z) отрезки 1, 1/2, 1/3 (см. рис. 1.4). Обратные величины: 1, 2, 3. Это целые числа. Символ плоскости – (123). Следует читать: один, два, три. Пример 2. Плоскость отсекает на осях координат отрезки 4, 3, 2. Обратные величины: Все параллельные плоскости имеют одинаковые индексы. Если плоскость пересекает ось в области отрицательных значений координат, то соответствующий индекс будет отрицательным и знак минус ставится над индексом. Плоскость, параллельная какой-либо координатной оси, имеет по этой оси индекс нуль, так как 1/∞ = 0. Зная индексы (hkl) плоскости, можно подсчитать межплоскостное расстояние d между плоскостями данного семейства для кубических кристаллов с периодом решетки a по формуле
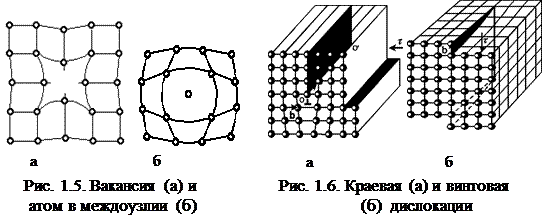
Индексы кристаллографических направлений (рис. 1.4). Индексы направления представляют собой три наименьших целых числа, характеризующих положение ближайшего узла, лежащего на данном направлении. Ориентация прямой определяется координатами двух ее точек. При определении индексов направлений необходимо, чтобы одна точка направления совпадала с началом координат. Затем необходимо установить координаты второй точки, в единицах периода решетки. Далее остается привести отношения этих координат к отношению трех наименьших целых чисел (обратные величины при вычислении не рассматриваются). Заключив полученные числа в квадратные скобки, получим индексы кристаллографического направления. Дефекты кристаллического строения. В кристаллах всегда имеются дефекты, оказывающие влияние на их свойства. Точечные дефекты. Вакансии – отсутствие атомов в узлах решетки. Атомы внедрения – внедрение своих или чужих (примесных) атомов в свободное пространство между атомами решетки основы. Атомы замещения – замещение атомов в узлах решетки чужими атомами. Около дефектов всегда возникают локальные искажения решетки (рис. 1.5). Линейные дефекты. Краевая дислокация – лишняя атомная полуплоскость, вставленная в какой-то части кристалла (рис. 1.6,а). Винтовая дислокация (рис. 1.6,б) может быть получена при помощи сдвигающего напряжения t, которое нарушает параллельность атомных слоев. Кристалл превращается в плоскость, закрученную по винту. В отличие Плотность дислокаций (r) – суммарная длина дислокаций в 1 см3 –определяет пластичность и прочность материала. Монокристаллы, нитевидные кристаллы или «усы» (длина 2-10 мм, толщина 0,5-2 мкм) не содержат дислокации, их прочность близка к теоретической прочности железа 20000 МПа (рис. 1.7). Прочность нормальных (отожженных) металлов – 300 МПа при r = 106-108 см-2 после холодной деформации увеличивается до 1500 МПа при плотности дислокаций 1012 см-2, что соответствует 106 км дислокаций в 1 см3.
Создание материала с идеальной кристаллической решеткой. Реализация этого пути представляет большие трудности. Упрочнение материала дефектами. Это направление осуществляют пластическим деформированием, термообработкой и т. д. Поверхностные и объемные дефекты – границы зерен, фрагментов и блоков, неметаллические включения, поры. Границы между зернами одной фазы. Металл состоит из кристаллов (зерен) размером от 1 до 1000 мкм. Если углы разориентации (b) между зернами составляют несколько десятков градусов, то говорят, что зерна разделяет большеугловая граница (рис. 1.8,б). Она представляет собой зону шириной 5-15 межатомных расстояний с нарушением порядка в расположении атомов. Скопление в этой зоне дислокаций и примесей оказывает существенное влияние на механические свойства металла. Зерна состоят из более мелких (0,1-1 мкм) блоков (субзерен), разориентированных относительно друг друга на небольшие углы (менее пяти градусов). Границу между фрагментами, блоками называют малоугловой (рис. 1.8,а). Процесс деления зерен на фрагменты называется фрагментацией или полигонизацией. Структуру называют блочной или мозаичной.
Когерентные частицы – выделения в твердом растворе (матрице) с когерентной границей раздела между ними и матрицей. Строение поверхности металла. Структура, фазовый и химический состав поверхностного слоя детали отличаются от основного материала, из которого она сделана (рис. 1.10). Зона 1 состоит из адсорбированных из окружающей среды атомов и молекул органических и неорганических веществ. Толщина слоя Пути упрочнения материала. Прочностные свойства металла зависят от сил межатомных связей и препятствий – барьеров, которые приходится преодолевать движущимся дислокациям. Упрочнение за счет торможения дислокаций точечными дефектами решетки (упрочнение твердым раствором). Эффективность механизма определяется количеством точечных дефектов (собственных и примесных). Около дефектов имеются локальные искажения решетки: чем они больше, тем выше сопротивление деформации. Упрочнение за счет увеличения количества дислокаций. В реальном металле имеется большое количество дислокаций, расположенных в разных плоскостях («лес» дислокаций). Среди них могут быть малоподвижные и неподвижные дислокации, скопления дислокаций. При пластической деформации движущимся дислокациям приходится преодолевать расположенные на их пути «леса» дислокаций. Чем больше дислокаций, тем выше сопротивление деформации. Упрочнение за счет торможения дислокаций дисперсными частицами. В структуре сплавов могут находиться дисперсные (мелкие) частицы какой-либо фазы: карбиды (Fe3C, Сr7С3, TiC, Fe3W3C и др.), интерметаллические соединения (Со7W6, СuАl2 и др.), окислы (SiO2, Аl2O3). Эти частицы являются барьерами для движущихся дислокаций. Механизмы преодоления дислокациями дисперсных частиц: перерезание (прохождение через частицы) и прохождение между ними. Упрочнение за счет торможения дислокаций границами зерен, фрагментов и блоков. На этих границах скапливаются дефекты решетки. Дислокации не могут переходить через границу и начинают тормозиться. Дополнительное напряжение, необходимое для пластической деформации, с учетом преодоления дислокациями границ, обратно пропорционально диаметру зерна. Мелкозернистый металл обладает более высоким сопротивлением деформации, чем крупнозернистый. Кристаллизация металлов Энергетическое состояние любой системы характеризуется запасом внутренней энергии, которая складывается из энергии движения атомов (ионов), электронов, энергии упругих искажений кристаллической решетки и т. д. Часть энергии, которая при изотермических условиях может быть превращена в работу, называется свободной: F = U – T × S, где F – свободная энергия, U – полная внутренняя энергия, T – температура; S – энтропия. Чем больше свободная энергия, тем менее устойчива система. Любое вещество может находиться в твердом, жидком или газообразном агрегатных состояниях. Переход в новое состояние возможен, только если оно обладает меньшим запасом свободной энергии. С ростом температуры свободная энергия F металла в жидком и твердом состояниях, уменьшается (рис. 1.11): dF / dT = – S. Выше равновесной или теоретической температуры (Т р) кристаллизации металл находится в жидком состоянии, ниже – в твердом.
При равновесной температуре Т р процесс кристаллизации не происходит. При медленном охлаждении, например, со скоростью V 1 кристаллизация протекает при высокой температуре, близкой к равновесной (см. рис. 1.12). Т. е. при небольшой степени переохлаждении, например, до температуры Т 1 (см. рис. 1.13) число центров кристал С увеличением скорости охлаждения (степени переохлаждения) кристаллизация протекает при более низкой температуре. Центров кристаллизации много, скорость роста кристаллов увеличивается, и образуются мелкие зерна. При больших скоростях охлаждения (большой степени переохлаждении) число центров кристаллизации и скорость роста кристаллов равны нулю, образуется аморфная структура – металлическое стекло.
Процесс искусственного регулирования размеров зерен за счет добавления веществ (модификаторов) называется модифицированием. Нерастворимые модификаторы служат дополнительными центрами кристаллизации, растворимые – осаждаются на поверхности растущих кристаллов и препятствуют их дальнейшему росту. В качестве модификаторов для алюминиевых сплавов используют титан, ванадий, цирконий, для стали – алюминий, титан и ванадий, для чугуна – магний, церий.
При охлаждении сплав уменьшается в объеме, верхняя корка прогибается, под ней образуется усадочная раковина, заполненная газами. Под раковиной сплав имеет рыхлую структуру, так как жидкий металл стекает вниз для заполнения пустот между кристаллами. Эта часть слитка (около 15-20 % от длины) подлежит отрезке и переплавке.
|
|||||||||
|
Последнее изменение этой страницы: 2017-02-08; просмотров: 2654; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.140.185.147 (0.045 с.) |
 Любой материал есть сложная физико-химическая система. В металловедении системами являются металлы и металлические сплавы.
Любой материал есть сложная физико-химическая система. В металловедении системами являются металлы и металлические сплавы. В реальных кристаллах рассмотренные выше связи в чистом виде встречаются редко. Практически всегда имеет место наложение связей. Одна из них имеет превалирующее значение, определяя структуру и свойства твердого тела.
В реальных кристаллах рассмотренные выше связи в чистом виде встречаются редко. Практически всегда имеет место наложение связей. Одна из них имеет превалирующее значение, определяя структуру и свойства твердого тела. Кристаллическая структура – периодически повторяющаяся в пространстве элементарная часть кристаллической решетки (элементарная ячейка). Параметры элементарной ячейки: a, b, c – периоды решетки – расстояние между центрами ближайших атомов; углы между кристаллографическими осями – a, b, g; координационное число – количество атомов, расположенных на ближайшем одинаковом расстоянии от любого атома; базис решетки – количество атомов в элементарной ячейке (величина базиса и координационное число решетки могут не совпадать); плотность упаковки – отношение объема, занятого атомами к объему ячейки. В зависимости от соотношения между величинами a, b, с и a, b, g различают семь кристаллических структур (рис. 1.3).
Кристаллическая структура – периодически повторяющаяся в пространстве элементарная часть кристаллической решетки (элементарная ячейка). Параметры элементарной ячейки: a, b, c – периоды решетки – расстояние между центрами ближайших атомов; углы между кристаллографическими осями – a, b, g; координационное число – количество атомов, расположенных на ближайшем одинаковом расстоянии от любого атома; базис решетки – количество атомов в элементарной ячейке (величина базиса и координационное число решетки могут не совпадать); плотность упаковки – отношение объема, занятого атомами к объему ячейки. В зависимости от соотношения между величинами a, b, с и a, b, g различают семь кристаллических структур (рис. 1.3). Индексы кристаллографических плоскостей. Чтобы найти индексы плоскости простой кубической решетки, нужно: 1) установить координаты точек пересечения плоскости с осями координат, измеренные в постоянных решетки а, в, с; 2) взять обратные значения этих чисел; 3) привести их к общему знаменателю); 4) отбросить общие знаменатели и заключить в скобки числители этих дробей, переписанные по порядку. Это и будут индексы Миллера (hkl).
Индексы кристаллографических плоскостей. Чтобы найти индексы плоскости простой кубической решетки, нужно: 1) установить координаты точек пересечения плоскости с осями координат, измеренные в постоянных решетки а, в, с; 2) взять обратные значения этих чисел; 3) привести их к общему знаменателю); 4) отбросить общие знаменатели и заключить в скобки числители этих дробей, переписанные по порядку. Это и будут индексы Миллера (hkl).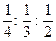 . Приведение к общему знаменателю:
. Приведение к общему знаменателю:  . Символ плоскости – (346).
. Символ плоскости – (346). .
. от краевой, точечные дефекты к винтовой дислокации не стекают.
от краевой, точечные дефекты к винтовой дислокации не стекают.
 Пути повышения прочности.
Пути повышения прочности. Межфазные границы – границы между кристаллами, принадлежащим разным фазам. Различают три типа межфазных границ (рис. 1.9). На когерентной границе решетка одной фазы плавно переходит в решетку другой. Несоответствие решеток обусловливает упругую деформацию, изгиб атомных плоскостей на границе. На полукогерентной границе дислокации чередуются с участками сопряжения решеток двух фаз. При большом несоответствии решеток двух фаз, плавное их сопряжение невозможно, межфазную границу называют некогерентной.
Межфазные границы – границы между кристаллами, принадлежащим разным фазам. Различают три типа межфазных границ (рис. 1.9). На когерентной границе решетка одной фазы плавно переходит в решетку другой. Несоответствие решеток обусловливает упругую деформацию, изгиб атомных плоскостей на границе. На полукогерентной границе дислокации чередуются с участками сопряжения решеток двух фаз. При большом несоответствии решеток двух фаз, плавное их сопряжение невозможно, межфазную границу называют некогерентной. 0,001-1 мкм. Зона 2 состоит из продуктов химического взаимодействия металла с окружающей средой (обычно оксидов). Толщина слоя 1-10 мкм. Переходная зона 3 толщиной несколько межатомных расстояний, имеет иную, чем в объеме, кристаллическую структуру. Зона 4, с измененной по сравнению с основным металлом 5 структурой, фазовым и химическим составом, возникает при изготовлении детали и изменяется в процессе эксплуатации. Толщина и состояние поверхностного слоя может изменяться в зависимости от состава материала, метода обработки, условий эксплуатации.
0,001-1 мкм. Зона 2 состоит из продуктов химического взаимодействия металла с окружающей средой (обычно оксидов). Толщина слоя 1-10 мкм. Переходная зона 3 толщиной несколько межатомных расстояний, имеет иную, чем в объеме, кристаллическую структуру. Зона 4, с измененной по сравнению с основным металлом 5 структурой, фазовым и химическим составом, возникает при изготовлении детали и изменяется в процессе эксплуатации. Толщина и состояние поверхностного слоя может изменяться в зависимости от состава материала, метода обработки, условий эксплуатации. При температуре Т р свободные энергии жидкой и твердой фаз одинаковы. Изменения энергии не происходит (D F = F ж – F т = 0), обе фазы сосуществуют одновременно. Фактически кристаллизация начинается при практической температуре (Т пр) кристаллизации. Охлаждение расплава ниже равновесной температуры называют переохлаждением ихарактеризуют степенью переохлаждения: D T = Т р– Т пр.
При температуре Т р свободные энергии жидкой и твердой фаз одинаковы. Изменения энергии не происходит (D F = F ж – F т = 0), обе фазы сосуществуют одновременно. Фактически кристаллизация начинается при практической температуре (Т пр) кристаллизации. Охлаждение расплава ниже равновесной температуры называют переохлаждением ихарактеризуют степенью переохлаждения: D T = Т р– Т пр.




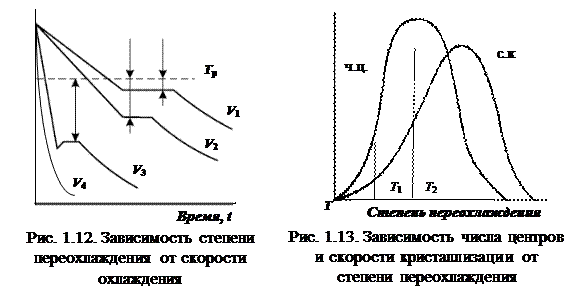 лизации мало, скорость роста кристаллов минимальна, и образуются крупные зерна.
лизации мало, скорость роста кристаллов минимальна, и образуются крупные зерна. Механизм кристаллизации. Около температуры плавления в жидком металле образуются скопления атомов, которые называют центрами кристаллизации или зародышами (рис. 1.14). Для их образования и роста необходимо уменьшение свободной энергии металла, в противном случае они растворяются. Минимальный размер способного к росту зародыша называется критическим, зародыш – устойчивым. Зародыши образуются независимо друг от друга. Растущие кристаллы имеют правильную форму. При срастании с другими кристаллами форма нарушается. Рост кристаллов продолжается в направлениях оставшихся участков жидкого металла.
Механизм кристаллизации. Около температуры плавления в жидком металле образуются скопления атомов, которые называют центрами кристаллизации или зародышами (рис. 1.14). Для их образования и роста необходимо уменьшение свободной энергии металла, в противном случае они растворяются. Минимальный размер способного к росту зародыша называется критическим, зародыш – устойчивым. Зародыши образуются независимо друг от друга. Растущие кристаллы имеют правильную форму. При срастании с другими кристаллами форма нарушается. Рост кристаллов продолжается в направлениях оставшихся участков жидкого металла. Строение металлического слитка. Кристаллизация на поверхности происходит в условиях сильного переохлаждения (рис. 1.15,а). Образуется много зародышей, сплав имеет мелкозернистую структуру с произвольно ориентированными кристаллами. Жидкий металл под коркой находится в условиях меньшего переохлаждения. Рост кристаллов происходит в направлении, обратном направлению теплоотвода – перпендикулярно стенкам изложницы. Это оси роста первого порядка. На них под определенными углами формируются поперечные оси роста второго порядка. На них оси третьего порядка и т. д. Так формируются древовидные кристаллы (рис. 1.15,б) – дендриты, образующие зону столбчатых кристаллов. Центральная часть дендрита (оси первого порядка) обогащена тугоплавкими компонентами, периферийная – легкоплавкими. Неоднородность химического состава сплава называют внутрикристаллической (дендритной) ликвацией. Теплоотвод от жидкого металла в центре слитка происходит равномерно, степень переохлаждения минимальна. В этой зоне образуются крупные кристаллы с произвольной ориентацией.
Строение металлического слитка. Кристаллизация на поверхности происходит в условиях сильного переохлаждения (рис. 1.15,а). Образуется много зародышей, сплав имеет мелкозернистую структуру с произвольно ориентированными кристаллами. Жидкий металл под коркой находится в условиях меньшего переохлаждения. Рост кристаллов происходит в направлении, обратном направлению теплоотвода – перпендикулярно стенкам изложницы. Это оси роста первого порядка. На них под определенными углами формируются поперечные оси роста второго порядка. На них оси третьего порядка и т. д. Так формируются древовидные кристаллы (рис. 1.15,б) – дендриты, образующие зону столбчатых кристаллов. Центральная часть дендрита (оси первого порядка) обогащена тугоплавкими компонентами, периферийная – легкоплавкими. Неоднородность химического состава сплава называют внутрикристаллической (дендритной) ликвацией. Теплоотвод от жидкого металла в центре слитка происходит равномерно, степень переохлаждения минимальна. В этой зоне образуются крупные кристаллы с произвольной ориентацией.


